Sustituto óseo, y procedimiento para su preparación.
Material sintético que comprende una fase orgánica (I) y una fase mineral (II),
caracterizado por que:
- la fase orgánica (I) comprende unas fibrillas estriadas de colágeno constituidas por unas triples hélices de colágeno I y en las que la periodicidad de las estriaciones es de 67 nm, estando dichas fibrillas ordenadas a gran distancia según una geometría 3D que asocia unos campos alineados y unos campos colestéricos, así como unos campos isotrópicos en los que no están ordenadas;
- la fase mineral (II) comprende unos cristales de apatita de estructura cristalina hexagonal, grupo de espacio 6/m, comprendiendo dichos cristales por lo menos unos iones calcio y por lo menos unos iones fosfato;
- el eje c de dichos cristales de apatita de la fase mineral está coalineado con el eje longitudinal de las fibrillas estriadas de colágeno de la fase orgánica;
- el contenido en colágeno en el seno de dicho material es de por lo menos 75 mg/cm3.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/FR2009/051233.
Solicitante: UNIVERSITE PIERRE ET MARIE CURIE - PARIS 6 .
Nacionalidad solicitante: Francia.
Dirección: 4, Place Jussieu 75005 Paris FRANCIA.
Inventor/es: NASSIF,NADINE, GOBEAUX,FRÉDÉRIC, GIRAUD GUILLE,MARIE MADELEINE, MOSSER,GERVAISE.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61L27/12 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61L PROCEDIMIENTOS O APARATOS PARA ESTERILIZAR MATERIALES U OBJECTOS EN GENERAL; DESINFECCION, ESTERILIZACION O DESODORIZACION DEL AIRE; ASPECTOS QUIMICOS DE VENDAS, APOSITOS, COMPRESAS ABSORBENTES O ARTICULOS QUIRURGICOS; MATERIALES PARA VENDAS, APOSITOS, COMPRESAS ABSORBENTES O ARTICULOS QUIRURGICOS (conservación de cuerpos o desinfección caracterizada por los agentes empleados A01N; conservación, p. ej. esterilización de alimentos o productos alimenticios A23; preparaciones de uso medico, dental o para el aseo A61K). › A61L 27/00 Materiales para prótesis o para revestimiento de prótesis (prótesis dentales A61C 13/00; forma o estructura de las prótesis A61F 2/00; empleo de preparaciones para la fabricación de dientes artificiales A61K 6/80; riñones artificiales A61M 1/14). › Materiales que contienen fósforo, p. ej. apatito.
PDF original: ES-2509896_T3.pdf

Fragmento de la descripción:
Sustituto óseo, y procedimiento para su preparación.
La presente invención se refiere a un sustituto óseo y a un procedimiento para su preparación.
El hueso es un material híbrido constituido principalmente por unas células, el colágeno de tipo I que constituye una trama orgánica proteica y una fase mineral constituida por cristales de hidroxiapatita de tamaño nanométrico. Esta asociación orgánico/mineral a gran escala en tres dimensiones confiere al mismo tiempo la elasticidad y la dureza del tejido óseo, permitiéndole así resistir a las fuerzas que le son aplicadas. El hueso es por lo tanto duro, denso y muy resistente.
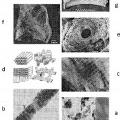
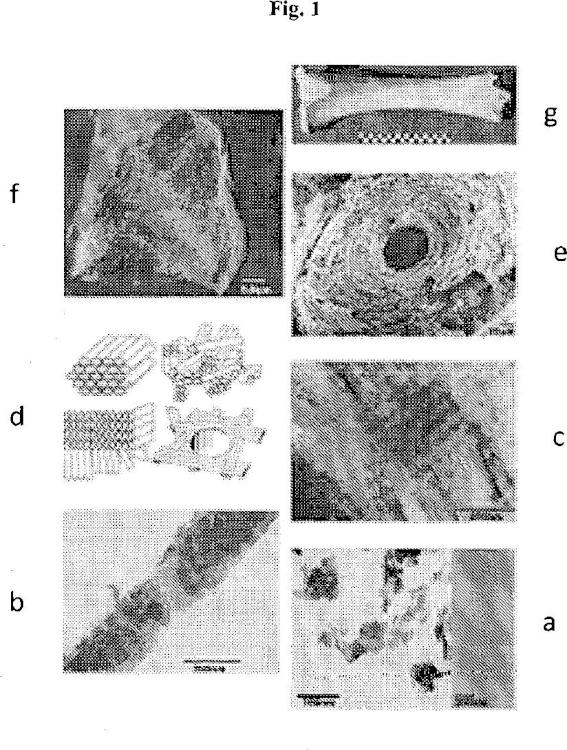
Se ha propuesto por Weiner & Wagner (Ann. Rev. Mater. Sci. 28, 271-298, 1998) una descripción de una organización jerarquizada a diferentes escalas, que se descompone en siete niveles descritos como sigue y que están ¡lustrados por la figura 1 adjunta:
- Nivel 1 (figura 1a): los dos componentes principales de base constitutivos del hueso, es decirlas plaquetas de hidroxiapatita y las fibrillas estriadas de colágeno, constituyen el primer nivel jerárquico de organización. Se trata del nivel más bajo de organización, a escala del nanómetro. La fase apatita está caracterizada en particular por la presencia de planos Ínter-reticulares característicos tales como (2) y (3). Los cristales de apatita, a este nivel de organización, no poseen ninguna orientación particular. Las fibrillas de colágeno están caracterizadas por una estriación periódica visible en microscopio electrónico y que resultan del ensamblaje de las moléculas de colágeno I que induce un desplazamiento periódico de 67 nm;
- Nivel 2 (figura 1b): la coalineación de las plaquetas de hidroxiapatita según su eje c a lo largo del eje principal de las fibrillas estriadas de colágeno constituye el segundo nivel, es decir que los planos inter-reticulares (2) de la apatita están orientados perpendicularmente al eje principal de las fibrillas y por lo tanto, según la periodicidad axial (es decir según las estriaciones) de las fibrillas de colágeno (estriación = 67 nm). Se habla de fibrillas mineralizadas de colágeno (anchura de 1 a 3 nanómetros). El nivel 2 se sitúa también a escala del nanómetro;
Nivel 3 (figura 1c): varias fibrillas mineralizadas de colágeno están ensambladas lado a lado en haces paralelos, formando una fibra mineralizada de colágeno (anchura de 1 a 3 micrones). La escala del micrómetro se alcanza en el nivel 3 de organización;
Nivel 4 (figura 1d): es complejo, ya que las fibrillas o bien las fibras mineralizadas de colágeno pueden organizarse en tres dimensiones. En efecto, se distingue a este nivel la coexistencia de campos en los que las fibrillas/fibras están alineadas según una dirección preferencial sobre una gran distancia y/o forman unas estructuras en arcos características de su apilamiento según una geometría denominada colestérica. Se distinguen también unos campos en los que las fibrillas/fibras no se organizan (campos denominados isótropos). La escala varía del micro al milímetro;
- Nivel 5 (figura 1 e): el hueso compacto presenta una disposición de estructuras cilindricas paralelas de tamaño milimétrico, designadas como "osteonas". En sección, estas osteonas aparecen constituidas por láminas concéntricas de colágeno;
- Nivel 6 (figura 1f): la parte central de los huesos largos rica en células se denomina "hueso esponjoso". A nivel de este hueso, unas láminas óseas forman una red macroporosa de tramos delgados e irregulares. La asociación hueso compacto/hueso esponjoso constituye el nivel 6 de organización. Se está a más de un milímetro;
- Nivel 7 (figura 1 g): el último nivel es, simplemente, el hueso entero.
Varias clases de materiales sintéticos (designados como "materiales de implantes") o naturales (designados como "injertos) están propuestos en la técnica anterior. Los materiales de implantes son generalmente bio-inertes, es decir son simplemente tolerados por el organismo, o biocompatibles, es decir que se integran perfectamente en el organismo hospedante. Un injerto es un tejido óseo extraído de la persona a la que se destina (autoinjerto) o de una tercera persona (aloinjerto), y es generalmente osteo-conductor, es decir que es capaz de guiar el recrecimiento óseo.
Un sustituto óseo osteo-inductor, es decir capaz de inducir una reconstrucción ósea, constituye sin embargo un sustituto ideal. La elaboración de un material de este tipo es compleja. Su colocación necesita la utilización de constituyentes que tienen una naturaleza química y una fase cristalina particular con el fin de optimizar su perfecta integración dentro de un organismo humano o animal, y evitar así el rechazo. Su organización tridimensional debe ser reconstituida para asegurar, por un lado, las propiedades mecánicas y, por otro lado una porosidad apropiada para la colonización de dicho sustituyente por el tejido hospedante. El acceso a la organización de la trama orgánica
del hueso (2% en masa), así como su asociación con la fase mineral (7% en masa) en el tejido son muy difíciles de reproducir in vitro.
Se han efectuado numerosos trabajos para la síntesis de sustitutos óseos, y en particular unos trabajos que se basan en la mlnerallzación de colágeno. La mlneralización de colágeno de tendones óseos de pavo ha sido estudiada por W. Traub, et al. [Proc. Nati. Acad. Sci. USA 1989, 86, 9822-9826], pero el material obtenido no presenta una organización análoga a la del hueso. Se han efectuado otros ensayos con colágeno purificado in vitro, pero las condiciones de fuerte dilución en las que se efectuaron los ensayos no han permitido obtener un material que presente la densidad ósea y la organización tridimensional del colágeno encontrados en los tejidos óseos vivos [véanse D. Llckorlsh, et al. (J. Biomed. Mat. Res. 24, 68A, 19-27); S. Yunokl, et al., (Mat. Lett., 26, 6, 999- 12); D. A. Wahl, et al. (Eur. Cell. Mat. 26,11, 43-56)].
La cristalización de calcita CaC3, a partir de una solución de CaCI2 bajo una atmósfera de amoniaco generada por la descomposición térmica a temperatura ambiente de un polvo de (NH4)C3 ha sido descrita por L. Addadi, et al. (Proc. Nati. Acad. Sci. USA 1987, 84, 2732-2736).
Se conoce también precipitar el colágeno a partir de una solución ácida mediante un aumento del pH. R. L. Ehrman, et al., (J. Nat. Cáncer Inst. 1956, 16, 1375-143) describen un procedimiento en el que una solución de colágeno en el ácido acético se pone en contacto con unos vapores de NH3. Se transforma en un gel que contiene unos granos finos. La estructura del material obtenido no está descrita.
M.M. Giraud-Guille, et al. (J. Mol. Biol. 1995, 251, 197-22) y (J. Mol. Biol. 1992, 224, 861-873) describen la estructura "cristal líquido" obtenida a partir de una solución concentrada en colágeno, así como la transición sol-gel obtenida por elevación del pH de ácido a básico.
G. Mosser, M. M. Giraud-Guille, et al., (Matrix Biol. 26, 25, 3-13) describen un procedimiento en el que una solución ácida en colágeno (5 mg/ml) se concentra progresivamente en unas microcámaras de vidrio con el fin de obtener una organización helicoidal de largo alcance de las moléculas de colágeno, así como un gradiente de concentración. La solución se pone entonces en contacto con vapores de amoniaco, para formar unas fibrillas de colágeno y estabilizar la organización colocada en fase líquida.
B. A. Harley, et al., (Biomaterials 26, 27, 866-874) describen la elaboración de una matriz estructurada de colágeno que contiene también un glucosaminoglicano. Unas microfibrillas de colágeno se mezclan con sulfato de condroitina de manera homogénea a 4°C. La solución se centrifuga después en un molde, se congela de manera ultrarrápida, se liofiliza y después se retícula a 15°C bajo un vacío de 5 mTorr durante 24 horas. La naturaleza fibrilar del colágeno no está descrita.
C. Guo, et al., (Biomaterials 27, 28, 115-1114) describen la utilización de bolas magnéticas para alinear una solución de fibrillas de colágeno. Una solución de colágeno preparada en un tampón fosfato a concentraciones de 2,5 mg/ml, mantenida a 4°C, se pone en contacto con las bolas magnéticas. Las mismas muestras son también preparadas en presencia de células a una concentración final de colágeno a 1,2 mg/ml. En los dos casos, las muestras se ponen en un campo magnético de menos de 1G durante la inducción de la fibrilogénesis producida por una elevación de la temperatura a 37°C. Asimismo, se utiliza una atmósfera en CO2 cuando unas células están integradas en la matriz. Las matrices son muy flojas y la naturaleza fibrilada del colágeno no se menciona. M. J. Olsza, et al., (Calcif.... [Seguir leyendo]
Reivindicaciones:
1. Material sintético que comprende una fase orgánica (I) y una fase mineral (II), caracterizado por que:
- la fase orgánica (I) comprende unas fibrillas estriadas de colágeno constituidas por unas triples hélices de colágeno I y en las que la periodicidad de las estuaciones es de 67 nm, estando dichas fibrillas ordenadas a gran distancia según una geometría 3D que asocia unos campos alineados y unos campos colestéricos, así como unos campos ¡sotrópicos en los que no están ordenadas;
- la fase mineral (II) comprende unos cristales de apatita de estructura cristalina hexagonal, grupo de espacio 6/m, comprendiendo dichos cristales por lo menos unos iones calcio y por lo menos unos iones fosfato;
- el eje c de dichos cristales de apatita de la fase mineral está coalineado con el eje longitudinal de las fibrillas estriadas de colágeno de la fase orgánica;
- el contenido en colágeno en el seno de dicho material es de por lo menos 75 mg/cm3
2. Material según la reivindicación 1, caracterizado por que la fase mineral está constituida por cristales de hidroxiapatita pura.
3. Material según la reivindicación 1 o 2, caracterizado por que la fase mineral está constituida por cristales de hidroxi apatita estequiométrica de fórmula (I) siguiente:
Ca1(PO4)6(OH)2 (I)
4. Material según la reivindicación 3, caracterizado por que la relación atómica Ca/P de los cristales de hidroxi a patita de fórmula (I) es de 1,67.
5. Material según la reivindicación 1, caracterizado por que la fase mineral comprende unos cristales de apatita que comprenden además por lo menos unos iones hidróxido y en los que los iones fosfato y/o los iones hidróxido son parcialmente sustituidos por unos iones carbonatas.
6. Material según la reivindicación 1, caracterizado por que la fase mineral comprende unos cristales de apatita que comprenden unos iones Ca2+, unos iones PO43' y unos iones OH', y en la que uno por lo menos de los iones Ca2+, PO43" u OH" está parcialmente sustituido por otros iones, entendiéndose que:
- los iones susceptibles de sustituir parcialmente los iones Ca2+, se seleccionan de entre los iones Mg2+,Cu2+,
í~\ 24" i» 2+ ~7 2+ _,2+ nti_ 2+ h 1 + i/t ^ 3^
Sr , Ba , Zn , Cd , Pb , Na , K y Eu ;
- los iones susceptibles de sustituir parcialmente los iones P43', se seleccionan de entre los iones CO32', Si43", As43', Mn43", VO43", Cr43' y HP42'; y
- tas iones susceptibles de sustituir parcialmente los iones OH', se seleccionan de entre tas iones CO32', F', CI', Br', I', S2' y O2'.
7. Material según cualquiera de las reivindicaciones anteriores, caracterizado por que contiene además una cantidad de proteoglicanos, de glicosaminoglicanos y/o de moléculas orgánicas que favorecen la mineralización, inferior al 2%.
8. Procedimiento de preparación de un material según la reivindicación 1, que consiste en preparar una solución acuosa ácida inicial de colágeno precursor de la fase orgánica (I), y por lo menos una solución acuosa de precursores de la fase mineral (II) y en hacer precipitar el colágeno por elevación del pH hasta un valor de por lo menos 7, caracterizado por que:
- la concentración en colágeno en el seno de la solución acuosa ácida es de por lo menos 75 mg/ml y permanece constante durante dicha elevación del pH,
- tas precursores de la fase mineral comprenden por lo menos una sal de calcio y por lo menos una sal de fosfato,
- la precipitación de la fase mineral (II) se efectúa mediante la puesta en contacto de la solución de precursores de la fase mineral con la fase orgánica (I), siendo dicha puesta en contacto efectuada antes o después de la precipitación de dichafase orgánica (I).
9. Procedimiento según la reivindicación 8, caracterizado por que se hace precipitar el colágeno de la fase orgánica (I) antes de su puesta en contacto con una solución neutra de precursores de la fase mineral (II), conteniendo dicha
solución neutra por lo menos dichas sales de calcio y por lo menos dichas sales de fosfato.
1. Procedimiento según la reivindicación 8, caracterizado por que una solución ácida de precursores de la fase orgánica (I) se pone en contacto con una solución ácida de precursores de la fase mineral (II), y la mezcla así obtenida se somete a un aumento del pH que induce la coprecipitadón del colágeno y de la apatita.
11. Procedimiento según la reivindicación 1, caracterizado por que la solución ácida concentrada de precursores de la fase orgánica (I) está contenida en un molde que está encerrado en una membrana de diálisis, siendo el conjunto sumergido a continuación en la solución de precursores de la fase mineral (II).
12. Procedimiento según la reivindicación 1, caracterizado por que la solución concentrada de colágeno se introduce en un envoltorio flexible constituido por una membrana de diálisis, siendo dicho envoltorio sumergido a continuación en la solución de precursores de la fase mineral (II).
13. Procedimiento según la reivindicación 8, para la preparación de un material en el que la fase mineral II está constituida por cristales de hidroxiapatita pura y tal como se define en la reivindicación 2, caracterizado por que se realiza en un recinto cerrado en el que se dispone:
- por lo menos un primer recipiente que contiene una solución acuosa de por lo menos una sal de fosfato y de por lo menos una sal de calcio, precursores de la fase mineral II, en la que se sumerge por lo menos un tubo de diálisis que contiene una solución acuosa ácida inicial de colágeno precursor de la fase orgánica (I),
por lo menos un segundo recipiente que contiene una solución de amoniaco o un polvo de (NH/^CCb;
entendiéndose que:
- la relación (volumen de la solución de precursores de la fase mineral l)/(volumen Interno del recinto cerrado) es de 2-1 ,
- la altura de la solución de precursores de la fase mineral I contenida en el primer recipiente varía de 3 a 5 cm, siendo el diámetro de dicho recipiente de 2 a 5 cm aproximadamente;
- la relación (volumen de la solución acuosa de amoniaco)/(volumen Interno del recinto cerrado) es de 8-1'3 o la relación volumen del polvo de (NH4)2CC>3/(volumen del recinto cerrado) es de 6-1'3.
14. Procedimiento según la reivindicación 8, caracterizado por que la solución acuosa ácida ¡nidal de colágeno presenta las características siguientes:
- su concentración en colágeno es de 75 mg/ml a 1 mg/ml;
- su pH es inferior a 4, en presencia de ácidos.
15. Procedimiento según la reivindicación 8, caracterizado por que la solución de precursores de la fase mineral (II) presenta las características siguientes:
- la concentración en precursor de calcio es inferior al límite de solubilidad;
- la concentración en precursor de fosfato es inferior al límite de solubilidad;
- las cantidades de precursores son tales que la relación molar Ca/P está entre 1,5 y 1,8.
16. Procedimiento según la reivindicación 8, para la preparación de un material según la reivindicación 6, caracterizado por que la solución de precursores de la fase mineral contiene además una o varias sales cuyo catión está destinado a sustituir por lo menos parcialmente Ca2+, y/o una o varias sales cuyo anión está destinado a sustituir por lo menos parcialmente P43' u OH'.
17. Procedimiento según la reivindicación 8, para la preparación de un material según la reivindicación 7, caracterizado por que la solución de precursores de la fase mineral (II) contiene además unos proteoglicanos, unos glicosaminoglicanos y/o unas moléculas orgánicas que favorecen la mineralización.
18. Procedimiento según la reivindicación 8, caracterizado por que la elevación del pH se efectúa por una atmósfera gaseosa básica.
Patentes similares o relacionadas:
Materiales cerámicos osteoinductivos moldeables e inyectables, del 24 de Junio de 2020, de NuVasive Netherlands B.V: Un material cerámico moldeable, maleable, amasable y/o inyectable que comprende fosfato de calcio poroso que tiene un tamaño de cristal de entre 0,1 y […]
Implantes médicos de poli-4-hidroxibutirato termoformados, del 6 de Mayo de 2020, de TEPHA, INC.: Un implante médico que comprende una termoforma conformada de homopolímero de poli-4-hidroxibutirato que es obtenible mediante un proceso que comprende […]
Vitrocerámica cristalizada de alta resistencia que comprende wollastonita, hidroxiapatita y akermanita, del 22 de Abril de 2020, de Bioalpha Corporation: Una vitrocerámica cristalizada que comprende de 30 % en peso a 40 % en peso de cada uno de CaSiO3, Ca10(PO4)6(OH)2, y Ca2Mg(Si2O7).
Composiciones y métodos para el tratamiento de huecos óseos y fracturas abiertas, del 22 de Abril de 2020, de Polypid Ltd: Una composición farmacéutica que comprende partículas de relleno óseo recubiertas y no recubiertas en una proporción entre aproximadamente 1:3 […]
Cemento de apatita inyectable de sustitución iónica múltiple para vertebroplastia regenerativa y cifoplastia, del 15 de Abril de 2020, de CONSIGLIO NAZIONALE DELLE RICERCHE, C. N. R.: Cemento de apatita inyectable, en el que el calcio en el fosfato tricálcico en la fase α está parcialmente sustituido con estroncio y el fosfato […]
Composiciones formadoras de cemento, cementos de monetíta, implantes y métodos para corregir los defectos óseos, del 19 de Febrero de 2020, de OssDsign AB: Un cemento de monetita endurecido que comprende al menos 70% en peso de monetita, al menos 80% en peso de monetita, al menos 85% en peso de monetita, o al menos […]
Material sustituto óseo, del 2 de Octubre de 2019, de Geistlich Pharma AG: Material sustituto óseo de fosfato de calcio/hidroxiapatita (CAP/HAP) bifásico que comprende un núcleo de CAP sinterizado y una capa de crecimiento epitáctico cerrada […]
Biomaterial poroso, del 11 de Septiembre de 2019, de Apatech Ltd: Un biomaterial de fosfato de calcio poroso osteoinductivo sintético que comprende una red de microporos interconectados, en donde: la […]