Inhalador de dosis farmacéutica medida y procedimiento relacionados con el mismo.
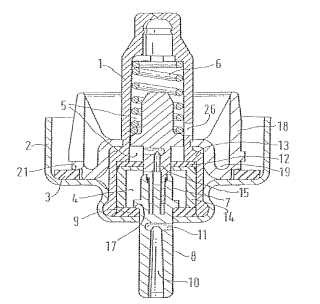
1. Un procedimiento de fabricación de un MDI (inhalador de dosis medida) que comprende proporcionar una junta deestanqueidad (3,
9, 12) para MDI, proporcionar los otros componentes para MDI y una formulación en aerosolfarmacéutica y ensamblar el MDI, caracterizado porque la junta de estanqueidad comprende un material de juntaelastomérico que comprende caucho de acrilonitrilo butadieno y uno o más compuestos extraíbles y la formulaciónen aereosol farmacéutica comprende xinafoato de salmeterol y propionato de fluticasona, y adicionalmentecaracterizado porque el procedimiento comprende una etapa de poner en contacto el material de juntaelastomérico con una solución que comprende un disolvente orgánico, en el que la solución está a una temperaturade al menos 40º C para extraer al menos una parte del al menos uno o más compuestos extraíbles del material dejunta elastomérico y en el que el material de junta elastomérico no está recubierto con un recubrimiento deorganotitanio.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2004/026252.
Solicitante: GLAXO GROUP LIMITED.
Nacionalidad solicitante: Reino Unido.
Dirección: 980 GREAT WEST ROAD BRENTFORD MIDDLESEX TW8 9GS REINO UNIDO.
Inventor/es: MILLER,JOHN FRANCIS, SOMMERVILLE,MARK LEE.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K9/00 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › Preparaciones medicinales caracterizadas por un aspecto particular.
- A61M39/00 A61 […] › A61M DISPOSITIVOS PARA INTRODUCIR AGENTES EN EL CUERPO O PARA DEPOSITARLOS SOBRE EL MISMO (introducción de remedios en o sobre el cuerpo de animales A61D 7/00; medios para la inserción de tampones A61F 13/26; dispositivos para la administración vía oral de alimentos o medicinas A61J; recipientes para la recogida, almacenamiento o administración de sangre o de fluidos médicos A61J 1/05 ); DISPOSITIVOS PARA HACER CIRCULAR LOS AGENTES POR EL CUERPO O PARA SU EXTRACCION (cirugía A61B; aspectos químicos de los artículos quirúrgicos A61L; magnetoterapia utilizando elementos magnéticos colocados dentro del cuerpo A61N 2/10 ); DISPOSITIVOS PARA INDUCIR UN ESTADO DE SUEÑO O LETARGIA O PARA PONERLE FIN. › Tubos, adaptadores o conectores para tubos, válvulas, vías de acceso o similares, especialmente concebidos para uso médico (para los dispositivos respiratorios, p. ej. tubos traqueales A61M 16/00; válvulas cardiacas artificiales A61F 2/24).
- C08C3/02 QUIMICA; METALURGIA. › C08 COMPUESTOS MACROMOLECULARES ORGANICOS; SU PREPARACION O PRODUCCION QUIMICA; COMPOSICIONES BASADAS EN COMPUESTOS MACROMOLECULARES. › C08C TRATAMIENTO O MODIFICACION QUIMICA DE LOS CAUCHOS. › C08C 3/00 Tratamiento de caucho coagulado. › Purificación.
- C08F6/00 C08 […] › C08F COMPUESTOS MACROMOLECULARES OBTENIDOS POR REACCIONES QUE IMPLICAN UNICAMENTE ENLACES INSATURADOS CARBONO - CARBONO (producción de mezclas de hidrocarburos líquidos a partir de hidrocarburos de número reducido de átomos de carbono, p. ej. por oligomerización, C10G 50/00; Procesos de fermentación o procesos que utilizan enzimas para la síntesis de un compuesto químico dado o de una composición dada, o para la separación de isómeros ópticos a partir de una mezcla racémica C12P; polimerización por injerto de monómeros, que contienen uniones insaturadas carbono-carbono, sobre fibras, hilos, hilados, tejidos o artículos fibrosos hechos de estas materias D06M 14/00). › Tratamientos posteriores a la polimerización (C08F 8/00 tiene prioridad; de cauchos de dieno conjugado C08C).
- C08K5/00 C08 […] › C08K UTILIZACION DE SUSTANCIAS INORGANICAS U ORGANICAS NO MACROMOLECULARES COMO INGREDIENTES DE LA COMPOSICION (colorantes, pinturas, pulimentos, resinas naturales, adhesivos C09). › Utilización de ingredientes orgánicos.
- C08K5/09 C08K […] › C08K 5/00 Utilización de ingredientes orgánicos. › Acidos carboxílicos; Sus sales metálicas; Sus anhídridos.
- C08K5/13 C08K 5/00 […] › Fenoles; Fenolatos.
PDF original: ES-2449718_T3.pdf
Fragmento de la descripción:
Inhalador de dosis farmacéutica medida y procedimiento relacionados con el mismo La presente invención se refiere a procedimientos de tratamiento de juntas de estanqueidad para inhalador de dosis medida (MDI) . El MDI se usa normalmente en la dispensación de una cantidad de una formulación que contiene medicamento que se puede usar en el tratamiento de enfermedades respiratorias u otras.
Antecedentes El uso de aerosoles para administrar medicamentos es conocido desde hace varias décadas. Tales aerosoles comprenden por lo general el medicamento, uno o más propelentes de clorofluorocarbono y uno o más aditivos, por ejemplo, un tensioactivo o un co-disolvente, tal como etanol. Históricamente, los propelentes de aerosol más comúnmente usados para medicamentos han sido el propelente 11 (CCI3F) , propelente 114 (CF2CICF2CI) , propelente 12 (CCI2F2) o combinaciones de estos. Sin embargo, ahora se cree que la liberación de estos propelentes en la atmósfera contribuye a la degradación del ozono estratosférico y por tanto hay una necesidad de proporcionar formulaciones en aerosol para medicamentos que usen los denominados propelentes “respetuosos con el ozono”.
Recipientes para formulaciones en aerosol comprenden habitualmente un cuerpo de vial (lata o bote) acoplado a una válvula. La válvula comprende un vástago de válvula por el cual se dispensan las formulaciones. En general la válvula incluye una o más juntas de válvula de caucho que están concebidas para permitir movimiento recíproco del vástago de válvula que evite las fugas de propelente del recipiente. Los inhaladores de dosis medida comprenden una válvula que está diseñada para liberar una cantidad medida de una formulación en aerosol al recipiente por actuación. Tal válvula de medida comprende, por lo general, una cámara de medida que es de un volumen predeterminado y que provoca que la dosis por actuación sea de una cantidad exacta predeterminada.
La válvula de medida en un recipiente se acopla de forma típica al bote con contacto mediante una junta de estanqueidad para evitar la fuga de propelente y/o sustancia fármaco fuera del recipiente en la unión. La junta comprende de forma típica un material elastomérico, por ejemplo, polietileno de baja densidad, clorobutilo, cauchos de acrilonitrilo butadieno, caucho de butilo, un polímero de monómero de etileno propileno dieno (EPDM) , neopreno o cloropreno. Tales materiales elastoméricos pueden tener cargas de negro de carbono o mineral.
Válvulas para uso en MDI se encuentran disponibles de varios fabricantes conocidos en la industria de aerosoles; por ejemplo en Valois, Francia (por ejemplo DF10, DF30, DF60) , Bespak pic, RU (por ejemplo, BK300, BK356, BK357) o 3M-Neotechnic Limited, RU (por ejemplo, SpraymiserTM) . Las válvulas de medida se usan junto con botes comercialmente disponibles, por ejemplo, botes de metal, por ejemplo, botes de aluminio, adecuados para la liberación de formulaciones en aerosol farmacéuticas.
Los MDI que incorporan una selladura de válvula o una junta de estanqueidad como se describió anteriormente actúan en general adecuadamente con propelentes CFC, tales como el propelente 11 (CCI3F) , propelente 114 (CF2CICF2CI) , propelente 12 (CCI2F2) . Sin embargo, como se citó anteriormente, hay un requerimiento para sustituir los denominados propelentes de CFC por propelentes respetuosos con el ozono en aerosoles. Una clase de propelentes que se cree que presentan efectos de agotamiento de ozono mínimos en comparación con los clorofluorocarbonos convencionales comprende fluorocarbonos y clorofluorocarbonos que contienen hidrógeno. Esa clase incluye, pero sin limitarse a estos, hidrofluoroalcanos (HFA) , por ejemplo, 1, 1, 1, 2-tetrafluoroetano (HFA134a) , 1, 1, 1, 2, 3, 3, 3-heptafluoro-n-propano (HFA 227) y mezclas de los mismos. Sin embargo han surgido diversos problemas con las formulaciones en aerosol farmacéuticas preparadas usando propelentes de HFA, en particular en lo que respecta a la estabilidad de las formulaciones.
Las formulaciones en aerosol farmacéuticas comprenden, por lo general, una solución o una suspensión. Es también posible una mezcla de una suspensión y una pequeña cantidad de medicamento disuelto, pero por lo general no deseable (como se describió anteriormente) . Algunas formulaciones en solución presentan la desventaja de que la sustancia fármaco contenida en las mismas es más susceptible de la degradación que cuando están en forma sólida. Además las formulaciones en solución pueden estar asociadas con problemas en el control del tamaño de las gotas que en cambio afecta al perfil terapéutico. Las formulaciones en suspensión son por tanto en general preferidas.
Para obtener la aprobación regulatoria, los productos de formulación en aerosol farmacéuticos deben satisfacer especificaciones estrictas. Un parámetro que deben satisfacer por lo general, y para el que se especifica normalmente un nivel, es la masa de partículas finas (FPM) . La FPM es una medida de la cantidad de fármaco que tiene el potencial de alcanzar el interior de los pulmones (los pequeños bronquiolos y alveolos) en base a la proporción de partículas de fármaco con un diámetro dentro de un cierto intervalo, normalmente menos de 5 micrómetros. La FPM de una actuación de un MDI se calcula por lo general en base a la suma de la cantidad de sustancia fármaco depositada en las fases 3, 4 y 5 de un apilamiento de impacto de cascada Andersen según se determina por el análisis por HPLC convencional. Los efectos secundarios potenciales se minimizan y se desecha
una pequeña cantidad de sustancia fármaco si el FPM constituye en la medida que sea posible un porcentaje de la masa total del fármaco.
En formulaciones en suspensión, el tamaño de partícula de la dosis emitida se controla por lo general durante la fabricación con el tamaño al que se reduce el medicamento sólido, normalmente por micronización. Durante el almacenamiento de algunas suspensiones de fármaco en un HFA, sin embargo, se ha encontrado que tiene lugar diversos cambios que presentan el efecto de reducir la FPM. Una caída en la FPM significa que la cantidad terapéuticamente efectiva de fármaco disponible para el paciente se reduce. Esto es indeseable y puede en última instancia afectar a la efectividad de la medicación. Ese problema es particularmente agudo cuando la dosis que se tiene que dispensar es baja, lo cual es el caso de ciertos fármacos potentes tales como agonistas beta de actividad prolongada, que son broncodilatoradores.
Se han propuesto diversos mecanismos con los que puede tener lugar la reducción en FPM: el crecimiento del tamaño de partícula puede tener lugar si el fármaco suspendido presenta una solubilidad suficiente en el propelente, un procedimiento conocido como maduración de Ostwald. De forma alternativa, o adicionalmente, pequeñas partículas pueden presentar la tendencia a agregarse o adherirse a piezas del interior del MDI, por ejemplo, el bote o válvula. También pequeñas partículas pueden llegar a ser absorbidas en o adsorbidas sobre componentes de caucho de la válvula. Cuando los procesos de adherencia y absorción son más prevalentes entre partículas pequeñas, estos procesos conducen a una disminución en FPM como una fracción del fármaco administrado así como también a una reducción en el contenido en fármaco total (TDC) del bote disponible para el paciente. Se ha encontrado adicionalmente que los procesos de adherencia y absorción no pueden dar lugar solo a la pérdida de fármaco disponible, sino que puede afectar de forma adversa a la función del dispositivo, dando lugar a una adherencia a la válvula u orificios que llegan a bloquearse.
Es esencial que la dosis prescrita de medicación de aerosol suministrada desde el MDI al paciente cumpla de forma consistente las especificaciones reivindicadas por el fabricante y cumpla con los requerimientos de la FDA y otras autoridades regulatorias. Esto es, cada dosis dispensada del MDI debe ser la misma dentro de las estrechas tolerancias. Por tanto es importante que la formulación sea sustancialmente homogénea en todo el bote y la dosis administrada en el momento de actuación de la válvula de medida y que esto se mantenga sustancialmente igual incluso tras almacenamiento.
Se han considerado diversos enfoques para solventar los problemas citados anteriormente. Un enfoque es la adición de uno o más adyuvantes a la suspensión de fármaco; por ejemplo adyuvantes seleccionados de alcoholes, alcanos, dimetiléter, tensioactivos (por ejemplo, tensioactivos fluorados o no fluorados, ácidos carboxílicos, polietoxilados, etc.) e incluso propelentes de clorofluorocarbono convencionales en pequeñas cantidades (a niveles que se pretende mantengan en... [Seguir leyendo]
Reivindicaciones:
1. Un procedimiento de fabricación de un MDI (inhalador de dosis medida) que comprende proporcionar una junta de estanqueidad (3, 9, 12) para MDI, proporcionar los otros componentes para MDI y una formulación en aerosol farmacéutica y ensamblar el MDI, caracterizado porque la junta de estanqueidad comprende un material de junta elastomérico que comprende caucho de acrilonitrilo butadieno y uno o más compuestos extraíbles y la formulación en aereosol farmacéutica comprende xinafoato de salmeterol y propionato de fluticasona, y adicionalmente caracterizado porque el procedimiento comprende una etapa de poner en contacto el material de junta elastomérico con una solución que comprende un disolvente orgánico, en el que la solución está a una temperatura de al menos 40º C para extraer al menos una parte del al menos uno o más compuestos extraíbles del material de junta elastomérico y en el que el material de junta elastomérico no está recubierto con un recubrimiento de organotitanio.
2. El procedimiento de la reivindicación 1, en el que al menos uno del uno o más compuestos extraíbles se selecciona del grupo que consiste en isómero de nonilfenol 2, 2’-metilenbis (6-tercbutil-4-metilfenol) , 2, 2, 4, 6, 6pentametilhept-3-eno, 3’-oxibispropanitrilo, ácido oleico, ácido palmítico y ácido esteárico.
3. El procedimiento de la reivindicación 1, en el que al menos uno del uno o más compuestos extraíbles presenta una presión de vapor mayor de 6000 Pa a una temperatura de 20º C.
4. El procedimiento de la reivindicación 1, en el que la solución comprende un alcohol inferior.
5. El procedimiento de la reivindicación 4, en el que la solución comprende adicionalmente un ácido.
6. El procedimiento de la reivindicación 5, en el que la solución presenta un pH menor de 5, 5.
7. El procedimiento de la reivindicación 5, en el que la solución presenta un pH entre 2, 5 y 6, 0.
8. El procedimiento de la reivindicación 4, en el que el alcohol inferior es etanol o isopropanol.
9. El procedimiento de la reivindicación 4, en el que la solución consiste esencialmente en etanol.
10. El procedimiento de la reivindicación 1, en el que el material de junta elastomérico se pone en contacto con la solución durante al menos 1 hora.
11. El procedimiento de la reivindicación 1, en el que el material de junta elastomérico se pone en contacto con la solución a una temperatura de al menos 60º C.
12. El procedimiento de la reivindicación 1, en el que el material de junta elastomérico se pone en contacto con la solución en condiciones de reflujo para la solución.
13. El procedimiento de la reivindicación 1, en el que el material de junta elastomérico se pone en contacto con la solución en presencia de energía ultrasónica.
14. El procedimiento de la reivindicación 1, en el que el material de junta elastomérico se pone en contacto con la solución en condiciones suficientes para extraer al menos 20 por ciento de al menos uno del uno o más compuestos extraíbles.
15. El procedimiento de la reivindicación 1, en el que el material de junta elastomérico se pone en contacto con la solución en condiciones suficientes para extraer al menos 40 por ciento de al menos uno del uno o más compuestos extraíbles.
16. El procedimiento de la reivindicación 1, que comprende adicionalmente agitar el material de junta elastomérico.
17. El procedimiento de la reivindicación 16, en el que la agitación del material de junta elastomérico se lleva a cabo subsiguientemente a la puesta en contacto del material de junta elastomérico con la solución.
18. El procedimiento de la reivindicación 17, que comprende además poner en contacto el material de junta elastomérico con la solución subsiguientemente a la agitación del material de junta elastomérico.
19. El procedimiento de una cualquiera de las reivindicaciones precedentes, en el que la junta de sellado es una junta de cuello/bote.
20. El procedimiento de una cualquiera de las reivindicaciones 1 a 18, en el que la junta de estanqueidad es una junta de estanqueidad inferior o superior.
21. El procedimiento de una cualquiera de las reivindicaciones precedentes, en el que la etapa de puesta en contacto es el último procedimiento de tratamiento que afecta de forma significativa a las propiedades del material de junta elastomérico.
22. El procedimiento de una cualquiera de las reivindicaciones precedentes, en el que la formulación comprende 5 HFA 134a o HFA 227 como propelente.
23. El procedimiento de una cualquiera de las reivindicaciones 1 a 21, en el que la formulación comprende HFA 134a como propelente.
24. El procedimiento de la reivindicación 1, en el que la junta de estanqueidad es una junta de cuello/bote, y en el que el procedimiento comprende adicionalmente juntas de estanqueidad inferiores y superiores que comprenden 10 cada una un material de junta elastomérico que comprende caucho de acrilonitrilo butadieno y uno o más compuestos extraíbles y poner en contacto el material de junta elastomérico de las juntas de estanqueidad inferiores y superiores con una solución que comprende un disolvente orgánico, en el que la solución está a una temperatura de al menos 40º C para extraer al menos una parte del al menos uno o más compuestos extraíbles de los materiales de junta elastoméricos de las juntas de estanqueidad inferior y superior y en el que el material de junta elastomérico
de las juntas de estanqueidad inferior y superior no está recubierto con un recubrimiento de organotitanio.
Patentes similares o relacionadas:
Administración intravascular de composiciones de nanopartículas y usos de las mismas, del 29 de Julio de 2020, de ABRAXIS BIOSCIENCE, LLC: Una composición que comprende nanopartículas que comprenden rapamicina y albúmina para su uso en un procedimiento para inhibir la remodelación […]
 Inhibidor de galactósido de galectina-3 y su uso para tratar fibrosis pulmonar, del 29 de Julio de 2020, de Galecto Biotech AB: Un dispositivo adecuado para administración pulmonar en el que dicho dispositivo es un inhalador de polvo seco que comprende una composición que comprende un compuesto de […]
Inhibidor de galactósido de galectina-3 y su uso para tratar fibrosis pulmonar, del 29 de Julio de 2020, de Galecto Biotech AB: Un dispositivo adecuado para administración pulmonar en el que dicho dispositivo es un inhalador de polvo seco que comprende una composición que comprende un compuesto de […]
Formulaciones estabilizadas que contienen anticuerpos anti-receptor de interleucina 4 (IL-4R), del 29 de Julio de 2020, de REGENERON PHARMACEUTICALS, INC.: Una jeringuilla precargada que contiene una formulación farmacéutica líquida estable, en la que la formulación farmacéutica líquida comprende: […]
Neuregulina para tratar la insuficiencia cardíaca, del 29 de Julio de 2020, de Zensun (Shanghai) Science & Technology, Co., Ltd: Neuregulina para usar en un método para tratar la insuficiencia cardíaca crónica en un paciente, donde el paciente tiene un nivel plasmático de NT-proBNP […]
Matrices de microagujas obtenidas mediante disolución y colada que contienen un principio activo, del 29 de Julio de 2020, de Corium, Inc: Un método para formar una matriz de microprotusiones, que comprende: (a) dispensar en un molde que tiene una matriz de cavidades correspondientes al negativo […]
Potenciador de la conservación, del 29 de Julio de 2020, de DSM IP ASSETS B.V.: Una composición tópica que comprende fitantriol y eritrulosa.
 Formulaciones de finasterida para la liberación de fármacos en el cabello y el cuero cabelludo, del 29 de Julio de 2020, de POLICHEM SA: Una composición que contiene:
(a) hidroxipropil-quitosano o una sal fisiológicamente aceptable de este en una cantidad de un 0,25 a un 2,0 % […]
Formulaciones de finasterida para la liberación de fármacos en el cabello y el cuero cabelludo, del 29 de Julio de 2020, de POLICHEM SA: Una composición que contiene:
(a) hidroxipropil-quitosano o una sal fisiológicamente aceptable de este en una cantidad de un 0,25 a un 2,0 % […]
Reducción de tejido adiposo, del 22 de Julio de 2020, de Dobak, John, Daniel: Una formulacion farmaceutica inyectable que comprende: (i) polidocanol en una cantidad del 0,5 % p/v al 2,0 % p/v; e (ii) un alcohol C3-C6 en una cantidad del […]