Procedimiento para detectar anticuerpos Aß-específicos en una muestra biológica.
Procedimiento para detectar anticuerpos Aß-específicos en una muestra biológica,
que comprende las etapas siguientes:
- poner en contacto la muestra con agregados Aß o con perlas con agregados Aβ inmovilizados en su superficie, y permitir que los anticuerpos Aß específicos se unan a los agregados Aß, y
- detectar los anticuerpos Aβ-específicos que están unidos a los agregados Aβ, mediante una técnica de detección de partículas individuales, preferentemente mediante la clasificación de células activadas por fluorescencia (FACS).
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E11183842.
Solicitante: AFFIRIS AG.
Nacionalidad solicitante: Austria.
Dirección: Karl-Farkas-Gasse 22 1030 Wien AUSTRIA.
Inventor/es: MATTNER, FRANK, SCHMIDT, WALTER, STAFFLER,GÜNTHER, MAIRHOFER,ANDREAS, SCHNEEBERGER,ACHIM, LUTTEROVA,MARTINA.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- G01N33/564 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › para complejos inmunológicos preexistentes o enfermedades autoinmunes.
PDF original: ES-2496341_T3.pdf
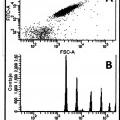
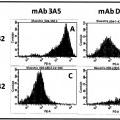


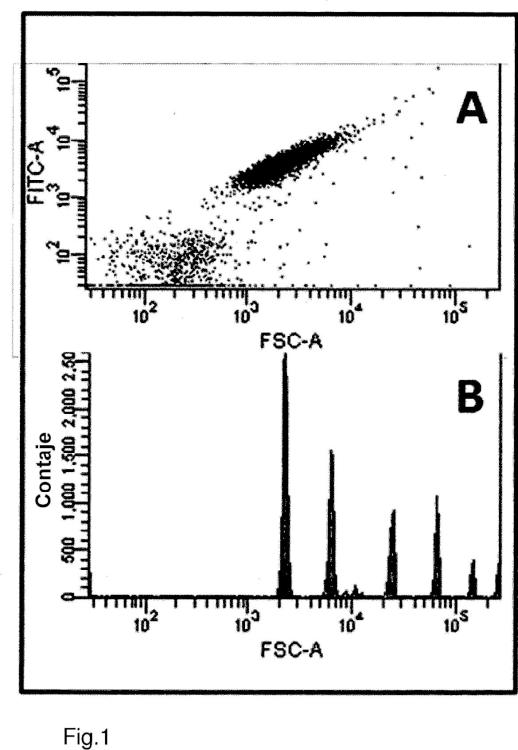
Fragmento de la descripción:
Procedimiento para detectar anticuerpos Ap-específicos en una muestra biológica.
La presente invención se refiere a procedimientos para detectar anticuerpos específicos Ap en muestras biológicas, especialmente en relación con y para el diagnóstico de la enfermedad de Alzheimer (AD).
AD constituye una alteración compleja progresiva que implica la interacción de cascadas patológicas, que incluyen la agregación del p-amiloide y la formación de placas cerebrales, la hiperfosforilación de la proteína tan con la formación de marañas intraneuronales. Concomitante con la agregación y la hiperfosforilación de estas proteínas cerebrales, procesos inflamatorios contribuyen a la pérdida de la integridad sináptica y a la neurodegeneración progresiva.
La conversión del péptido p amiloide (Ap o A-beta) a partir de una forma soluble con una estructura principalmente alfa-helicoidal o secundaria enrollada al azar, a una forma agregada con una estructura secundaria en forma de láminas beta, que forma finalmente placas amiloideas en el cerebro, representa una de las primeras características de la patología AD. Varias formas de Ap, C-, así como de los péptidos modificados o truncados N-terminalmente, contribuyen a la formación de las placas Ap en el cerebro. Las tres variantes mayores C-terminales de Ap, incluyen los péptidos Api-40 (que están formados por 40 aminoácidos (aa) con sal-40 como último aa), Ap1-42 y Api-43. Además de estas formas importantes de péptidos truncados C-terminales, existen también otras formas truncadas que aparecen menos frecuentemente, principalmente Ap1-37, Ap1-38 y Ap1-39. Las variantes N-terminales de Ap consisten en AP3-40/42/43 y Ap11-40/42/43. En todas estas formas truncadas N-terminales el ácido glutámico mantiene la primera posición. Este aa no es estable, pero experimenta más bien un cambio para transformarse en el piroglutamato (pE), dando lugar a la formación de App(E)3-40/42 y App(E)11-40/42. Los residuos de pE se forman, bien espontánea o enzimáticamente, mediante enzimas conocidos como glutaminil ciclasas.
Hasta recientemente, el diagnóstico de AD era uno puramente clínico, basado en la aparición gradual de déficits cognitivos en, por lo menos, dos ámbitos (por ejemplo, de comprensión, y funcional), que afectan negativamente a la vida diaria del paciente, sin que se encontrara otra causa que los provoque (por ejemplo, vascular). La limitación del diagnóstico clínico de AD consistió en altas tasas de diagnóstico equivocado (especificidad diagnóstica del 80% por los expertos), y en el hecho de que el diagnóstico se pudiera realizar solamente en un momento tardío, cuando la enfermedad había causado una pérdida neuronal sustancial, que ha producido ya déficits funcionales.
Basándose en el conocimiento reunido durante las dos últimas décadas, la forma de diagnosticar AD está cambiando rápidamente. Un grupo de investigadores comandado por B. Dubois, París, fue el primero en integrar datos que se habían puesto de manifiesto a partir de las investigaciones subyacentes a la patología AD, en el algoritmo diagnóstico (Dubois et al., Lancet Neurol. 9 (2010): 1118-1127). Según los autores, el diagnóstico de AD se basa en un déficit cognitivo específico (una alteración de la memoria episódica), que tiene que producirse combinada con un cambio en los biomarcadores específicos de la enfermedad (atrofia hipocámpica detectada mediante MRI estructural; típica de AD del líquido cerebroespinal) A42 bajo, tan total alta, alta fosfotau); imagen amiloidea positiva; riesgo genético definido). Recientemente, este algoritmo diagnóstico conducido patofisiológicamente ha sido adoptado ampliamente por el grupo de trabajo NIH-NINCDS (McKhann et al., Alzheimers & Dementia 7 (2011): 263-269). Con propósitos principalmente prácticos, el grupo de trabajo NIH- NINCDS mantuvo el diagnóstico del MCI (alteración cognitiva leve del tipo AD como un estadio temprano de AD.
El concepto de potenciación del diagnóstico clínico de AD mediante biomarcadores, que reflejen la patología de la enfermedad, ha sido adoptado por un grupo de trabajo propiciado por el Instituto Nacional del Envejecimiento (NIA, NIH, USA) y la Asociación Alzheimer, llevando esto a cabo, AD no constituye ya un diagnóstico por exclusión, sino que empieza a ser ya uno positivo. El hecho de que NIA y AA no sigan completamente el algoritmo conducido (gobernado) por los biomarcadores, propuesto por Dubois y colaboradores, refleja las limitaciones de los biomarcadores habitualmente disponibles. El distintivo del líquido cefalorraquídeo (CSF) de AD, puede ponerse como ejemplo. El CSF de los pacientes de AD muestra un patrón típico, principalmente la reducción de Api-42 y la elevación de la Tau total (tTau) y de la fosfoTau (pTau). El distintivo se encuentra en los pacientes AD, pero no detecta un cambio a lo largo del tiempo. De hecho, en una población de pacientes con riesgo de AD (es decir, pacientes MCI), identifica aquellos que van a desarrollar los síntomas clínicos. Ya en este estadio, el CSF muestra idéntico patrón de expresión y cambio que en los pacientes con AD pleno. De este modo, mientras que no sea posible definir un intervalo normal para Api-42, tTau y pTau, no existe definición de los momentos cruciales, es decir, del momento en un paciente dado cuando por ejemplo, la fisiología de Ap cambia de normal a patológica. Lo mismo es cierto para cualquiera de los biomarcadores habitualmente seguidos y que todavía no se han validado. La razón principal para esto es que sólo existen pocos estudios longitudinales que evalúan esta cuestión, a causa de que no es posible fácilmente repetir CSF-, MRI, exámenes de imaginería amiloide, a causa del riesgo que imponen a los pacientes y a los costes que con ellos se asocien.
De este modo, falta todavía un biomarcador fiable que pueda aplicarse repetitivamente, con costes y riesgos bajos. Es verdad especialmente que todos los esfuerzos que se han llevado a cabo hasta la fecha para desarrollar biomarcadores AD basados en la sangre, fallaron (Hampel et al., Nat. Rev. Drug Discov. 9 (2010): 560-574). La
disponibilidad de tales biomarcadores deberá ser de la mayor importancia para el desarrollo de terapias modificadoras de enfermedades. Cuanto más pronto se administren dichas terapias, más grandes serán las posibilidades de suerte. Y, se pueden limitar dichos esfuerzos a los casos verdaderos de AD, con la ayuda de un biomarcador específico.
Así hasta ahora, Ap (varias especies de Ap y estados de agregación), se han evaluado en AD y MCI, el estadio predemencia de AD. Hallazgos recientes muestran que existe una actividad amiloidogénica de IgG e IgM contenidos en el plasma y en el líquido cerebroespinal de los pacientes AD y en los controles sanos (ONuallain et al., J. Clin. Immunol. 30 (2010) Suppl.1: S37-S42; Marcello et al., J. Neural. Transm. 116 (2009): 913-920). Resultados obtenidos mediante ELISA, o ensayos de inmunoprecipitación que evalúan IgG y/o IgM específicos para varios de los estados de agregación/formas de Ap, mostraron que los pacientes AD- y MCI mostraron niveles más bajos de auto-anticuerpos Ap séricos que los controles sanos. Aunque estos estudios mostraron una diferencia en la concentración de auto-anticuerpos, los procedimientos que se utilizaron adolecieron de la sensibilidad y especificidad que hubieran sido necesarias para utilizarlos como herramientas de diagnóstico predictivo para identificar pacientes AD o MCI con alta selectividad y especificidad. La mayoría de los procedimientos utilizados hasta la fecha, se basan en la tecnología ELISA. Para aumentar la sensibilidad en estos ensayos, algunos utilizan mareaje radioactivo del péptido A(31 -42. El análisis ROC (receptor característico operacional) de Brettschneider et al., (Brettschneider et al., Biol.. Psychiatry 57 (2005): 813-817), alcanzó una especificidad del 46,7% cuando la sensibilidad se fijó al 81,3%, utilizando un ensayo de inmunoprecipitación con A(31 -42 marcada con cloramina T, para mediar la diferencia entre los controles sanos y los pacientes AD. Al contrario que esto, Bayer et al. (WO 2010/128139 Al; Marcello et al., J Neural. Transm. 116 (2009): 913-920), utilizaron un procedimiento basado en ELISA, en el que la placa se revistió con un fragmento de piroglutamato-Ap. En este caso, la detección de los auto- anticuerpos IgM anti Ap específicos en los controles sanos y en los pacientes AD con anticuerpos anti-IgM-HRP mostró que la especificidad era del 60% cuando la sensibilidad se fijó en 80%. Hasta ahora, ninguno de estos procedimientos cumplió los criterios que los hubiera calificado como biomarcadores predictores (>80% especificidad) para AD.
No se conoce la razón para la reducida concentración sérica de los anticuerpos... [Seguir leyendo]
Reivindicaciones:
1. Procedimiento para detectar anticuerpos Ap-específicos en una muestra biológica, que comprende las etapas siguientes:
- poner en contacto la muestra con agregados Ap o con perlas con agregados Ap inmovilizados en su superficie, y permitir que los anticuerpos Ap específicos se unan a los agregados Ap, y
- detectar los anticuerpos Ap-específicos que están unidos a los agregados Ap, mediante una técnica de detección de partículas individuales, preferentemente mediante la clasificación de células activadas por fluorescencia (FACS).
2. Procedimiento según la reivindicación 1, caracterizado por que los anticuerpos Ap-específicos son anticuerpos humanos, preferentemente anticuerpos IgG o IgM humanos, especialmente anticuerpos IgG humanos.
3. Procedimiento según la reivindicación 1 o 2, caracterizado por que los anticuerpos Ap-específicos son auto- anticuerpos.
4. Procedimiento según cualquiera de las reivindicaciones 1 a 3, caracterizado por que los agregados Ap tienen un tamaño de 50 nm a 15 pm, preferentemente de 100 nm a 10 pm, especialmente de 200 nm a 5 pm.
5. Procedimiento según cualquiera de las reivindicaciones 1 a 4, caracterizado por que los agregados Ap se han preparado incubando los péptidos Ap-1-42, Ap-1-43, Ap-3-42 o Ap-p(E)3-42, a un pH de 2 a 9, durante por lo menos 20 minutos, preferentemente por lo menos durante 1 hora, y especialmente por lo menos durante 4 horas.
6. Procedimiento según cualquiera de las reivindicaciones 1 a 5, caracterizado por que los agregados Ap están presentes para poner en contacto la muestra con los agregados Ap en una cantidad comprendida entre 0,001 y 1 pm, preferentemente entre 0,01 y 0,1 pM.
7. Procedimiento según cualquiera de las reivindicaciones 1 a 6, caracterizado por que la muestra biológica es sangre humana o una muestra derivada de sangre humana, preferentemente suero humano o plasma humano; líquido cefalorraquídeo humano o linfa humana.
8. Procedimiento según cualquiera de las reivindicaciones 1 a 7, caracterizado por que los agregados Ap se ponen en contacto con la muestra durante por lo menos 10 minutos, preferentemente entre 10 minutos y 24 horas, y especialmente entre 20 minutos y 2 horas.
9. Procedimiento según cualquiera de las reivindicaciones 1 a 8, caracterizado por que se lleva a cabo una etapa de desenmascaramiento sobre los anticuerpos Ap en la muestra, antes de poner en contacto la muestra con los agregados Ap, especialmente si se detectan anticuerpos IgM.
10. Procedimiento según cualquiera de las reivindicaciones 1 a 9, caracterizado por que las perlas son especialmente perlas magnéticas.
11. Utilización de un procedimiento según cualquiera de las reivindicaciones 1 a 10, para el diagnóstico de la enfermedad de Alzheimer (AD).
12. Utilización de un procedimiento según cualquiera de las reivindicaciones 1 a 10, para la monitorización de pacientes AD, especialmente pacientes AD que sean tratados con medicamentos para la curación o la mejora de AD.
13. Utilización de un procedimiento según cualquiera de las reivindicaciones 1 a 10, para evaluar el riesgo de desarrollar AD o para detectar un estadio temprano de AD.
14. Utilización de un procedimiento según cualquiera de las reivindicaciones 1 a 10, para el diagnóstico de la demencia de Parkinson (PDD), Demencia con cuerpos de Lewy (DLB), Angiopatía Amiloide Cerebral (CAA), miositis de cuerpos de inclusión (IBM), o trauma cefálico crónico.
15. Utilización de un kit, que incluye:
- unos agregados Ap, y
un contenedor de muestras
para llevar a cabo el procedimiento según cualquiera de las reivindicaciones 1 a 10.
Patentes similares o relacionadas:
Biomarcador de enfermedad autoinmunitaria, del 15 de Julio de 2020, de Tzartos, Socrates: Un método de diagnóstico o pronóstico de una enfermedad autoinmunitaria asociada con la formación de lesiones desmielinizadas del sistema nervioso central (SNC) […]
ANTICUERPO SÉRICO IGM-PC COMO BIOMARCADOR DE LA ESCLEROSIS MÚLTIPLE, Y NUEVA ELISA ULTRASENSIBLE PARA EL DIAGNÓSTICO DE ESTA ENFERMEDAD, del 2 de Julio de 2020, de FUNDACION UNIVERSITARIA SAN PABLO CEU: Anticuerpo sérico IgM frente a fosfatidilcolina (IgM-PC) para ser utilizado como biomarcador de la esclerosis múltiple (EM) y de las diferentes fases de esta enfermedad, […]
Ensayos para la detección de fármacos anti-TNF y autoanticuerpos, del 8 de Abril de 2020, de Prometheus Biosciences, Inc: Un método para determinar la presencia o el nivel de un fármaco anti-TNFa en una muestra biológica, en la que el fármaco anti-TNFa es un […]
Composiciones y métodos para el diagnóstico de la artritis reumatoide, del 4 de Marzo de 2020, de Inova Diagnostics, Inc: Un complejo que comprende un polipéptido purificado que comprende una alfa-1-antitripsina humana (hA1AT) carbamilada in vitro, o uno de sus fragmentos, y […]
Procedimientos y kits de supervisión de la nefropatía membranosa, del 15 de Enero de 2020, de uroimmun Medizinische Labordiagnostika AG: Un procedimiento in vitro para diagnosticar y/o pronosticar la nefropatía membranosa en un paciente, comprendiendo dicho procedimiento la etapa de detectar en una […]
Procedimiento de determinación de las concentraciones activas y/o de las constantes cinéticas de interacción en muestras biológicas complejas en resonancia de plasmón superficial, del 8 de Enero de 2020, de Université de Bordeaux: Método para determinar en muestras biológicas complejas en resonancia de plasmón superficial la concentración activa de un analito y, facultativamente, las constantes […]
Método para la medición de anticuerpos anti-fármaco, del 25 de Diciembre de 2019, de JIMRO CO., LTD: Un método para medir anticuerpos anti-fármaco (ADA) en un analito a medir, comprendiendo el método: una etapa de proporcionar una muestra […]
Procedimientos para determinar el riesgo de diabetes tipo 1 mediante biomarcadores de proteínas séricas, del 28 de Octubre de 2019, de TURUN YLIOPISTO: Un procedimiento para predecir, determinar y/o monitorizar un riesgo de y/o progresión hacia la diabetes tipo 1 (T1D) en un individuo, comprendiendo el procedimiento: a) determinar […]