Células madre mesenquimales CD34 negativas modificadas genéticamente para el tratamiento de tumores.
Células madre mesenquimales CD34- genéticamente modificadas para su uso en el tratamiento de tumores en sujetos,
en donde el tratamiento comprende introducir en el torrente sanguíneo de un sujeto un número terapéuticamente efectivo de dichas células, en donde cada una de las células madre CD34 - genéticamente modificadas contiene un ácido nucleico exógeno que comprende (i) una región que codifica para una proteína citotóxica unida operativamente a (ii) un promotor o combinación de promotor/potenciador específicos de endotelio, mediante el cual la proteína citotóxica se expresa de manera selectiva cuando las células madre CD34- mesenquimales genéticamente modificadas se sitúan en la proximidad de, y se diferencian en células de tipo endotelial en la proximidad de tejido tumoral que esté sufriendo angiogénesis, y en donde la introducción de un número terapéuticamente efectivo de las células madre CD34- genéticamente modificadas en el torrente sanguíneo del sujeto no está precedido, acompañado o seguido de mieloablación
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2008/006434.
Solicitante: APCETH GMBH & CO. KG.
Nacionalidad solicitante: Alemania.
Dirección: MAX-LEBSCHE-PLATZ 30 81377 MÜNCHEN ALEMANIA.
Inventor/es: HUSS, RALF, NELSON,PETER, RAGGI,MATTHIAS, STANGL,MANFRED.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K45/00 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › Preparaciones medicinales que contienen ingredientes activos no previstos en los grupos A61K 31/00 - A61K 41/00.
- C12N5/0775 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 5/00 Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00). › Células madre mesenquimales; Células madre derivadas de tejido adiposo.
PDF original: ES-2507507_T3.pdf


Fragmento de la descripción:
Células madre mesenquimales CD34 negativas modificadas genéticamente para el tratamiento de tumores Antecedentes de la invención 1. Campo de la invención
A lo largo de esta solicitud se citan varias publicaciones. La divulgación de estas publicaciones, así como de las solicitudes provisionales anteriormente identificadas se usa para describir en más detalle el estado de la técnica a la que pertenece esta invención.
Las células madre median en la reproducción y transmisión de información genética a generaciones celulares posteriores. Pueden autorrenovarse y generar progenie diferenciada. En los últimos años se ha progresado en la comprensión de los mecanismos moleculares que subyacen a las interacciones entre células madre y sus nichos tisulares. Esto ha conducido a una mejor comprensión de los mecanismos reguladores moleculares en funcionamiento en células madre.
Aunque la terapia génica está todavía en un enfoque experimental, la tecnología promete tener un impacto sobre la salud humana. El alcance y la definición de la terapia génica han cambiado y se han expandido a lo largo de los últimos pocos años. Además de corregir trastornos genéticos heredados tales como fibrosis quística, hemofilia y otras entidades, también están desarrollándose enfoques de terapia génica para combatir enfermedades adquiridas tales como cáncer, SIDA, isquemia vascular crónica, osteoartritis, diabetes, enfermedad de Parkinson y de Alzheimer.
En la actualidad, no está contemplándose la terapia génica de la línea germinal debido a su naturaleza técnica completa y consideraciones éticas. Sin embargo, la terapia génica de células somáticas exclusivamente para el beneficio de un individuo (que no puede pasarse a generaciones subsiguientes) es un foco principal de la investigación en células madre. Ha llevado más de 15 años de esfuerzo desde la descripción inicial de la transferencia génica satisfactoria a células madre hematopoyéticas murinas hasta los primeros ensayos clínicos inequívocamente satisfactorios en pacientes nacidos con inmunodeficiencia combinada ligada al cromosoma X (SCID) y deficiencia en adenosina desaminasa (ADA) (Aiuti etal., 22; Cavazzana-Calvo etal., 2; Gaspar etal., 24). Están explorándose muchos aspectos de la terapia con células madre. Por ejemplo, se han usado vectores retrovirales en muchas situaciones para la transferencia de genes a células madre para reparar genes mutados o incompletos. Estos incluyen deficiencia inmunitarias combinadas graves, anemia de Fanconi y otras hemoglobinopatías (Herzog etal., 26).
Un problema central en la modificación por ingeniería genética de células madre es la metodología específica usada para introducir genes terapéuticos en las células progenitoras. Debido a que los retrovirus tienden a insertarse en genes activos (se cree la cromatina condensada se abre en estas regiones), se ha sugerido que su uso puede aumentar también el riesgo de cáncer (Young et al., 26), porque la inserción de vectores retrovirales próximos a genes implicados en proliferación celular podría generar en teoría una célula madre cancerosa precursora. Sin embargo, el riesgo global de este tipo de acontecimiento es difícil de establecer. Hay ahora muchos ejemplos de éxito completo logrado en pacientes con enfermedad granulomatosa crónica (CGD) en los que se restauró la actividad NADPH oxidasa tras la infusión de células madre sanguíneas genéticamente alteradas (Barese et al., 24).
El requisito mínimo para lograr una terapia génica productiva es la producción sostenida del producto génico terapéutico en el contexto biológico correcto con efectos secundarios perjudiciales mínimos. Para lograr este fin, la aplicación de células madre en terapia génica requerirá el desarrollo de nuevas estrategias para modular la expresión de genes terapéuticos, así como métodos para el suministro eficaz de genes foráneos a células madre. El control selectivo de la expresión de genes terapéuticos por células madre en diferenciación dentro de un entorno tisular definido es un importante objetivo en la modificación por ingeniería genética de células madre. Este enfoque podría ayudar, por ejemplo, en el control de la diferenciación de células madre para dar linajes específicos, el mantenimiento de su estado no diferenciado para su posterior trasplante, proliferación y regulación de la expresión de genes terapéuticos tales como genes suicidas, citocinas o factores de crecimiento en entornos tisulares definidos.
Sumario de la invención
Esta invención proporciona células madre mesenquimales CD34' genéticamente modificadas para su uso en el tratamiento de tumores en sujetos, en donde el tratamiento comprende introducir en el torrente sanguíneo del sujeto un número terapéuticamente efectivo de dichas células, en donde cada una de las células madre CD34" genéticamente modificadas contiene un ácido nucleico exógeno que comprende (i) una región que codifica una proteína citotóxica que está operativamente unida a (ii) un promotor específico de endotelio o combinación de promotor/potenciador, mediante el cual la proteína citotóxica se expresa de manera selectiva cuando las células madre CD34' genéticamente modificadas entran en proximidad con y se diferencian en células de tipo endotelial en
proximidad con tejido tumoral que está sufriendo angiogénesis, yen donde la introducción de las células madre CD34" genéticamente modificadas no se ve precedida, acompañada o seguida por mieloablación.
Otros objetos y características de la presente invención resultarán evidentes a partir de la siguiente descripción detallada considerada conjuntamente con los dibujos adjuntos. Sin embargo, debe entenderse que los dibujos están diseñados únicamente para fines de ilustración y no como una definición de los límites de la invención, para los que debe hacerse referencia a las reivindicaciones adjuntas. Debe entenderse además que los dibujos no están necesariamente dibujados a escala y que, a menos que se indique lo contrario, están destinados meramente a ilustrar conceptualmente las estructuras y los procedimientos descritos en el presente documento.
Breve descripción de los dibujos
En los dibujos:
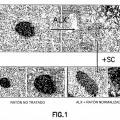
Figura 1
Fila superior: expresión de insulina en un islote p murino normal antes (izquierda) y después del tratamiento con aloxano (ALX) (derecha) con agotamiento de la insulina casi completo. Fila inferior: tamaño de un islote p normal que produce insulina a diferentes aumentos (2x; 4x); el tratamiento del islote p agotado en insulina tras el tratamiento con ALX con células madre negativas para CD34 (SC) restaura completamente la producción de insulina con signos de hipertrofia (2x y 4x).
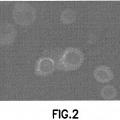
Figura 2
Células aisladas de un páncreas murino tras la diabetes inducida por ALX y la restauración con SC de la producción de insulina. Se marcaron las células madre negativas para CD34 trasplantadas con una proteína fluorescente verde expresada de manera constitutiva y las células que producían insulina mostraban una fluorescencia roja. No hubo expresión conjunta de ambos marcadores, lo que sugiere que las células madres trasplantadas no expresan insulina por sí misma sino que más bien facilitan la regeneración endógena.
Finura 3
Izquierda: Niveles de glucemia de ratones tras el tratamiento con ALX sin trasplante de SC (parte superior), con trasplante de SC y sin corrección del nivel de glucemia (parte media) y ratones con un nivel de glucemia normalizado tras el trasplante de SC (parte inferior). Derecha: Sólo los ratones que revelaron la presencia de células madre en sus páncreas (homogeneizados para el análisis de FACS y la detección de la fluorescencia verde) (E3; círculo de color rojo) mostraron un nivel de glucemia normalizado, lo que sugiere el papel fundamental de las células trasplantadas en la corrección de la producción de insulina.
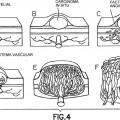
Figura 4
Presentación esquemática del desarrollo de un tumor maligno epitelial desde un carcinoma in situ hasta cáncer invasivo y la conexión con el sistema de vasos sanguíneos endógenos. Las células madre negativas para CD34 se dirigen a un sitio de neo-angiogénesis tal como se demuestra en el presente documento y por tanto pueden utilizarse como caballo de Troya para suministrar agentes moduladores inmunitarios o citotóxicos.
Figura 5
Detección de células positivas para RFP en tumores mamarios. Células madre transfectadas con Tie2-RFP se diferencian a endoteliales y transcriben el RFP. (A) Contrateñidas con DAPI. (B) Células positivas para RFP que forman vasos.
Figura 6
Reducción de la progresión tumoral con tratamiento con GCV. (A) Protocolo de aplicación... [Seguir leyendo]
Reivindicaciones:
1. Células madre mesenquimales CD34' genéticamente modificadas para su uso en el tratamiento de tumores en sujetos, en donde el tratamiento comprende introducir en el torrente sanguíneo de un sujeto un número terapéuticamente efectivo de dichas células, en donde cada una de las células madre CD34' genéticamente modificadas contiene un ácido nucleico exógeno que comprende (i) una región que codifica para una proteína citotóxica unida operativamente a (ii) un promotor o combinación de promotor/potenciador específicos de endotelio, mediante el cual la proteína citotóxica se expresa de manera selectiva cuando las células madre CD34' mesenquimales genéticamente modificadas se sitúan en la proximidad de, y se diferencian en células de tipo endotelial en la proximidad de tejido tumoral que esté sufriendo angiogénesis, y en donde la introducción de un número terapéuticamente efectivo de las células madre CD34' genéticamente modificadas en el torrente sanguíneo del sujeto no está precedido, acompañado o seguido de mieloablación.
2. Las células madre CD34' mesenquimales genéticamente modificadas para el uso de la reivindicación 1, en donde el sujeto es humano.
3. Las células madre mesenquimales CD34' genéticamente modificadas para el uso de cualquiera de las reivindicaciones 1 o 2, en donde el tumor se selecciona del grupo que consiste en un tumor de próstata, un tumor pancreático, un carcinoma de células escamosas, un tumor de mama, un melanoma, un carcinoma de células básales, un carcinoma hepatocelular, cáncer testicular, un neuroblastoma, un glioma o un tumor astrocítico maligno tal como un glioblastoma multiforme, un tumor colorrectal, un carcinoma endometrial, un carcinoma de pulmón, un tumor ovárico, un tumor de cuello de útero, un osteosarcoma, un rabdo/leiomiosarcoma, un sarcoma sinovial, un angiosarcoma, un sarcoma de Ewing/PNET y un linfoma maligno.
4. Las células madre mesenquimales CD34'genéticamente modificadas para el uso de la reivindicación 3, en donde el tumor es un tumor pancreático.
5. Las células madre mesenquimales CD34' genéticamente modificadas para el uso de la reivindicación 3, en donde el tumor es un cáncer de mama.
6. Las células madre mesenquimales CD34' genéticamente modificadas para el uso de la reivindicación 2, en donde el tumor es un tumor vascularizado.
7. Las células madre mesenquimales CD34" genéticamente modificadas para el uso de la reivindicación 2, en donde el tumor es un tumor primario.
8. Las células madre mesenquimales CD34" genéticamente modificadas para el uso de la reivindicación 2, en donde el tumor es un tumor metastásico.
9. Las células madre mesenquimales CD34" genéticamente modificadas para el uso de cualquiera de las reivindicaciones 1 a 6, en donde la combinación de promotor/potenciador es el promotor/potenciador Tie2, la proteína citotóxica es la timidina cinasa viral de Herpes simplex, y el sujeto se trata con ganciclovir de tal modo que permite que la timidina cinasa viral de herpes simplex haga que el ganciclovir sea citotóxico.
1. Las células madre mesenquimales CD34" genéticamente modificadas para el uso de cualquiera de las reivindicaciones 1 a 9, en donde las células madre CD34' genéticamente modificadas son alogénicas con respecto al sujeto.
11. Las células madre mesenquimales CD34" genéticamente modificadas para el uso de cualquiera de las reivindicaciones 1 a 9, en donde las células CD34" genéticamente modificadas son autólogas con respecto al sujeto.
12. Las células madre mesenquimales CD34" genéticamente modificadas para el uso de cualquiera de las reivindicaciones 1 a 11, en donde el número terapéuticamente efectivo de células madre CD34" genéticamente modificadas es de 1 x 13 a 1 x 17 células/kg de peso corporal.
13. Las células madre mesenquimales CD34" genéticamente modificadas para el uso de cualquiera de las reivindicaciones 1 a 12, en donde el número terapéuticamente efectivo de células madre CD34" genéticamente modificadas es de 1 x 14 a 1 x 16 células/kg de peso corporal.
14. Las células madre mesenquimales CD34" genéticamente modificadas para el uso de la reivindicación 2, en donde el número terapéuticamente efectivo de células madre CD34" genéticamente modificadas es 1 x 15 células/kg de peso corporal.
15. Las células madre mesenquimales CD34" genéticamente modificadas para el uso de cualquiera de las reivindicaciones 1 a 14, en donde las células madre CD34" genéticamente modificadas se administran mediante una sola inyección.
16. Las células madre mesenquimales CD34' genéticamente modificadas para el uso de cualquiera de las reivindicaciones 1 a 15, en donde las células madre CD34- genéticamente modificadas se administran mediante inyecciones repetidas en el tiempo.
Patentes similares o relacionadas:
Preparación externa líquida, del 29 de Julio de 2020, de HISAMITSU PHARMACEUTICAL CO. INC.: Una preparación tópica líquida, que comprende: agua; oxibutinina o una sal farmacéuticamente aceptable de la misma; y un éster de ácido dicarboxílico, […]
Anticuerpos del OPGL, del 15 de Julio de 2020, de AMGEN FREMONT INC.: Un anticuerpo, que comprende una cadena pesada y una cadena ligera, donde: a) la cadena pesada comprende: 1) una secuencia de aminoácidos recogida […]
Agente profiláctico y/o agente terapéutico para el linfoma difuso de células B grandes, del 17 de Junio de 2020, de ONO PHARMACEUTICAL CO., LTD.: 6-amino-9-[(3R)-1-(2-butinoil)-3-pirrolidinil]-7-(4-fenoxifenil)-7,9-dihidro-8H-purin-8-ona, una sal de la misma, un solvato de la misma o un N-óxido de la misma, […]
Tratamiento de glucogenosis de tipo II, del 20 de Mayo de 2020, de DUKE UNIVERSITY: α-Glucosidasa ácida (GAA) humana recombinante producida en un cultivo de células de ovario de hámster chino para uso en un método de tratamiento de glucogenosis […]
Composición farmacéutica para el tratamiento o la paliación de pacientes con cáncer ancianos o en estado terminal, del 6 de Mayo de 2020, de Delta-Fly Pharma, Inc: Una composición farmacéutica para su uso en el tratamiento de cáncer, que comprende, como principio activo, ácido (2S)-2-(2S,3R)-3-amino-2-hidroxi-4-fenilbutanoilamino]-4-metilpentanoico […]
Enfoque dirigido a GDF6 y a señalización de BMP para la terapia contra el melanoma, del 6 de Mayo de 2020, de UNIVERSITY OF MASSACHUSETTS: Un inhibidor de GDF6 para su uso en el tratamiento de un melanoma en un sujeto, que comprende administrar a un sujeto que lo necesite una cantidad eficaz […]
Lipopéptidos de alta pureza, micelas de lipopéptidos y procesos para preparar los mismos, del 6 de Mayo de 2020, de Cubist Pharmaceuticals LLC: Un método para purificar daptomicina a partir de moléculas o agregados de alto peso molecular, en donde la daptomicina se proporciona en forma micelar, dicho […]
Un canal catiónico no selectivo en células neurales y compuestos que bloquean el canal para su uso en el tratamiento de la inflamación del cerebro, del 6 de Mayo de 2020, de UNIVERSITY OF MARYLAND, BALTIMORE: Un antagonista de SUR1 que bloquea el canal de NCCa-ATP para su uso en (a) la prevención o el tratamiento de la inflamación de las células neurales […]