Vacunas polivalentes de ADN de glicoproteína de VIH-1 primaria y procedimientos de vacunación.
Un composición de ácido nucleico que comprende
(a) al menos tres moléculas de ácidos nucleicos diferentes que codifican glicoproteínas de la envuelta gp120 del virus de la inmunodeficiencia humana 1 (VIH-1),
en la que cada molécula de ácido nucleico codifica una glicoproteína de la envuelta de una cepa aislada primaria de un clado seleccionado del grupo que consiste en los clados A, B, C y E; y
(b) una molécula de ácido nucleico que codifica una proteína gag del VIH de una cepa aislada primaria.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2003/038640.
Solicitante: UNIVERSITY OF MASSACHUSETTS.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 225 Franklin Street, 12th Floor Boston, MA 02110 ESTADOS UNIDOS DE AMERICA.
Inventor/es: PAL, RANAJIT, LU,SHAN, WANG,SHIXIA, KALYANARAMAN,V. S, WHITNEY,STEPHEN CHARLES, KEEN,TIM, NAIR,BALACHANDRAN C, MARKHAM,PHILLIP.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K39/00 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53).
- A61K39/21 A61K […] › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Retroviridae, p. ej. virus de la anemia infecciosa equina.
- A61K39/295 A61K 39/00 […] › Antígenos virales polivalentes (virus de la viruela o de la varicela A61K 39/285 ); Mezclas de antígenos virales y bacterianos.
- C07K14/16 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › VIH-1.
PDF original: ES-2416629_T3.pdf
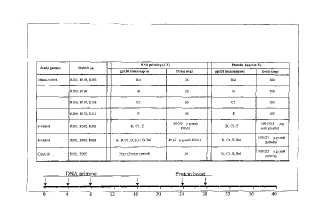
Fragmento de la descripción:
Vacunas polivalentes de ADN de glicoproteína de VIH-1 primaria y procedimientos de vacunación
CAMPO TÉCNICO
La invención se refiere a composiciones para el tratamiento del síndrome de inmunodeficiencia adquirida (SIDA) .
ANTECEDENTES
El virus de la inmunodeficiencia humana (VIH) es el agente etiológico del SIDA. Hay dos tipos de VIH actualmente reconocidos, VIH-1 y VIH-2. El VIH-1 es la forma predominante en el mundo. La forma de VIH-1 que domina la epidemia global se llama el grupo principal de VIH-1. Hay tres grupos de VIH-1, el grupo principal (grupo M) , el grupo divergente (grupo O) y el grupo no M/no O (grupo N) . El grupo N se divide adicionalmente en al menos once subtipos genéticos distintos que se denominan comúnmente clados, A, B, C, D, E, F, G, H, I, J y K, con más secuencias esperando a ser clasificadas. El clado B es el más prevalente en los Estados Unidos, mientras que el clado D es el más prevalente en el mundo. La distribución geográfica de los subtipos genéticos está cambiando continuamente, y los datos presentes ofrecen cálculos estimados incompletos.
Aproximadamente el 95% de las nuevas infecciones por el VIH están produciéndose en países desarrollados, por tanto, una vacuna puede ser la forma más eficaz para controlar la epidemia. Sin embargo, el desarrollo de vacunas eficaces para prevenir la infección por el VIH o neutralizar la infección por el VIH ha sido un reto difícil para la comunidad científica. Es un objetivo primario desarrollar una vacuna del VIH que pueda provocar eficazmente anticuerpos neutralizantes antivirales específicos, además de respuestas inmunitarias mediadas por células, para prevenir la infección y controlar la propagación del VIH, con una posibilidad de amplitud considerable de reactividad a través de clados genéticos. NYAMBI P.N. Y COL. describen que la inmunorreactividad de viriones intactos del tipo 1 del virus de la inmunodeficiencia humana (VIH-1) revela la existencia de menos inmunotipos del VIH-1 que genotipos (J. VIROL. vol. 74, nº 22, noviembre de 2000, páginas 10670 - 10680) . El documento US 6139843 desvela composiciones de péptido para el tratamiento del VIH que comprenden péptidos de diferentes cepas aisladas primarias. El extraordinario grado de diversidad genética del VIH ha sido problemático para el desarrollo de vacunas (Fomsgaard, Immunology Letters 1999, 65:127-131, informa de una vacuna de mini-genes multi-valente usada para inducir una respuesta CTL que engloba una parte más ancha del alto grado de diversidad de antígenos del VIH. Un único plásmido que codifica un conjunto de epítopes mínimos se usó en vacunación de ADN con pistola de genes) .
RESUMEN
La invención se define por las reivindicaciones adjuntas.
Los procedimientos y composiciones en el presente documento se proporcionan basándose, en parte, en el descubrimiento de que vacunas polivalentes de ADN de cepas aisladas primarias como se define por las reivindicaciones inducen eficazmente una respuesta inmunitaria contra el VIH (por ejemplo, VIH-1) . También se ha descubierto que refuerzos con composiciones de proteínas del VIH recombinantes aumentan respuestas inmunitarias contra el VIH en sujetos a los que se les ha administrado una vacuna polivalente de ADN de cepas aisladas primarias. La invención se define por las reivindicaciones adjuntas.
Se desvelan composiciones de ácido nucleico que incluyen una pluralidad de conjuntos de moléculas de ácidos nucleicos, por ejemplo, plásmidos de ADN, codificando cada molécula de ácido nucleico un virus de la inmunodeficiencia humana (VIH) , por ejemplo, VIH-1, glicoproteína de la envuelta, en las que cada conjunto de moléculas de ácidos nucleicos codifica un tipo diferente de glicoproteína de la envuelta del VIH, o comprende una secuencia de cepa aislada primaria de un clado genético distinto. Los ácidos nucleicos pueden ser secuencias naturales o secuencias que son el 80, 90, 95, 98 o el 99 por ciento idénticas a secuencias naturales. Las proteínas codificadas pueden ser secuencias naturales, o pueden incluir conservación de sustituciones de aminoácidos, por ejemplo, en 1 en 10, 1 en 20, 1 en 30, o menos, por ejemplo, 1, 2, 5 ó 10 localizaciones de aminoácidos. En ciertas realizaciones pueden usarse secuencias consenso (basadas en una colección de diferentes secuencias naturales) .
La glicoproteína de la envuelta del VIH puede ser una cualquiera o más de gp120, gp140, gp160 y gp41. Las composiciones de ácido nucleico pueden incluir adicionalmente un conjunto de moléculas de ácidos nucleicos que codifican una proteína gag del VIH. Las glicoproteínas de la envuelta pueden ser de un clado de un grupo importante (M) de clados, por ejemplo, el clado puede ser el clado A, B, C, D, E, F, G, H, I, J o K. Alternativamente, la glicoproteína de la envuelta puede ser de un clado de un grupo divergente (O) de clados o un grupo N de clados. La glicoproteína de la envuelta puede ser una glicoproteína de la envuelta de una cepa aislada Ba-L o una cepa aislada B715. El clado puede ser el clado C. La glicoproteína de la envuelta puede ser de una cepa aislada Czm. Uno o más de los conjuntos de ácidos nucleicos pueden incluir uno o más codones optimizados.
En otro aspecto se desvelan composiciones de ácido nucleico que incluyen una pluralidad de conjuntos de moléculas de ácidos nucleicos, en las que la pluralidad incluye dos o más de los siguientes conjuntos: un conjunto de moléculas de ácidos nucleicos, codificando cada uno una glicoproteína de la envuelta del virus de la inmunodeficiencia humana (VIH) del clado A; un conjunto de moléculas de ácidos nucleicos, codificando cada uno una glicoproteína de la envuelta del VIH del clado B; un conjunto de moléculas de ácidos nucleicos, codificando cada uno una glicoproteína de la envuelta del VIH del clado C; y un conjunto de moléculas de ácidos nucleicos, codificando cada uno una glicoproteína de la envuelta del VIH del clado E; en las que cada conjunto de moléculas de ácidos nucleicos codifica una secuencia de cepa aislada primaria de la glicoproteína de la envuelta. La composición pueden incluir adicionalmente un conjunto de moléculas de ácidos nucleicos que codifica una proteína gag del virus de la inmunodeficiencia humana (VIH) , en la que el conjunto codifica una secuencia de cepa aislada primaria de la proteína gag, por ejemplo, del clado C, y/o de la cepa aislada Czm. La proteína gag también puede ser una proteína gag del clado B.
La composición puede contener entre 50 µg y 2.500 µg de ácido nucleico de cada conjunto.
Se desvela adicionalmente una composición farmacéutica que contiene una o más de las nuevas composiciones descritas en el presente documento y un excipiente farmacéuticamente aceptable.
También se desvelan procedimientos para tratar un individuo con síndrome de inmunodeficiencia adquirida (SIDA) , administrando al individuo una cantidad de las nuevas composiciones farmacéuticas suficiente para inhibir la progresión de la enfermedad debido al virus de la inmunodeficiencia humana (VIH) . En estos procedimientos, el modo de administración puede ser administración tópica, administración por vía oral, inyección por aguja, inyección por chorro sin aguja, administración intradérmica, administración intramuscular y administración con pistola de genes. La respuesta inmunitaria puede ser una respuesta inmunitaria protectora, por ejemplo, una respuesta inmunitaria mediada por células, una respuesta inmunitaria humoral, o ambas.
En ciertos procedimientos, las nuevas composiciones pueden administrarse en combinación con una segunda terapia para infección por el VIH, por ejemplo, terapia con un inhibidor de la transcriptasa inversa de nucleósidos, terapia con un inhibidor de la transcriptasa inversa de no nucleósidos y/o terapia con un inhibidor de proteasas del VIH.
También se desvelan procedimientos de inducción de una respuesta inmunitaria contra el virus de la inmunodeficiencia humana (VIH) o un epítope del VIH en un mamífero vertebrado administrando al mamífero una cantidad de las nuevas composiciones suficiente para provocar una respuesta inmunitaria contra el VIH o un epítope del VIH en el mamífero vertebrado. Estos procedimientos pueden incluir adicionalmente aislar células inmunitarias del mamífero vertebrado; y probar una respuesta inmunitaria de las células inmunitarias aisladas in vitro. En estos procedimientos, la composición puede administrarse en múltiples dosis durante un periodo de tiempo prolongado (por ejemplo, durante un periodo de 2, 3, 4 semanas o más, por ejemplo, varios meses) .
Los procedimientos también pueden incluir administrar un adyuvante, refuerzo o facilitar el agente antes, durante o después de... [Seguir leyendo]
Reivindicaciones:
1. Un composición de ácido nucleico que comprende
(a) al menos tres moléculas de ácidos nucleicos diferentes que codifican glicoproteínas de la envuelta gp120 del virus de la inmunodeficiencia humana 1 (VIH-1) , en la que cada molécula de ácido nucleico codifica una glicoproteína de la envuelta de una cepa aislada primaria de un clado seleccionado del grupo que consiste en los clados A, B, C y E; y
(b) una molécula de ácido nucleico que codifica una proteína gag del VIH de una cepa aislada primaria.
2. La composición de ácido nucleico de la reivindicación 1, en la que la composición de ácido nucleico comprende al menos cuatro moléculas de ácidos nucleicos diferentes que codifican glicoproteínas de la envuelta gp120 del VIH-1, en la que cada molécula de ácido nucleico codifica una glicoproteína de la envuelta de una cepa aislada primaria de un clado seleccionado del grupo que consiste en los clados A, B, C y E.
3. La composición de ácido nucleico de la reivindicación 2, en la que las al menos cuatro moléculas de ácidos nucleicos diferentes codifican glicoproteínas de la envuelta gp120 del VIH-1 de las cepas aisladas primarias B715, Ba-L y Czm, y de una cepa aislada primaria del clado E.
4. La composición de ácido nucleico de la reivindicación 1, en la que las moléculas de ácidos nucleicos comprenden plásmidos de ADN.
5. La composición de ácido nucleico de la reivindicación 1, en la que la composición comprende un conjunto de moléculas de ácidos nucleicos que codifican glicoproteína de la envuelta gp120 de una cepa aislada primaria del clado A, opcionalmente en la que la cepa aislada primaria del clado A es 92UG037.8.
6. La composición de ácido nucleico de la reivindicación 1, en la que la composición comprende un conjunto de moléculas de ácidos nucleicos que codifican glicoproteína de la envuelta gp120 de una cepa aislada primaria del clado E, opcionalmente en la que la cepa aislada primaria del clado E es 93TH976.17.
7. La composición de ácido nucleico de la reivindicación 1, en la que la proteína gag del VIH-1 es una proteína gag de NL4-3, o en la que la proteína gag del VIH-1 es una proteína gag de una cepa aislada Czm.
8. La composición de ácido nucleico de la reivindicación 1, en la que el conjunto de moléculas de ácidos nucleicos que codifica la proteína gag comprende codones optimizados.
9. La composición de ácido nucleico de una cualquiera de las reivindicaciones 1-8, en la que una o más de las moléculas de ácidos nucleicos comprenden codones optimizados.
10. Una composición farmacéutica que comprende la composición de ácido nucleico de una cualquiera de las reivindicaciones 1-9 y un excipiente farmacéuticamente aceptable.
11. La composición farmacéutica de la reivindicación 10 que comprende además un segundo agente terapéutico para infección por el VIH.
12. La composición farmacéutica de la reivindicación 11, en la que el segundo agente terapéutico para infección por el VIH es un inhibidor de la transcriptasa inversa de nucleósidos, un inhibidor de la transcriptasa inversa de no nucleósidos o un inhibidor de proteasas del VIH.
13. La composición de una cualquiera de las reivindicaciones 1-10 para su uso en el tratamiento de un individuo con síndrome de inmunodeficiencia adquirida (SIDA) que inhibe la progresión de la enfermedad debido a un virus de la inmunodeficiencia humana (VIH) en el individuo.
14. La composición de la reivindicación 13 para su uso en el tratamiento de un individuo con SIDA, en la que la composición se formula para administración tópica, administración por vía oral, inyección por aguja, inyección por chorro sin aguja, administración intradérmica, administración intramuscular o administración con pistola de genes.
15. La composición de la reivindicación 13 para su uso en el tratamiento de un individuo con SIDA, en la que la composición está presente en una cantidad suficiente para provocar una respuesta inmunitaria contra el VIH o un epítope del VIH en el mamífero vertebrado.
16. La composición de la reivindicación 15 para su uso en el tratamiento de un individuo con SIDA, en la que el mamífero vertebrado es un ratón, una rata, un conejo, un primate no humano o un ser humano.
17. La composición de la reivindicación 15 para su uso en el tratamiento de un individuo con SIDA, en la que la composición se formula para administración tópica, administración por vía oral, inyección por aguja, inyección por
chorro sin aguja, administración intramuscular, administración intradérmica o administración con pistola de genes.
18. La composición de una cualquiera de las reivindicaciones 15-17 para su uso en el tratamiento de un individuo con SIDA, en la que el mamífero vertebrado es un ser humano.
19. La composición de la reivindicación 18 para su uso en el tratamiento de un individuo con SIDA, en la que el ser humano está en riesgo de, o infectado con, el virus de la inmunodeficiencia humana.
20. La composición de ácido nucleico de una cualquiera de las reivindicaciones 1-10 y una composición de proteína para su uso en inducir una respuesta inmunitaria humoral contra el virus de la inmunodeficiencia humana (VIH) o un epítope del VIH en un mamífero vertebrado, en la que la composición de proteína comprende moléculas de glicoproteínas de la envuelta del VIH aisladas de cada una de las cepas aisladas primarias en la composición de ácido nucleico, en la que la composición de proteína va a administrarse después de la composición de ácido nucleico.
21. Un kit que comprende:
la composición de ácido nucleico de una cualquiera de las reivindicaciones 1-10 y una composición de proteína que comprende moléculas de glicoproteínas de la envuelta del VIH aisladas de cada una de las cepas aisladas primarias en la composición de ácido nucleico.
22. La composición de ácido nucleico de las reivindicaciones 1-10 y una composición de proteína para su uso en inducir una respuesta inmunitaria mediada por células contra el virus de la inmunodeficiencia humana (VIH) o un epítope del VIH en un mamífero vertebrado, en la que la composición de proteína comprende moléculas de glicoproteínas de la envuelta del VIH aisladas de cada una de las cepas aisladas primarias en la composición de ácido nucleico, y la composición de proteína se administra al mamífero vertebrado después de la composición de ácido nucleico.
Patentes similares o relacionadas:
Eliminación de impurezas de cultivos celulares residuales, del 29 de Julio de 2020, de NOVARTIS AG: Un método para eliminar la Proteína Nuclear (NP) de la Gripe de una preparación que comprende proteínas del virus de la gripe de interés que incluyen hemaglutinina […]
 Cepas de Bordetella vivas atenuadas como vacuna de dosis única contra la tos ferina, del 29 de Julio de 2020, de INSTITUT PASTEUR DE LILLE: Una vacuna que comprende una cepa viva, atenuada y mutada de Bordetella pertussis que comprende al menos una mutación del gen (ptx) de la toxina […]
Cepas de Bordetella vivas atenuadas como vacuna de dosis única contra la tos ferina, del 29 de Julio de 2020, de INSTITUT PASTEUR DE LILLE: Una vacuna que comprende una cepa viva, atenuada y mutada de Bordetella pertussis que comprende al menos una mutación del gen (ptx) de la toxina […]
Método para producir inmunoconjugados de anticuerpo-SN-38 con un enlazador CL2A, del 22 de Julio de 2020, de IMMUNOMEDICS, INC.: Un método para producir un compuesto, CL2A-SN-38, que presenta la estructura, **(Ver fórmula)** que comprende realizar un esquema de reacción como el que se muestra: **(Ver […]
Composición de vacuna que contiene un adyuvante sintético, del 22 de Julio de 2020, de INFECTIOUS DISEASE RESEARCH INSTITUTE: Una composición farmacéutica que comprende: un adyuvante lípido de glucopiranosilo (GLA), que tiene la fórmula: **(Ver fórmula)** en la que: […]
Arenavirus trisegmentados como vectores de vacunas, del 22 de Julio de 2020, de UNIVERSITE DE GENEVE: Una partícula de arenavirus trisegmentada infecciosa y competente para la replicación que comprende un segmento L y dos segmentos S, en donde uno de los dos segmentos […]
Inmunoterapia novedosa contra diversos tumores, entre ellos tumores cerebrales y neuronales, del 22 de Julio de 2020, de IMMATICS BIOTECHNOLOGIES GMBH: Péptido que comprende una secuencia de aminoácidos acorde con la SEQ ID N.º 19, en que dicho péptido tiene una longitud total de entre 9 y 16 aminoácidos.
Anticuerpos del OPGL, del 15 de Julio de 2020, de AMGEN FREMONT INC.: Un anticuerpo, que comprende una cadena pesada y una cadena ligera, donde: a) la cadena pesada comprende: 1) una secuencia de aminoácidos recogida […]
Métodos mejorados para la preparación de escualeno, del 15 de Julio de 2020, de NOVARTIS AG: Un procedimiento para la preparación de escualeno a partir de una composición que comprende escualeno a partir de una fuente animal, dicho procedimiento comprendiendo […]