Métodos para la purificación de alfa-1-antitripsina y apolipoproteína A-1.
Un método para purificar la apolipoproteína A-1 (ApoA-I) y la alfa-1-antitripsina (AAT) de una única fracción inicial de plasma humano que contiene ambas proteínas que comprende:
i) tratar una fracción de plasma humano inicial que contiene ApoA-1 y AAT para separar una fracción que contiene ApoA-1 de una que contiene AAT;
II) purificar ApoA-1 hasta un grado de pureza de calidad farmacéutica de la fracción que contiene ApoA-1; y
III) purificar AAT hasta un grado de pureza de calidad farmacéutica de la fracción que contiene AAT, donde opcionalmente dicho método se utiliza para la purificación a gran escala y, donde el método comprende:
a) tratar la fracción de plasma humano inicial que se utiliza como material de partida de modo que ApoA-1 y AAT se solubilicen;
b) precipitar ApoA-1 de la solución a una temperatura de 10 °C o menor, mediante agregado de un alcohol alifático inferior a una concentración de 8 a 14% v/v y ajustar el pH de la solución a un pH de 5 a 6 para que ApoA-1 precipite y AAT permanezca en solución;
c) separar la ApoA-1 precipitada de la solución que contiene AAT; y
d) purificar por separado ApoA-1 y AAT en uno o más pasos de procesamiento para obtener una pureza de calidad farmacéutica.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2008/009745.
Solicitante: CSL BEHRING GMBH.
Nacionalidad solicitante: Alemania.
Dirección: EMIL-VON-BEHRING-STRASSE 76 35041 MARBURG ALEMANIA.
Inventor/es: BRINKMAN,NATHAN, BIGLER,DOUGLAS, BOLLI,REINHARD, FOERTSCH,VRENI.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07K1/14 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 1/00 Procedimientos generales de preparación de péptidos. › Extracción; Separación; Purificación.
- C07K1/16 C07K 1/00 […] › por cromatografía.
- C07K1/30 C07K 1/00 […] › por precipitación.
- C07K1/36 C07K 1/00 […] › por una combinación de varios procesos de diferentes tipos.
- C07K14/775 C07K […] › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › Apolipopéptidos.
- C07K14/81 C07K 14/00 […] › Inhibidores de proteasa.
PDF original: ES-2397280_T3.pdf
Fragmento de la descripción:
Métodos para la purificación de alfa-1-antitripsina y apolipoproteína A-1
Referencia a las aplicaciones relacionadas Esta solicitud reivindica el beneficio de prioridad de la solicitud provisional U.S. Nº 60/935, 527, que fue presentada el 17 de agosto de 2007 y se incorpora en este documento por referencia en su totalidad.
Campo de la invención La invención se refiere a métodos de separación y purificación de proteínas tanto para alfa-1-antitripsina (AAT, también conocida como inhibidor de la proteinasa alfa-1, API y A1-PI) como para la apolipoproteína A-1 (ApoA-I) , por ejemplo, de una fracción del plasma sanguíneo humano. En ciertas realizaciones, la invención proporciona métodos para separar AAT de ApoA-I en la etapa inicial de la purificación, para que el mismo material de partida se pueda utilizar como fuente de ambas proteínas. Los métodos son apropiados además para proporcionar composiciones de AAT y de ApoA-I adecuadas para el uso farmacéutico y son adecuados para la purificación a gran escala.
Antecedentes de la invención Muchos productos biofarmacéuticos basados en proteínas se aislan del plasma humano. El suministro limitado de la materia prima plasma humano, que depende parcialmente de la donación voluntaria de sangre, combinado con la concentración generalmente baja, la alta fragilidad y el rendimiento limitado en la purificación de las proteínas del plasma sanguíneo, torna difícil y costosa la fabricación de esta clase de medicamentos. Por lo tanto, existe la necesidad de mejorar la eficacia de los métodos de purificación de las proteínas del plasma sanguíneo, para que se puedan aislar tantas proteínas médicamente relevantes como sea posible de la misma muestra de plasma humano, con el mayor rendimiento que se pueda lograr.
Los procesos de separación y purificación de las proteínas del plasma humano presentan desafíos debido a la diversidad de proteínas, la naturaleza variable de los posibles contaminantes o impurezas asociados con cada preparación de proteína y la gran cantidad de proteína usualmente necesaria para la producción de productos biofarmacéuticos. Las tecnologías de purificación generalmente involucran una serie de pasos de purificación con el objetivo de aislar una única proteína diana.
La alfa-1-antitripsina (AAT) y la apolipoproteína A-1 (ApoA-I) son ejemplos de proteínas del plasma humano que se pueden fabricar como productos biofarmacéuticos. Se han descrito métodos para purificar esas proteínas mediante procesos de purificación exclusivos. Por ejemplo la publicación PCT Nº WO04060528 describe un proceso de purificación para AAT y la patente de los Estados Unidos Nº 5, 089, 602 describe la purificación de ApoA-I, donde cada proceso parte de fracciones de plasma sanguíneo humano y cada uno lleva a una única proteína producto.
En la actualidad hemos desarrollado métodos que permiten la purificación de AAT y ApoA-I a partir de la misma fracción de plasma humano. Esos métodos son adecuados para la purificación a gran escala, proporcionando así la base para procesos de fabricación susceptibles de aplicación industrial. La invención proporciona métodos para separar AAT de ApoA-I en las primeras etapas de la purificación, para que el mismo material de partida se pueda utilizar como material de partida para purificar ambas proteínas, y métodos para producir AAT y ApoA-I de calidad farmacéutica después de dicha separación.
ApoA-I es una proteína grande de 28 kDa constituyente de la lipoproteína de alta densidad (HDL) y desempeña un papel clave en el transporte inverso del colesterol desde la periferia hacia el hígado para la excreción o el reciclaje.
Durante mucho tiempo se ha descrito que Apo A-I, particularmente en partículas similares a HDL reconstituidas, tiene potencial terapéutico. Sólo recientemente se publicó un estudio que pone de relieve este potencial (JAMA (2007) ; vol. 297, p. 1675-1682) .
Se han desarrollado varias técnicas de purificación de ApoA-I.
Una de las maneras más comunes de purificar ApoA-I en pequeña escala, es utilizar ultracentrifugación para aislar HDL, seguida de una separación de ApoA-I de la partícula de HDL. Hay varias maneras diferentes de purificar ApoA-I de HDL, incluida la extracción por solvente. La ultracentrifugación es un método que insume mucho tiempo y no es conveniente para el aislamiento a gran escala.
También se han descrito métodos que usan plasma como material de partida que no incluyen ultracentrifugación, por ejemplo, purificación cromatográfica (Ross S. E. et al, Rapid chromatographic purification of apolipoproteins A-I and A-II from human plasma, Analytical Biochemistr y 149, p. 166-168 (1985) ) y purificación usando HPLC de filtración en gel (Tricerri A. et al., A rapid and efficient procedure for the purification of human apolipoprotein A-I using gel-filtration HPLC, IJBC, 1, p. 159-166 (1994) ) . También se han publicado otros métodos que utilizan fracciones del fraccionamiento con etanol frío del plasma humano como material de partida (Peitsch et al., A purification method for apolipoprotein A-I and A-II, Analytical Biochemistr y , 178. p. 301-305 (1989) ) .
EP0329605 para Rotkreuzstiftung Zentrallaboratorium Blutspendedienst SRK y Lerch et al., Isolation and properties of apolipoprotein A for therapeutic use, Protides Biol. Fluids, 36, p. 409-416 (1989) , se refieren a la preparación de apolipoproteínas de fracciones de plasma sanguíneo humano que contienen lipoproteínas. Ambas publicaciones informan que se pueden usar precipitados de B y IV de un proceso de fraccionamiento con etanol frío como material para la producción de ApoA-I. Se hace uso de soluciones amortiguadoras que contienen altas concentraciones de etanol, opcionalmente con un solvente orgánico, para precipitar los contaminantes. Los precipitados se solubilizan en clorhidrato de guanidina, que posteriormente es eliminado por filtración en gel o diafiltración. Se incluye un paso de cromatografía de intercambio aniónico para unir los contaminantes, mientras ApoA-I logra pasar. Opcionalmente se propone concentrar ApoA-I por adsorción en una segunda resina de intercambio iónico.
WO9807751 también informa el uso de cromatografía de intercambio iónico para el aislamiento de ApoA-I.
La alfa-1-antitripsina (AAT) , un inhibidor importante de la serina endopeptidasa, está presente en el plasma humano en una concentración de aproximadamente 1.9 a 3.5 g/l. Esta glucoproteína de aproximadamente 53 kDa es producida en el hígado e inhibe la elastasa de los neutrófilos, una enzima implicada en la proteólisis del tejido conectivo especialmente en el pulmón. AAT tiene tres sitios de N-glucosilación en residuos de asparagina 46, 83 y 247, que son glucosilados por mezclas de glucanos complejos bi y triantenarios. Esto resulta en múltiples isoformas de AAT, con puntos isoeléctricos (pI) en el rango de 4.0 a 5.0. La inhibición de la proteasa por AAT es un componente esencial de la regulación de la proteolisis tisular, y la deficiencia de AAT está implicada en la patología de varias enfermedades. Los individuos que heredan una deficiencia de AAT, por ejemplo, tienen un mayor riesgo de padecer enfisema grave de aparición temprana, resultado de la destrucción no regulada de tejido pulmonar la por elastasa leucocitaria humana. La administración de AAT humana exógena ha demostrado inhibir la elastasa y se asocia con mejoría en la supervivencia y reducción en la tasa de disminución de la función pulmonar en pacientes con deficiencia de AAT (Cr y stal et al., Am. J. Respir. Crit. Care Med. 158:49-59 (1998) ; véase R. Mahadeva y D. Lomas, Thorax 53:501-505 (1998) por una revisión.)
Debido a su utilidad terapéutica, la producción comercial de AAT ha sido objeto de considerable investigación. Se ha avanzado mucho en la producción de AAT recombinante en E. coli ( (R. Bischoff et al., Biochemistr y 30:3464-3472 (1991) ) , levadura (K. Kwon et al., J. Biotechnology 42:191-195 (1995) ; Bollen et al., patente de los Estados Unidos 4, 629, 567) , plantas (J. Huang et al., Biotechnol. Prog. 17:126-33 (2001) ) , y mediante secreción en la leche de mamíferos transgénicos (G. Wright et al., Biotechnology, 9:830-834 (1991) ; A.L. Archibald, Proc. Natl. Acad. Sci. USA, 87:5178-5182 (1990) ) . Sin embargo, el aislamiento de AAT del plasma humano es actualmente el método práctico más eficaz para obtener AAT en cantidad, y el plasma humano es la única fuente aprobada por la FDA.
Se han descrito varios procesos para aislar y purificar AAT de fracciones del plasma humano, que implican combinaciones de pasos de precipitación, adsorción, extracción y cromatográficos. La mayoría de los procesos publicados para el aislamiento de... [Seguir leyendo]
Reivindicaciones:
1. Un método para purificar la apolipoproteína A-1 (ApoA-I) y la alfa-1-antitripsina (AAT) de una única fracción inicial de plasma humano que contiene ambas proteínas que comprende:
i) tratar una fracción de plasma humano inicial que contiene ApoA-1 y AAT para separar una fracción que contiene ApoA-1 de una que contiene AAT; II) purificar ApoA-1 hasta un grado de pureza de calidad farmacéutica de la fracción que contiene ApoA-1; y III) purificar AAT hasta un grado de pureza de calidad farmacéutica de la fracción que contiene AAT,
donde opcionalmente dicho método se utiliza para la purificación a gran escala y, donde el método comprende:
a) tratar la fracción de plasma humano inicial que se utiliza como material de partida de modo que ApoA-1 y AAT se solubilicen; b) precipitar ApoA-1 de la solución a una temperatura de 10 °C o menor, mediante agregado de un alcohol alifático inferior a una concentración de 8 a 14% v/v y ajustar el pH de la solución a un pH de 5 a 6 para que ApoA-1 precipite y AAT permanezca en solución; c) separar la ApoA-1 precipitada de la solución que contiene AAT; y d) purificar por separado ApoA-1 y AAT en uno o más pasos de procesamiento para obtener una pureza de calidad farmacéutica.
2. El método de acuerdo con la reivindicación 1, donde la fracción de plasma humano inicial se selecciona entre una o más fracciones IV de Cohn, precipitados de los sobrenadantes A y A+1 de Kistler-Nitschmann, y precipitados con sulfato de amonio.
3. El método de acuerdo con la reivindicación 2, donde una o más de las fracciones IV de Cohn es la fracción IV1 de Cohn.
4. El método de acuerdo con cualquiera de las reivindicaciones precedentes, donde AAT y ApoA-1 no están expuestas a) a un pH de 13.69 o superior o b) a un pH de 13 o superior, o c) a un pH de 12 o superior, o d) a un pH de 11 o superior.
5. El método de acuerdo con la reivindicación 1, donde la fracción de plasma humano inicial se solubilizan en el paso a) en una solución amortiguadora que comprende Tris aproximadamente 50 a 150 mM y NaCl aproximadamente 0 a 20 mM a un pH de aproximadamente 8.0 a 10.0.
6. El método de acuerdo con cualquiera de las reivindicaciones precedentes, donde el alcohol alifático inferior es etanol.
7. Un método de acuerdo con cualquiera de las reivindicaciones precedentes que comprende además un paso de reducción viral.
8. El método de acuerdo con la reivindicación 7, donde el paso de reducción viral comprende una pasteurización a aproximadamente 60 °C.
9. El método de acuerdo con la reivindicación 8, donde el paso de pasteurización se lleva a cabo en una solución que contiene al menos 40% p/p de sacarosa y al menos 4% p/p de acetato de potasio.
10. El método de acuerdo con la reivindicación 9, donde el paso de reducción viral comprende la filtración a través de un filtro que pueda eliminar las partículas virales.
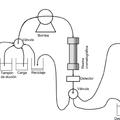
Figura 1:
Diagrama de flujo que ilustra una realización de la separación de ApoA-I y AAT como se describe en detalle en el ejemplo 2.
Patentes similares o relacionadas:
 Purificación de proteínas, del 29 de Julio de 2020, de UCB Biopharma SRL: Un proceso para la purificación de una proteína de interés a partir de una mezcla que comprende las etapas de
a) en un ciclo de cromatografía operativo, […]
Purificación de proteínas, del 29 de Julio de 2020, de UCB Biopharma SRL: Un proceso para la purificación de una proteína de interés a partir de una mezcla que comprende las etapas de
a) en un ciclo de cromatografía operativo, […]
Composición a base de hidroxiapatita en polvo para el tratamiento del linfoma B o T, del 1 de Julio de 2020, de URODELIA: Composición para uso como autovacuna antitumoral para el tratamiento de linfomas B o T en un sujeto, que comprende un polvo de hidroxiapatita y/o de […]
Eliminación de agregados de proteína de preparaciones biofarmacéuticas en un modo de flujo continuo, del 27 de Mayo de 2020, de MERCK PATENT GMBH: Un método de cromatografía de flujo continuo para separar una proteína monomérica de interés de agregados de proteína en una muestra, comprendiendo […]
Un procedimiento de cromatografía de reparto débil, del 6 de Mayo de 2020, de WYETH LLC: Un procedimiento de recuperación de un producto purificado de un fluido de carga que incluye una o más impurezas, que comprende las etapas de: hacer pasar el fluido […]
Nuevo método de purificación eficiente de albumina sérica humana, del 12 de Febrero de 2020, de Shilpa Medicare Limited: Un método para la purificación de la albúmina humana recombinante, comprendiendo el método las etapas de: a. separar la pluralidad de células […]
Purificación de inmunoglobulina con el uso de etapas de limpieza previa, del 12 de Febrero de 2020, de RICHTER GEDEON NYRT: El procedimiento de purificación de una inmunoglobulina de una muestra que comprende la inmunoglobulina y al menos una impureza, el procedimiento […]
Método para purificar antitrombina, del 25 de Diciembre de 2019, de Kyowa Kirin Co., Ltd: Método para purificar antitrombina, que comprende las etapas de: (a) adsorber la antitrombina sobre el portador de intercambio aniónico, (b) lavar […]
Método de purificación de proteína, del 25 de Diciembre de 2019, de Kyowa Kirin Co., Ltd: Método para purificar una proteína, en el que la proteína se separa de las impurezas utilizando un carbón activado para obtener la proteína con un bajo contenido de impurezas, […]