Métodos de purificación de condroitinasa y formulaciones estables de la misma.
Una formulación que comprende una condroitinasa en un tampón de fosfato de sodio a una concentración de aproximadamente 750 a 1000 mM.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2005/017464.
Solicitante: ACORDA THERAPEUTICS, INC.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 420 Saw Mill River Road Ardsley, NY 10502 ESTADOS UNIDOS DE AMERICA.
Inventor/es: GRUSKIN, ELLIOTT, A., CAGGIANO,Anthony,O, SHEPTOVITSKY,YELENA G, KASPERBAUER,SARAH.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K38/00 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00).
- A61K38/47 A61K […] › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › que actúan sobre compuestos glicosílicos (3.2), p. ej. celulosas, lactasas.
- C12N9/88 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 9/00 Enzimas, p. ej. ligasas (6.); Proenzimas; Composiciones que las contienen (preparaciones para la limpieza de los dientes que contienen enzimas A61K 8/66, A61Q 11/00; preparaciones de uso médico que contienen enzimas A61K 38/43; composiciones detergentes que contienen enzimas C11D ); Procesos para preparar, activar, inhibir, separar o purificar enzimas. › Liasas (4.).
PDF original: ES-2411504_T3.pdf
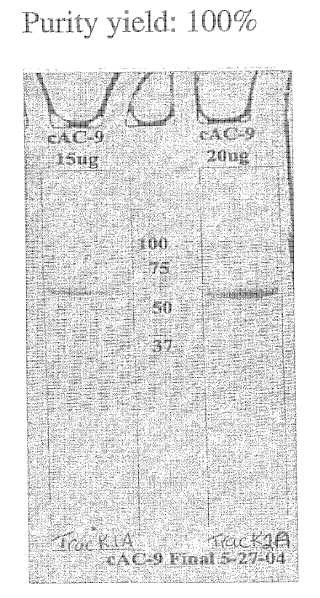
Fragmento de la descripción:
Metodos de purificacion de condroitinasa y formulaciones estables de la misma.
Campo de la invención Un aspecto de la presente invencion se refiere a una formulacion estable de condroitinasa. Tambien se describen metodos de purificacion de condroitinasa.
Antecedentes Los proteoglicanos, los principales componentes de la matriz extracelular, son conocidos por estar presentes en grandes cantidades en el tejido de la cicatriz glial y por inhibir la recuperacion despues de lesiones de la medula espinal (Fawcett y Asher, (1999) Brain Res. Bull. 49 (6) : 377-391) . Las enzimas que son capaces de digerir tejido de la cicatriz glial son un objetivo importante para el desarrollo de agentes terapeuticos para la lesion de la medula espinal (SCI) . La condroitinasa ABCI (EC 4.2.2.4; cABCI) es una enzima bacteriana que cataliza la digestion de las cadenas laterales de condroitina sulfatada y dermatan de los proteoglicanos. Se ha demostrado que esta enzima promueve la recuperacion funcional despues de lesion de la medula espinal (Bradbur y et al., (2002) Nature 416:636640; Caggiano et al., (2005) J. Neurotrauma 22 (2) : 226-239) .
La medula espinal se compone de fibras nerviosas. El dano al sistema nervioso central, incluyendo la medula espinal, da como resultado una perdida de funcion. Dependiendo del tipo de lesion en el sistema nervioso central, la perdida de funcion se puede manifestar en la perdida de funciones sensoriales, motoras o autonomas o una combinacion de las mismas. Las funciones sensoriales incluyen la capacidad de sentir sensaciones como el dolor. Las funciones motoras incluyen la capacidad de mover voluntariamente el cuerpo. Las funciones autonomas incluyen funciones involuntarias del cuerpo, por ejemplo la capacidad de sudar y respirar.
Los tipos mas comunes de lesiones de la medula espinal (SCI) incluyen contusiones (hematomas de la medula espinal) y las lesiones por compresion (causadas por una presion prolongada sobre la medula espinal) . En lesiones por contusion, a menudo se forma una cavidad o un hueco en el centro de la medula espinal. A diferencia de las celulas nerviosas, o neuronas del sistema nervioso periferico (SNP) , las neuronas del sistema nervioso central (SNC) no se regeneran despues de la lesion.
La lesion de la medula espinal puede estar caracterizada por contusion del tejido neural que da como resultado una disminucion o perdida de la capacidad del tejido nervioso para transmitir adecuadamente los impulsos nerviosos. La causa habitual es debida a una lesion por impacto de alguna naturaleza, pero tambien puede ocurrir durante la manipulacion de la medula espinal en ciertos procedimientos quirurgicos. Despues de una lesion de la medula espinal en el mamifero adulto, la incapacidad de los axones para regenerarse puede conducir a la perdida de sensacion, perdida de funcion motora y/o perdida de la funcion autonoma, asi como paralisis permanente. Una de las razones de que las neuronas no logren regenerarse es su incapacidad para atravesar la cicatriz glial que se desarrolla tras una lesion de la medula espinal. La lesion inducida por herida desarrollara cicatriz glial, que contiene moleculas de la matriz extracelular incluyendo proteoglicanos de sulfato de condroitina (CSPG) . Los CSPG inhiben el crecimiento de tejido nervioso in vitro y la regeneracion del tejido nervioso en regiones ricas en CSPG in vivo.
Diversas moleculas, y regiones especificas de las mismas, han sido implicadas en la capacidad para apoyar el brote de las neuritas a partir de una celula neuronal, un proceso tambien conocido como sobrecrecimiento de neuritas. El termino neuritas hace referencia tanto a las estructuras de los axones como de las dendritas. El proceso de brote de las neuritas es esencial en el desarrollo y la regeneracion neuronales, especialmente despues de que una lesion fisica o enfermedad hayan danado las celulas neurales. Las neuritas se prolongan profusamente durante el desarrollo en los sistemas nerviosos tanto centrales como perifericos de todas las especies animales. Este fenomeno se refiere tanto a los axones como a las dendritas.
Se sabe que varios polipeptidos, especialmente las moleculas de adhesion celular (CAM) , promueven el crecimiento de las celulas neurales. Si bien los primeros esfuerzos en esta area de investigacion se concentraron en la proteina fibronectina (FN) de la matriz extracelular que promueve la adhesion, tambien se ha encontrado que otros polipeptidos promueven el crecimiento neural. Por ejemplo, en la Patente de los Estados Unidos Num. 5.792.743 se describen nuevos polipeptidos y metodos para promover el crecimiento neural en el sistema nervioso central de un mamifero mediante la administracion de una CAM neural soluble, un fragmento de la misma, o un producto de fusion con Fc de la misma. En la Patente de los Estados Unidos Num. 6.313.265 se describen polipeptidos sinteticos que contienen las regiones farmacologicamente activas de las CAM que se pueden utilizar en la promocion de la regeneracion nerviosa y la reparacion tanto de las lesiones de los nervios perifericos como de las lesiones en el SNC. Aunque util, el uso de proteinas regenerativas por si solo puede no ser suficiente para efectuar la reparacion de un sistema nervioso danado.
Durante aproximadamente las ultimas dos decadas, se ha expandido rapidamente el conocimiento de la adhesion celular y la migracion en matrices extracelulares (ECM) a nivel molecular. La accion de las enzimas y otros polipeptidos que degradan componentes de la matriz extracelular y las membranas basales puede facilitar los eventos de reparacion neural mediante una variedad de mecanismos, incluyendo la liberacion de citoquinas unidas y mediante el aumento de la permeabilidad de la matriz, mejorando de este modo la movilidad de las moleculas mediadoras, factores de crecimiento y agentes quimiotacticos, asi como de las celulas que participan en el proceso de cicatrizacion. Por ejemplo, la Patente de los Estados Unidos Num. 5.997.863 describe el uso de glicosaminoglicanos para manipular la proliferacion celular y promover la cicatrizacion de heridas.
Los componentes de los CSPG inhibidores se han identificado como glicosaminoglicanos, sulfato de condroitina (CS) y sulfato de dermatan (DS) . La eliminacion de estas moleculas inhibidoras permitiria que las neuritas se regeneraran y reinervaran un area despues de una lesion fisica o una enfermedad, asi como permitiria la recuperacion de las funciones sensoriales, motoras y autonomas.
Estudios previos han encontrado que las condroitinasas pueden lisar y degradar los CSPG, incluyendo CS y DS. Un estudio encontro que la condroitinasa ABC eliminaba las cadenas de glicosaminoglicanos (GAG) en y alrededor de las zonas lesionadas del SNC de rata in vivo. La degradacion de las los GAG promovio la expresion de una proteina asociada al crecimiento, GAP-43, lo que indica un aumento en la capacidad de las celulas tratadas para regenerarse. Sin embargo, esta proteina asociada al crecimiento esta asociada con la regeneracion en las lesiones nerviosas perifericas, pero no centrales.
Los sulfatos de condroitina (CS) son polisacaridos sulfatados en las cadenas lineales de disacaridos repetidas. Tienen un peso molecular que oscila de alrededor de 10.000 a mas de 100.000 Da. Existen sustratos de sulfato de condroitina en diferentes isomeros designados por las letras adjuntas A, B yC (Hoffman et al., (1958) Federation Proc. 17:1078-1082) . Las unidades que se repiten estan compuestas de acido uronico (GlcA o IdoA) y galactosamina, y se denominan galactosaminoglicanos, y son un ejemplo de los glicosaminoglicanos, abreviados tipicamente como GAG. A pesar de que estas especies de cadenas de GAG tienen diferentes regiones repetidas de disacaridos, estan unidas covalentemente a traves de la denominada secuencia de tetrasacarido e la region de conexion (vease mas abajo) al residuo de serina en la secuencia consenso de anclaje a GAG (Glu/Asp-X-Ser-Gly) de las respectivas proteinas centrales. Los sulfatos de condroitina A y C (ChS-A, ChS-C) son los GAG mas abundantes y se encuentran en el cartilago, el hueso y las valvulas cardiacas. La condroitina B (ChS-B, o, alternativamente, sulfato de dermatan) se expresa principalmente en la piel, los vasos sanguineos, las valvulas cardiacas.
Cuando se caracterizaron preparaciones bacterianas de condroitinasa frente a diferentes sustratos de sulfato de condroitina (ChS) , se descubrio una serie de condroitinasas distintas: condroitinasa AC que degrada la mayor parte de la condroitina A (ChA) y la condroitina C (ChC) (Yamagata et al., (1968) J. Biol. Chem. 243 (7) : 1523-1535) , condroitinasa B que degrada la condroitina (ChB) (Michelacci y Deitrich, (1976) J. Biol. Chem. 251 (4) : 1154-1158) , condroitinasa C que actua principalmente sobre ChC (Michelacci y Dietrich, (1976) supra)... [Seguir leyendo]
Reivindicaciones:
1. Una formulacion que comprende una condroitinasa en un tampon de fosfato de sodio a una concentracion de aproximadamente 750 a 1000 mM.
2. La formulacion de la reivindicacion 1, en donde la concentracion de tampon de fosfato de sodio es de 750 a 1000 mM.
3. La formulacion de una cualquiera de las reivindicaciones 1 y 2, en donde la condroitinasa esta purificada.
4. La formulacion de una cualquiera de las reivindicaciones 1 y 2, en donde la condroitinasa conserva al menos de 45 a 55% de la actividad aproximadamente a las 24 horas.
5. La formulacion de una cualquiera de las reivindicaciones 1 y 2, en donde la condroitinasa se selecciona del grupo que consiste en condroitinasa ABC I, condroitinasa ABC II, condroitinasa AC, condroitinasa B, Hyal1, Hyal2, Hyal3, Hyal4, y PH20.
6. La formulacion de una cualquiera de las reivindicaciones 1 y 2, en donde la condroitinasa es condroitinasa ABCI.
7. La formulacion de una cualquiera de las reivindicaciones 1 y 2, en donde la condroitinasa es condroitinasa AC.
8. La formulacion de una cualquiera de las reivindicaciones 1 y 2, que comprende adicionalmente acetato de sodio.
9. La formulacion de una cualquiera de las reivindicaciones 1 y 2, en donde dicha formulacion esta a un pH de 7, 4.
10. La formulacion de la reivindicacion 6, en donde la condroitinasa ABC I tiene una secuencia de aminoacidos del SEQ ID NO: 2.
11. La formulacion de una cualquiera de las reivindicaciones 1 y 2, en donde la concentracion de tampon de fosfato de sodio es de aproximadamente 750 mM.
12. La formulacion de una cualquiera de las reivindicaciones 1 y 2, en donde la concentracion de tampon de fosfato de sodio es de aproximadamente 1.000 mM.
Patentes similares o relacionadas:
Composiciones para la supresión de la formación de inhibidores contra el factor VIII en pacientes con hemofilia A., del 22 de Julio de 2020, de THE TRUSTEES OF THE UNIVERSITY OF PENNSYLVANIA: Una composición que comprende material vegetal liofilizado que comprende al menos un fragmento de FVIII conjugado con la subunidad B de la toxina […]
Composiciones farmacéuticas para uso tópico basadas en ácido hialurónico sulfatado como promotor de absorción de la piel, del 1 de Julio de 2020, de FIDIA FARMACEUTICI S.P.A.: Una composición farmacéutica para uso tópico que contiene ácido hialurónico sulfatado como promotor de absorción de la piel de diclofenaco, ketoprofeno, ibuprofeno […]
Compuestos para el tratamiento de Trastornos Neuropsiquiátricos, del 24 de Junio de 2020, de Curemark LLC: Una composición que comprende enzimas digestivas para uso en el tratamiento del Trastorno Esquizofreniforme, en donde las enzimas digestivas comprenden amilasa, lipasa […]
Tratamiento de glucogenosis de tipo II, del 20 de Mayo de 2020, de DUKE UNIVERSITY: α-Glucosidasa ácida (GAA) humana recombinante producida en un cultivo de células de ovario de hámster chino para uso en un método de tratamiento de glucogenosis […]
Reticuladores químicos, del 22 de Abril de 2020, de AMICUS THERAPEUTICS, INC: Un método de realización de un péptido de direccionamiento lisosomal modificado que comprende: a. poner en contacto el factor de crecimiento similar […]
Regímenes de dosificación para el tratamiento de la enfermedad de Fabry, del 22 de Abril de 2020, de AMICUS THERAPEUTICS, INC: 1-desoxigalactonojirimicina para su uso en el tratamiento de enfermedad de Fabry, en donde el tratamiento comprende administrar a un paciente desde aproximadamente 50 mg hasta […]
Proteína, del 18 de Diciembre de 2019, de Dupont Nutrition Biosciences ApS: Un polipéptido aislado que presenta actividad de xilanasa, seleccionado del grupo que consiste en: (a) un polipéptido que comprende una secuencia de aminoácido que tiene […]
Composiciones de alfa-galactosidasa, del 18 de Diciembre de 2019, de PROTALIX LTD. (100.0%): Una proteína α-galactosidasa humana que comprende una glicina como el resto N-terminal en donde dicha proteína α-galactosidasa humana se fusiona traduccionalmente […]