Formulaciones de bazedoxifeno con antioxidantes.
Un procedimiento para potenciar la estabilidad de disolución del bazedoxifeno en una composición farmacéuticaque comprende bazedoxifeno o una de sus sales farmacéuticamente aceptables,
el procedimiento que comprende laformulación de la composición farmacéutica para que contenga al menos una de vitamina E y vitamina E TPGS, enla que la composición farmacéutica está sustancialmente libre de ácido ascórbico.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2010/054022.
Solicitante: WYETH LLC.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: Patent Law Department Five Giralda Farms Madison, NJ 07940 ESTADOS UNIDOS DE AMERICA.
Inventor/es: NAGI, ARWINDER S., AGRAWAL,ANJALI, CHATLAPALLI,RAMARAO S, VAN PELT,LAWRENCE, CHIRRA,SRINIVAS.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/55 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › que tienen ciclos con siete eslabones, p. ej. azelastina, pentilentetrazol.
PDF original: ES-2436841_T3.pdf
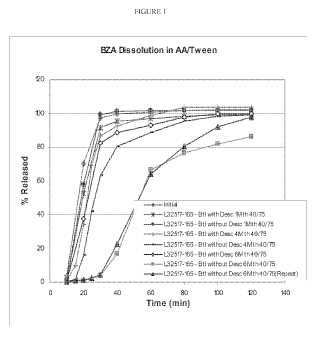
Fragmento de la descripción:
Formulaciones de bazedoxifeno con antioxidantes
Campo técnico
La divulgación se refiere de forma general al campo de las composiciones farmacéuticas. Más específicamente, la divulgación se refiere a composiciones farmacéuticas que contienen bazedoxifeno y un antioxidante, así como a procedimientos para potenciar la estabilidad de disolución y/o biodisponibilidad del bazedoxifeno en dichas composiciones. En ciertas realizaciones, las composiciones incluyen un núcleo que comprende estrógenos conjugados, y al menos un revestimiento que comprende bazedoxifeno, o una de sus sales farmacéuticamente aceptables, y al menos uno de vitamina E, vitamina E TPGS, propil galato, ácido cítrico, y BHA/BHT, sustancialmente libres de ácido ascórbico.
Antecedentes La menopausia se define de forma general como el último período menstrual natural y se caracteriza por el cese de la función ovárica, que da lugar a una disminución sustancial de los estrógenos circulantes en el torrente sanguíneo. La menopausia por lo general se identifica, retrospectivamente, después de 12 meses de amenorrea. Habitualmente no es un acontecimiento repentino, sino que con frecuencia va precedido de un periodo de ciclos menstruales irregulares antes del eventual cese del menstruo. Después del cese de la menstruación, normalmente la reducción en las concentraciones endógenas de estrógeno es rápida. Hay un descenso de los estrógenos séricos en niveles circulantes que oscilan entre 40-250 pg/ml de estradiol y de 40 y 170 pg/ml de estrona durante los ciclos de ovulación a menos de 15 pg/ml de estradiol y 30 pg/ml de estrona en mujeres posmenopáusicas.
Puesto que estos estrógenos se reducen durante el período previo (perimenopausia) y después de la menopausia (postmenopausia) , pueden acaecer diversos cambios fisiológicos, incluyendo atrofia vulvar y vaginal que provoca sequedad vaginal, prurito y dispareunia, e inestabilidad vasomotora manifestada en forma de sofocos. Otras alteraciones menopáusicas pueden incluir depresión, insomnio, y nerviosismo. Los efectos psicológicos a largo plazo de la privación posmenopáusica de estrógeno pueden acarrear una importante morbilidad y mortalidad debido al incremento de los factores de riesgo para enfermedades cardiovasculares y osteoporosis. Los cambios menopáusicos en los niveles sanguíneos de los lípidos, un componente importante de la patogénesis de la enfermedad cardiaca coronaria (ECC) , pueden ser los precursores de una mayor incidencia de la enfermedad cardiaca isquémica, ateroesclerosis, y otras enfermedades cardiovasculares. Después de la menopausia se puede observar inmediatamente una reducción rápida en la masa ósea tanto de hueso cortical (columna) como trabecular (cadera) , con una pérdida total de masa ósea del 1% al 5% al año, que continúa durante 10 a 15 años.
La terapia de sustitución de estrógenos (TSE) es beneficiosa para el alivio sintomático de los sofocos y la atrofia genital y para la prevención de la osteoporosis posmenopáusica. La TSE ha sido reconocida como un tratamiento ventajoso para el alivio de los síntomas vasomotores. La TSE a largo plazo puede prevenir la osteoporosis, debido a que reduce la pérdida ósea, reduce las fracturas de columna y cadera, y previene la pérdida de peso. Además, la TSE es eficaz a la hora de incrementar la lipoproteína de alta densidad-colesterol (HDL-C) y de reducir la lipoproteína de baja densidad-colesterol (LDL-C) , haciendo posible la protección frente a la ECC. La TSE también puede proporcionar protección antioxidante frente a trastornos o estados patológicos mediados por radicales libres. También se ha reportado que los estrógenos confieren neuroprotección, e inhiben los trastornos neurodegenerativos, tales como la enfermedad de Alzheimer (véase patente de Estados Unidos Nº 5.554.601, que se incorpora en su totalidad en el presente documento por referencia) .
El protocolo normal para la TSE requiere la suplementación con estrógenos utilizando formulaciones que contienen estrona, estriol, etinilestradiol o estrógenos conjugados aislados de fuentes naturales (por ejemplo, estrógenos conjugados Premarin® de Wyeth) . En algunos pacientes, la terapia puede estar contraindicada debido a los efectos proliferativos de los estrógenos sin oposición sobre el tejido uterino. Esta proliferación lleva asociada un mayor riesgo de endometriosis y/o cáncer de endometrio. Los efectos de los estrógenos sin oposición sobre el tejido mamario son menos claros, pero producen cierta preocupación. Por consiguiente, una tendencia se ha dirigido hacia el desarrollo de un régimen de tratamiento de dosis bajas que minimiza los efectos adversos de la TSE.
Otro enfoque ha sido la administración de progestina, secuencialmente o en combinación, con estrógeno. Existen gran cantidad de datos clínicos que muestran que el riesgo relativo de cáncer de endometrio se puede reducir con la adición de progestina a la TSE. La adición de progestina a la terapia de estrógenos puede ayudar a prevenir la proliferación endometrial inducida por estrógenos. Con las dosis diarias apropiadas de estrógeno y progestina, se ha demostrado que la terapia de sustitución de estrógenos combinada es eficaz para el alivio de la atrofia vaginal y los síntomas vasomotores, la prevención de la osteoporosis posmenopáusica, y la reducción del riesgo de cáncer endometrial mediante la prevención de hiperplasia endometrial.
Un tercer enfoque para minimizar los efectos adversos de la TSE es la utilización de moduladores selectivos del receptor de estrógenos (MSRE) junto con la TSE. Los MSRE son una clase de compuestos que demuestran una afinidad por los receptores de estrógeno (RE) pero presentan efectos estrogénicos selectivos de tejido. Un ejemplo de un MSRE es el bazedoxifeno (1-[4- (2-azepan-1-il-etoxi) -bencil]-2- (4-hidroxi-fenil) -3-metil-1H-indol-5-ol; BZ) , o una
de sus sales farmacéuticamente aceptables, tales como el acetato de bazedoxifeno (BZA) , que tiene la fórmula química se muestra a continuación:
Se ha informado de que el bazedoxifeno previene la pérdida ósea y protege el sistema cardiovascular y reduce o elimina los efectos negativos sobre el útero y la mama (incluyendo riesgos potenciales de cánceres de útero y mamá) . Consistente con su clasificación como MSRE, el bazedoxifeno demuestra poca o ninguna estimulación de la respuesta uterina en modelos preclínicos de estimulación uterina. Por el contrario, el bazedoxifeno demuestra un efecto similar a los agonistas de estrógenos en la prevención de la pérdida ósea y en la reducción del colesterol en un modelo de osteopenia en ratas ovariectomizadas. En una línea celular MCF-7 (línea celular humana de cáncer de mama) , el bazedoxifeno se comporta como un antagonista de estrógenos. Estos datos demuestran que el bazedoxifeno es estrogénico sobre el hueso y los parámetros lipídicos cardiovasculares y antiestrogénico sobre el tejido uterino y mamario y así tiene potencial para tratar una serie de diferentes enfermedades o estados de tipo patológico en los que está involucrado el receptor de estrógenos.
Las patentes de Estados Unidos Nº 5.998.402 y 6.479.535 informan de la preparación de bazedoxifeno, cada una de las cuales se incorpora en su totalidad en el presente documento por referencia. La preparación sintética de bazedoxifeno también ha aparecido en la literatura general. Véase, por ejemplo, Miller, y col., Drugs of the Future, 2002, 27 (2) , 117-121, que se incorpora en su totalidad en el presente documento por referencia) . Además, se describen composiciones farmacéuticas que contienen bazedoxifeno, por ejemplo, en el documento WO 02/03987, que se incorpora en su totalidad en el presente documento por referencia. Además, la co-administración de bazedoxifeno con estrógenos se desvela, por ejemplo, en la patente de Estados Unidos Nº 6.479.535 y las publicaciones de Estados Unidos Nº 2007/0003623, 2008/0175905 y 2008/0175908, cada una de las cuales se incorpora en su totalidad en el presente documento por referencia.
La Forma A polimórfica del bazedoxifeno se desvela en la publicación de Estados Unidos Nº 2005/0227965 mientras que la Forma B polimórfica del bazedoxifeno se desvela en la publicación de Estados Unidos Nº 2005/0250762, cada una de las cuales se incorpora en su totalidad en ese documento por referencia. Los procedimientos de preparación de la Forma A polimórfica del bazedoxifeno también se desvelan en las solicitudes de patente de Estados Unidos asignada en común y pendiente de tramitación Nº de Serie 12/369.104 y 12/369.315 presentada el 11 de febrero 2009, cada una de las cuales se incorpora en su totalidad en el presente documento por referencia. La Forma A tiene una mayor solubilidad en sistemas... [Seguir leyendo]
Reivindicaciones:
1. Un procedimiento para potenciar la estabilidad de disolución del bazedoxifeno en una composición farmacéutica que comprende bazedoxifeno o una de sus sales farmacéuticamente aceptables, el procedimiento que comprende la formulación de la composición farmacéutica para que contenga al menos una de vitamina E y vitamina E TPGS, en la que la composición farmacéutica está sustancialmente libre de ácido ascórbico.
2. Una composición farmacéutica que comprende bazedoxifeno o una de sus sales farmacéuticamente aceptables, un agente de carga, un aglutinante, un agente humectante, y al menos una de vitamina E y vitamina E TPGS, en la que la composición farmacéutica está sustancialmente libre de ácido ascórbico, en el que la estabilidad de disolución del bazedoxifeno en la composición farmacéutica se potencia en comparación con la estabilidad de disolución del bazedoxifeno en una composición farmacéutica que comprende bazedoxifeno y ácido ascórbico.
3. La composición farmacéutica de la reivindicación 2, en la que la composición farmacéutica comprende del 10% aproximadamente al 40% en peso aproximadamente en forma de bazedoxifeno.
4. La composición farmacéutica de la reivindicación 2, en la que
el agente de carga comprende al menos uno de lactosa, monohidrato de lactosa, manitol, sacarosa, maltodextrina, dextrina, maltitol, sorbitol, xilitol, celulosa pulverizada, goma de celulosa, celulosa microcristalina, carboximetil celulosa, carboxietil celulosa, hidroxietil celulosa, fécula, glicolatos de almidón sódico, aluminosilicatos metálicos, fosfato de calcio, y un carbonato metálico; el aglutinante comprende al menos uno de hidroxipropil metilcelulosa, carboximetil celulosa, carboxietil celulosa, hidroxipropil celulosa, hidroxietil celulosa, celulosas microcristalinas, almidones, polivinil pirrolidina, óxido de polietileno, polivinil pirrolidona, copovidona, goma de xantano, y goma de guar; y el agente humectante comprende al menos uno de éster de sacarosa del ácido palmítico; copolímero de polietilenglicol-polipropilenglicol, alquil sulfato metálico, lauril sulfato sódico, éster de polioxietilensorbitán ácido graso, polioxietilen alquil éter, polietilenglicol, derivados de polioxietileno del aceite de ricino, docusato sódico, compuestos amina de amonio cuaternario, ésteres de azúcares de ácidos grasos, ésteres polietoxilados de ácidos grasos, glicéridos de ácidos grasos, y glicéridos poliglicolizados.
5. La composición farmacéutica de la reivindicación 4, en la que el agente de carga es sacarosa.
6. La composición farmacéutica de la reivindicación 4, en la que el aglutinante es hidroxipropil metilcelulosa.
7. La composición farmacéutica de la reivindicación 4, en la que el agente humectante es éster de sacarosa del ácido palmítico.
8. La composición farmacéutica de la reivindicación 4, en la que el agente de carga es sacarosa, el aglutinante es hidroxipropil metilcelulosa, y el agente humectante es éster de sacarosa del ácido palmítico.
9. Una composición farmacéutica, que comprende:
un núcleo que comprende estrógenos conjugados; y al menos un revestimiento que comprende bazedoxifeno o una de sus sales farmacéuticamente aceptables, un agente de carga, un aglutinante, un agente humectante, y al menos una de vitamina E y vitamina E TPGS, en la que el al menos un revestimiento está sustancialmente libre de ácido ascórbico, y en la que la estabilidad de disolución del bazedoxifeno en la composición farmacéutica se potencia en comparación con la estabilidad de disolución del bazedoxifeno en una composición farmacéutica que comprende bazedoxifeno y ácido ascórbico.
10. La composición farmacéutica de la reivindicación 9, en la que la composición farmacéutica comprende entre el 3% aproximadamente y el 10% en peso aproximadamente de la composición total en forma de acetato de bazedoxifeno, entre el aproximadamente 5% y el 30% en peso aproximadamente de la composición total en forma de agente de carga, entre el 3% aproximadamente y el 10% en peso aproximadamente de la composición total en forma de aglutinante, entre el 0, 01% aproximadamente y el 2% en peso aproximadamente de la composición total en forma de agente humectante, y entre el 0, 01% aproximadamente y el 2% en peso aproximadamente de la composición total en forma de al menos una de vitamina E y vitamina E TPGS.
11. La composición farmacéutica de la reivindicación 10, en la que la composición farmacéutica comprende el 0, 1% en peso aproximadamente o superior de la al menos una de vitamina E y vitamina E TPGS.
12. La composición farmacéutica de la reivindicación 9, en la que:
el agente de carga comprende al menos uno de lactosa, monohidrato de lactosa, manitol, sacarosa, maltodextrina, dextrina, maltitol, sorbitol, xilitol, celulosa pulverizada, goma de celulosa, celulosa microcristalina, carboximetil celulosa, carboxietil celulosa, hidroxietil celulosa, almidón, glicolatos de almidón sódico, aluminosilicatos metálicos, fosfato de calcio, y un carbonato metálico; el aglutinante comprende al menos uno de hidroxipropil metilcelulosa, carboximetil celulosa, carboxietil celulosa,
hidroxipropil celulosa, hidroxietil celulosa, celulosas microcristalinas, almidones, polivinil pirrolidina, óxido de polietileno, polivinil pirrolidona, copovidona, goma de xantano, y goma de guar; y el agente humectante comprende al menos uno de éster de sacarosa del ácido palmítico; copolímero de polietilenglicol-polipropilenglicol, alquil sulfato metálico, lauril sulfato sódico, éster de polioxietilensorbitán ácido graso, polioxietilen alquil éter, polietilenglicol, derivados de polioxietileno del aceite de ricino, docusato sódico, compuestos amina de amonio cuaternario, ésteres de azúcares de ácidos grasos, ésteres polietoxilados de ácidos grasos, glicéridos de ácidos grasos, y glicéridos poliglicolizados.
13. La composición farmacéutica de la reivindicación 12, en la que el agente de carga es sacarosa.
14. La composición farmacéutica de la reivindicación 12, en la que el agente de carga es sacarosa, el aglutinante es 10 hidroxipropil metilcelulosa, y el agente humectante es éster de sacarosa del ácido palmítico.
15. Una composición farmacéutica que comprende:
un núcleo de comprimido que comprende al menos un estrógeno conjugado, dicho núcleo de comprimido formando entre el 45% aproximadamente y el 80% en peso aproximadamente de la composición total; y una capa exterior sustancialmente libre de ácido ascórbico, que comprende:
acetato de bazedoxifeno entre el 4% aproximadamente y el 8% en peso aproximadamente de la composición total; sacarosa entre el 10% aproximadamente y el 20% en peso aproximadamente de la composición total; hidroxipropil metilcelulosa entre el 4% aproximadamente y el 8% en peso aproximadamente de la composición total;
éster de sacarosa del ácido palmítico entre el 0, 2% aproximadamente y el 0, 6% en peso aproximadamente de la composición total; y al menos una de vitamina E y vitamina E TPGS entre el 0, 1% aproximadamente y el 2% en peso aproximadamente de la composición total, a condición de que el % total de la composición sea del 100% en peso,
en la que la estabilidad de disolución del acetato de bazedoxifeno en la composición farmacéutica se potencia en comparación con la estabilidad de disolución del acetato de bazedoxifeno en una composición farmacéutica que comprende acetato de bazedoxifeno y ácido ascórbico.
Patentes similares o relacionadas:
Tratamientos de combinación que comprenden imidazopirazinonas para el tratamiento de trastornos psiquiátricos y/o cognitivos, del 29 de Julio de 2020, de H. LUNDBECK A/S: Un compuesto de Fórmula (I) **(Ver fórmula)** en donde n es 0 o 1; q es 0 o 1; R1 se selecciona del grupo que consiste en bencilo, indanilo, indolina y heteroarilos […]
Combinación de agonistas inversos del receptor de histamina-3 con inhibidores de acetilcolinesterasa, del 24 de Junio de 2020, de SUVEN LIFE SCIENCES LIMITED: Una combinación que comprende un agonista inverso del receptor de histamina-3 y un inhibidor de acetilcolinesterasa; en donde el agonista inverso del receptor de histamina-3 […]
Amidas heterocíclicas como inhibidores de quinasa, del 3 de Junio de 2020, de GlaxoSmithKline Intellectual Property Development Limited: Un compuesto que es **(Ver fórmula)** o un tautómero del mismo o una sal del mismo.
INHIBIDORES DE TGF-ß1 Y PRODUCTORES DE ENDOGLINA PARA SU USO EN EL TRATAMIENTO DE EPIDERMÓLISIS BULLOSA, del 14 de Mayo de 2020, de CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS (CSIC): La presente invención se refiere a un fármaco inhibidor de la ruta de TGF-ß1 y estimulador de endoglina o una composición farmacéutica del mismo, […]
Inhibidores de EZH2 (potenciador del homólogo Zeste 2), del 13 de Mayo de 2020, de Glaxosmithkline Intellectual Property (No. 2) Limited: Un compuesto según la Fórmula (I) o una sal farmacéuticamente aceptable del mismo: **(Ver fórmula)** en la que: representa un enlace sencillo […]
INHIBIDORES DE TGF-ß1 Y PRODUCTORES DE ENDOGLINA PARA SU USO EN EL TRATAMIENTO DE EPIDERMÓLISIS BULLOSA, del 8 de Mayo de 2020, de CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS (CSIC): Inhibidores de TGF-{beta}1 y productores de endoglina para su uso en el tratamiento de epidermólisis bullosa. La presente invención se refiere a un fármaco inhibidor […]
Benzazepinas fusionadas para el tratamiento de la tartamudez, del 29 de Abril de 2020, de Emalex Biosciences, Inc: Un antagonista selectivo para el receptor D1 y/o selectivo para D5 para su uso en el tratamiento de la tartamudez en un sujeto.
Compuestos de oxima como agonistas del receptor muscarínico M1 y/o M4, del 15 de Abril de 2020, de HEPTARES THERAPEUTICS LIMITED: Un compuesto de la fórmula : **(Ver fórmula)** o una sal del mismo, en donde: p es 0, 1 o 2; q es 0, 1 o 2; Y es N, O, S o C; X1 y X2 son grupos […]