Composición de espuma en aerosol.
Una espuma en aerosol farmacéutica que incluye una cantidad eficaz de:
un ingrediente farmacéuticamente activo, en la que el ingrediente farmacéuticamente activo es un corticosteroide;
un agente oclusivo que comprende vaselina;
un disolvente acuoso;
un codisolvente orgánico;
un componente emulgente; y
un propelente,
y en la que el ingrediente farmacéuticamente activo es insoluble en agua y en el agente oclusivo; y en la que elagente oclusivo está presente en una cantidad suficiente para formar una capa oclusiva sobre la piel, durante suuso.
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E07118237.
Solicitante: STIEFEL RESEARCH AUSTRALIA PTY LTD.
Nacionalidad solicitante: Australia.
Dirección: 8 MACRO COURT ROWVILLE VIC 3178 AUSTRALIA.
Inventor/es: ABRAM,ALBERT,ZORKO.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/573 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › sustituidos en posición 21, p. ej. cortisona, dexametasona, prednisona o aldosterona.
- A61K47/06 A61K […] › A61K 47/00 Preparaciones medicinales caracterizadas por los ingredientes no activos utilizados, p. ej. portadores o aditivos inertes; Agentes de direccionamiento o agentes modificadores enlazados químicamente al ingrediente activo. › Compuestos orgánicos, p. ej. hidrocarburos naturales o sintéticos, poliolefinas, aceite mineral, petrolato u ozoquerita.
- A61K47/10 A61K 47/00 […] › Alcoholes; Fenoles; Sus sales, p. ej. glicerol; Polietilenglicoles [PEG]; Poloxámeros; Éteres alquílicos PEG/POE.
- A61K47/12 A61K 47/00 […] › Acidos carboxílicos; Sus sales o anhídridos.
- A61K47/14 A61K 47/00 […] › Esteres de ácidos carboxílicos, p. ej. monoglicéridos de ácidos grasos, triglicéridos de cadenas medianas, parabenos o ésteres de ácidos grasos y de polietilenglicol (PEG).
- A61K47/44 A61K 47/00 […] › Aceites, grasas o ceras previstas en dos o más grupos de A61K 47/02 - A61K 47/42; Aceites naturales o aceites naturales modificados, grasas o ceras, p. ej. aceite de ricino, aceite de ricino polietoxilado, cera Montana, lignito, goma laca, colofonía, cera de abeja o lanolina (glicéridos sintéticos, p. ej. triglicéridos de cadena mediana, A61K 47/14).
- A61K47/46 A61K 47/00 […] › Ingredientes de constitución indeterminada o sus productos de reacción, p. ej. piel, hueso, leche, fibra de algodón, cáscara de huevo, bilis de buey (oxgall) o extractos de plantas.
- A61K8/04 A61K […] › A61K 8/00 Cosméticos o preparaciones similares para el aseo. › Dispersiones; Emulsiones.
- A61K9/12 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › Aerosoles; Espumas.
- A61P5/38 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 5/00 Medicamentos para el tratamiento de trastornos del sistema endocrino. › de las hormonas suprarrenales.
PDF original: ES-2431330_T3.pdf
Fragmento de la descripción:
Composición de espuma en aerosol
La presente invención proporciona una composición para la administración tópica de ingredientes farmacéuticos activos.
En la técnica anterior se conocen diversas espumas de degradación lenta y de degradación rápida en aerosol y no en aerosol para la administración tópica de ingredientes farmacéuticos activos. En particular, la composición de espuma es un sistema de emulsión acuoso. La composición de espuma, tras haber sido accionada, produce una espuma expandible, homogénea y estabilizada que se degrada fácilmente con cizallamiento. Una composición de este tipo se denomina con frecuencia una espuma en aerosol o "mousse".
Se conoce el uso de composiciones de espuma en aerosol para la administración tópica de ingredientes farmacéuticos activos. Un ejemplo de dicha composición se encuentra en la solicitud de patente australiana 80257/87, que divulga una composición de espuma en aerosol para la administración tópica del ingrediente farmacéuticamente activo, el minoxidilo. Sin embargo, la eficacia de dichos sistemas para administrar ingredientes farmacéuticamente activos es limitada.
Además, la mayoría de la cremas y lociones tópicas conocidas o sugeridas en la técnica anterior para administrar ingredientes farmacéuticamente activos contienen grandes cantidades de vaselina o algún otro agente oclusivo que actúa como barrera sobre la piel. Esta barrera reduce la evaporación de la humedad de la piel, que conduce a un mayor contenido en humedad del estrato córneo y de la epidermis, y potencia la administración tópica de los ingredientes farmacéuticos activos.
Sin embargo, en la práctica no resulta deseable incluir estas cantidades tan grandes de agente oclusivo en una formulación de espuma en aerosol, porque al dispensarse, la formulación de espuma en aerosol sería una espuma menos estable, y tras su aplicación, el agente oclusivo dejaría una espumosidad grasienta y pegajosa sobre la piel que no sería considerada aceptable por el consumidor.
En las patentes de EEUU de la técnica anterior 5.002.680 y 4.981.677, se divulgan composiciones de espuma en aerosol que contienen un agente oclusivo, tal como vaselina. Estas composiciones están dirigidas a objetivos cosméticos, y no se proporciona una descripción sobre su idoneidad (u otra consideración) para potenciar la administración tópica de ingredientes farmacéuticos activos. Además, con respecto a la patente de EEUU 4.981.677, la formulación incluye un componente de almidón. Por consiguiente, no resulta evidente que se forme una capa oclusiva.
El documento EP-A-0 484 530 divulga una preparación en aerosol de espuma para su uso como base para cosméticos, cuasifármacos, medicinas, etc., que comprende del 0, 1% al 5% en p/v de un tensioactivo, del 0, 05% al 10% en p/v de un alcohol inferior y/o un glicol, del 3% al 25% en p/v de agua, y del 60% al 95% en p/v de n-butano gaseoso.
El documento WO 96/27376 A divulga una composición farmacéutica que puede formar espuma que comprende una sustancia activa de corticosteroide, un agente de formación de espuma de degradación rápida, un propelente y un agente tamponante. El agente de formación de espuma de degradación rápida generalmente comprende un alcohol alifático, agua, un alcohol graso y un agente tensioactivo.
Woodford R., et al., Bioavailability and Activity of Topical Corticosteroids from a Novel Drug Deliver y System, the Aerosol Quick-Break Foam, Journal of Pharmaceutical Sciences, American Pharmaceutical Association, Washington, EEUU, vol. 66, n.º 1, enero 1977, pp. 99-103, divulga una composición de espuma con benzoato de betametasona, alcohol deshidratado y agua.
El documento WO 93/25189 A divulga una formulación de antibiótico útil para el tratamiento de quemaduras y abrasiones y adaptada para la aplicación tópica como una espuma clínicamente hidrosoluble, el procedimiento para la preparación de la formulación y un sistema dispensador especial para aplicarla. En una realización, la composición de espuma comprende sulfadiazina de plata al 1%, vaselina al 8, 22%, alcohol estearílico y agua.
Por consiguiente, sería un avance significativo en la técnica si pudiese proporcionarse una composición de espuma en aerosol que potencie la administración tópica del ingrediente farmacéutico activo, mientas que, al mismo tiempo, preferiblemente proporcione una composición farmacéuticamente elegante y aceptable por el consumidor.
En un primer aspecto de la presente invención, se proporciona una composición de espuma en aerosol farmacéutica que incluye una cantidad eficaz de un ingrediente farmacéuticamente activo, en la que el ingrediente farmacéuticamente activo es un corticosteroide; un agente oclusivo que comprende vaselina; un disolvente acuoso; un codisolvente orgánico; un componente emulgente; y un propelente,
siendo el ingrediente farmacéuticamente activo insoluble en agua y en el agente oclusivo; estando el agente oclusivo presente en una cantidad suficiente para formar una capa oclusiva sobre la piel, durante su uso.
La presente invención se ha previsto basándose en el sorprendente descubrimiento de que una formulación de espuma en aerosol con una cantidad relativamente baja de agente oclusivo sigue siendo capaz de reducir la pérdida de agua transepidérmica y, por tanto, en teoría aumentar la permeabilidad de la piel para que se produzca una mayor penetración del fármaco en la piel, mientras sigue siendo una composición elegante y aceptable por el consumidor.
El ingrediente farmacéuticamente activo hidroinsoluble es un corticosteroide. El corticosteroide puede seleccionarse de uno o más del grupo que consiste en valerato de betametasona y propionato de clobetasol.
Se prefiere el propionato de clobetasol.
El ingrediente farmacéuticamente activo puede estar presente en cualquier cantidad eficaz. El ingrediente farmacéuticamente activo puede estar presente en cantidades de aproximadamente 0, 005% en peso a aproximadamente 10% en peso, preferiblemente de aproximadamente 0, 051% a aproximadamente 1% en peso, basado en el peso total de la composición de espuma en aerosol farmaceútica.
La base de espuma en aerosol puede fabricarse utilizando composiciones que son muy conocidas en la técnica.
La composición de espuma en aerosol farmacéutica también incluye una cantidad eficaz de un propelente de aerosol. El propelente de aerosol utilizado en la composición de espuma en aerosol puede ser cualquier gas adecuado, tal como un hidrocarburo, por ejemplo, propano, butano, CFC, HFC, nitrógeno o aire. En una realización preferida, el propelente de aerosol es un hidrocarburo. Cuando el propelente de aerosol es un hidrocarburo, este puede estar presente en una cantidad de aproximadamente 2, 5% al 20% en peso, preferiblemente del 2, 5% al 7, 5% en peso, basado en el peso total de la composición de espuma en aerosol farmacéutica. El propelente puede introducirse en la composición de espuma en aerosol en el momento del llenado utilizando, por ejemplo, un dispensador de aerosol convencional, por ejemplo, una configuración de bote de pulverización.
El agente oclusivo utilizado en la composición farmacéutica según la presente invención es un excipiente, o una combinación de excipientes, que proporciona una capa oclusiva o una barrera de hidratación a la piel. Una capa oclusiva o una barrera de hidratación es una capa o una barrera suficiente para producir una reducción en la pérdidad de agua transepidérmica, que da como resultado la hidratación de la piel. Otros agentes oclusivos pueden seleccionarse del grupo que consiste en sebos y aceites minerales, ácidos de cadena larga, sebos y grasas animales, sebos y grasas vegetales, polímeros hidroinsolubles y similares. El agente oclusivo es vaselina.
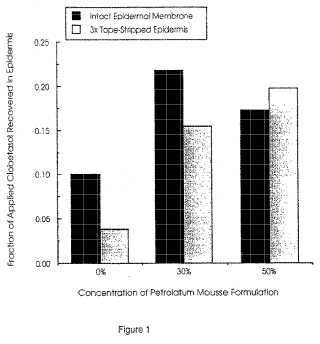
El agente oclusivo está presente en una cantidad suficiente para permitir la formación de una capa oclusiva o barrera de hidratación sobre la piel del paciente. De forma sorprendente, los solicitantes han descubierto que es posible formar dicha capa oclusiva con una cantidad relativamente pequeña de agente oclusivo. Por ejemplo, la cantidad de agente oclusivo en la composición de espuma en aerosol puede ser de hasta aproximadamente 55%, preferiblemente de aproximadamente 40% o menor en peso, basado en el peso total de la composición. En una realización preferida de la invención, la cantidad del agente oclusivo en la composicion de espuma en aerosol puede ser de hasta aproximadamente 50%, más preferiblemente de aproximadamente 20% al 50% en peso.
La composición de espuma en aerosol farmacéutica también incluye una cantidad eficaz de un emulgente.
El emulgente o tensioactivo puede seleccionarse... [Seguir leyendo]
Reivindicaciones:
1. Una espuma en aerosol farmacéutica que incluye una cantidad eficaz de:
un ingrediente farmacéuticamente activo, en la que el ingrediente farmacéuticamente activo es un corticosteroide;
un agente oclusivo que comprende vaselina;
un disolvente acuoso;
un codisolvente orgánico;
un componente emulgente; y
un propelente,
y en la que el ingrediente farmacéuticamente activo es insoluble en agua y en el agente oclusivo; y en la que el agente oclusivo está presente en una cantidad suficiente para formar una capa oclusiva sobre la piel, durante su uso.
2. Una composición de espuma en aerosol farmacéutica según la reivindicación 1, en la que el ingrediente farmacéuticamente activo es un corticosteroide seleccionado de uno o más del grupo que consiste en valerato de betametasona y propionato de clobetasol.
3. Una composición de espuma en aerosol farmacéutica según la reivindicación 1 o 2, en la que el ingrediente farmacéuticamente activo está presente en una cantidad del 0, 005% al 10% en peso, basado en el peso total de la composición.
4. Una composición de espuma en aerosol farmacéutica según la reivindicación 3, en la que el ingrediente farmacéuticamente activo está presente en una cantidad del 0, 05% al 1% en peso, basado en el peso total de la composición.
5. Una composición de espuma en aerosol farmacéutica según cualquiera de las reivindicaciones anteriores, en la que el agente oclusivo está presente en una cantidad del 10% al 50% en peso, basado en el peso total de la composición.
6. Una composición de espuma en aerosol farmacéutica según la reivindicación 5, en la que el agente oclusivo está presente en una cantidad del 20% al 50% en peso, basado en el peso total de la composición.
7. Una composición de espuma en aerosol farmacéutica según cualquiera de las reivindicaciones anteriores, en la que el agente oclusivo comprende también un aceite mineral.
8. Una composición de espuma en aerosol farmacéutica según cualquiera de las reivindicaciones anteriores, en la que el emulgente se selecciona de uno cualquiera o más del grupo que consiste en tensioactivos no iónicos, catiónicos o aniónicos, sus alcoholes grasos, ácidos grasos y sales de ácidos grasos.
9. Una composición de espuma en aerosol farmacéutica según la reivindicación 8, en la que el emulgente incluye una mezcla de monoestearato de sorbitano y polisorbato 60.
10. Una composición de espuma en aerosol farmacéutica según cualquiera de las reivindicaciones anteriores, en la que el componente emulgente está presente en una cantidad del 1% al 15% en peso, basado en el peso total de la composición.
11. Una composición de espuma en aerosol farmacéutica según la reivindicación 10, en la que el componente emulgente está presente en una cantidad del 2% al 5% en peso, basado en el peso total de la composición.
12. Una composición de espuma en aerosol farmacéutica según cualquiera de las reivindicaciones anteriores, en la que el disolvente acuoso está presente en una cantidad del 25% al 95% en peso, basado en el peso total de la composición.
13. Una composición de espuma en aerosol farmacéutica según cualquiera de las reivindicaciones anteriores, en la que el codisolvente orgánico está presente en una cantidad del 0, 25% al 50% en peso, basado en el peso total de la composición.
14. Una composición de espuma en aerosol farmacéutica según la reivindicación 13, en la que el codisolvente orgánico está presente en una cantidad del 0, 5% al 2% en peso, basado en el peso total de la composición.
15. Una composición de espuma en aerosol farmacéutica según cualquiera de las reivindicaciones anteriores, en la que el propelente de aerosol es un hidrocarburo y está presente en una cantidad del 2, 5% al 20% en peso, basado en el peso total de la composición.
16. Un dispensador de aerosol farmacéutico, que incluye una composición de espuma en aerosol farmacéutica según cualquiera de las reivindicaciones anteriores.
Patentes similares o relacionadas:
Preparación sólida que contiene colorante, del 29 de Julio de 2020, de DAIICHI SANKYO COMPANY, LIMITED: Preparación farmacéutica sólida que comprende monobencenosulfonato de ácido [(1R,5S,6S)-6-(aminometil)-3- etilbiciclo[3.2.0]hept-3-en-6-il]acético […]
Preparación externa líquida, del 29 de Julio de 2020, de HISAMITSU PHARMACEUTICAL CO. INC.: Una preparación tópica líquida, que comprende: agua; oxibutinina o una sal farmacéuticamente aceptable de la misma; y un éster de ácido dicarboxílico, […]
Método de tratamiento del cáncer, del 22 de Julio de 2020, de Intensity Therapeutics, Inc: Una composición que comprende una cantidad terapéuticamente efectiva de un agente terapéutico y un agente mejorador de la permeación intracelular para uso en el tratamiento […]
Preparaciones ácidas de insulina con estabilidad mejorada, del 15 de Julio de 2020, de SANOFI-AVENTIS DEUTSCHLAND GMBH: Formulación farmacéutica que contiene insulina humana Gly(A21),Arg(B31),Arg(B32) y un tensioactivo, elegido de un grupo que contiene Tween 20® y Tween 80®; siendo […]
Métodos para el tratamiento de la enfermedad ocular en sujetos humanos, del 10 de Junio de 2020, de Clearside Biomedical, Inc: Una formulación farmacéutica que comprende un fármaco para su uso en un método de tratamiento de un trastorno ocular posterior en un sujeto humano que […]
Preparación liofilizada de dipéptidos citotóxicos, del 3 de Junio de 2020, de ONCOPEPTIDES AB: Una preparación farmacéutica liofilizada que comprende (i) melfalán flufenamida, o una sal farmacéuticamente aceptable de la misma; y (ii) al menos un […]
Método y composiciones para el tratamiento de la psoriasis, del 29 de Abril de 2020, de Anaplasi Pharmaceuticals LLC: Una composición tópica en forma de aerosol, espuma o mousse, para el uso en el tratamiento de la psoriasis, en donde la composición comprende: a) del 30 % en […]
Formulación farmacéutica acuosa de tapentadol para administración por vía oral, del 22 de Abril de 2020, de GRUNENTHAL GMBH: Una composición farmacéutica acuosa que contiene tapentadol o una sal fisiológicamente aceptable del mismo y que está adaptada para administración […]