Vacunas a base de vector adenovírico.
Uso de un vector adenovírico del no subgrupo C en la fabricación de una composición farmacéutica para la inducciónde una respuesta inmune en un mamífero,
en el que (a) el vector adenovírico del no subgrupo C comprendeuna proteína de fibra adenovírica que comprende una secuencia de aminoácido que comprende 80% o más de identidadcon una secuencia de aminoácido de una proteína de fibra adenovírica del subgrupo C, (b) la proteína de fibraadenovírica se une a un virus Coxsackie y al receptor de adenovirus (CAR), y (c) el vector adenovírico comprendeademás una secuencia de ácido nucleico que codifica un antígeno el cual es expresado en el mamífero para induciruna respuesta inmune.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2004/024002.
Solicitante: GENVEC, INC.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 65 WEST WATKINS MILL ROAD GAITHERSBURG, MARYLAND 20878 ESTADOS UNIDOS DE AMERICA.
Inventor/es: NABEL, GARY, J., GALL,JASON G. D, WICKHAM,THOMAS J, ENRIGHT,WILLIAM J, BROUGH,DOUGLAS E, ZUBER,MOHAMMED, KING,C. RICHTER, CHENG,CHENG.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K39/235 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Adenoviridae.
- C12N15/861 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Vectores adenovirales.
PDF original: ES-2391975_T3.pdf
Fragmento de la descripción:
Vacunas a base de vector adenovirico
Campo de la invención
La presente invencion pertenece al uso de un vector adenovirico recombinante en la fabricacion de una composicion 5 farmaceutica para induccion de una respuesta inmune en un mamifero.
Antecedentes de la invención
El suministro de productos terapeuticos a sitios de enfermedad en cantidades biologicamente relevantes ha sido un obstaculo para el desarrollo de farmacos durante decadas. Una solucion que ha probado ser una alternativa con exito a las vias de suministro de farmacos tradicionales es el suministro de secuencias de acido nucleico exogeno
para la produccion de factores terapeuticos in vivo. Los vectores de transferencia de genes abarcan idealmente una amplia variedad de tipos de celulas, tienen la capacidad para aceptar grandes secuencias de acido nucleico, son seguros, y pueden producirse en cantidades requeridas para el tratamiento de pacientes. Los vectores adenoviricos tienen todos ellos estas propiedades ventajosas y se usan en una diversidad de protocolos para tratar o prevenir trastornos biologicos.
Sin embargo, el uso indiscriminado de vectores adenoviricos esta impedido, al menos en parte, por la inmunogenicidad del vector. Una mayoria de la poblacion de los Estados Unidos de America ha sido expuesta a adenovirus de tipo salvaje y han desarrollado inmunidad preexistente a vectores de transferencia de genes a base de adenovirus. Como un resultado de ello, los vectores adenoviricos son rapidamente aclarados de la corriente sanguinea, reduciendose, con ello, la eficacia del vector en el suministro de cantidades biologicamente relevantes de producto de
gen. La neutralizacion y/o aclaramiento de vectores adenoviricos en el cuerpo complica el uso de estos vectores como vacunas de ADN. Las vacunas de ADN usan vectores de transferencia de genes para suministrar ADN que codifica el antigeno a las celulas huespedes. Mediante la produccion de proteinas antigenicas in vivo, las colas mediadas por celulas y humorales del sistema inmune son activadas, generandose, de esta forma, una respuesta inmune mas completa contra el antigeno, en comparacion con las vacunas tradicionales en las que son inyectadas
dentro del cuerpo proteinas extrafas. A pesar de las caracteristicas ventajosas de los vectores adenoviricos como vehiculos de suministro de genes, la inmunogenicidad del vector evita la dosificacion repetida eficaz, lo que puede ser ventajoso para el "reforzamiento" del sistema inmune contra patogenos, y como resultado de ello, en unicamente una pequefa fraccion de una dosis de vector adenovirico se suministra su carga completa a las celulas huespedes.
El uso terapeutico de vectores adenoviricos esta igualmente limitado por la estabilidad de los vectores adenoviricos.
Por ejemplo, la eliminacion de la region E1 del genoma adenovirico del serotipo 5 hace que la deficiente replicacion del adenovirus frecuentemente de como resultado la atenuacion de la regulacion de la expresion de la proteina capsida iX (piX) . Aunque la atenuacion de la regulacion de la piX no parece inhibir la produccion de particulas viricas, los vectores adenoviricos deficientes en piX se ha mostrado que son termolabiles in vivo (vease, por ejemplo, Colby y otros, J. Virol., vol. 39, pags. 977980, (1981) ) , y no pueden encapsidar genomas de longitud total (vease,
por ejemplo, GhoshChoudhur y y otros, EMBO J., vol. 6, pags. 17331739, (1987) , y Caravokyri y otros, J. Virol., vol. 69, pags. 66276633, (1995) ) .
De acuerdo con ello, existe una necesidad en la tecnica de constructos de vectores adenoviricos alternativos y procedimientos de uso de dichos constructos, para suministrar secuencias de acidos nucleicos, particularmente secuencias de acidos nucleicos que codifiquen antigenos, a las celulas huespedes. La invencion proporciona dicho
vector adenovirico y procedimientos de uso. Estas y otras ventajas de la invencion, asi como caracteristicas de la invencion adicionales, resultaran evidentes a partir de la descripcion de la invencion proporcionada en la presente invencion..
Breve sumario de la invención
La invencion pertenece al uso de un vector adenovirico del nosubgrupo C de acuerdo con la reivindicacion 1.
45 La invencion proporciona ademas el uso de una composicion que comprende (a) un vector adenovirico del serotipo 41 o del serotipo 35 que comprende un genoma adenovirico deficiente en una o mas funciones del gen esenciales para la replicacion de la region E1A del genoma adenovirico y la region E1B del genoma adenovirico que codifica la proteina E1B de 55K y (b) un soporte. Ademas, la invencion proporciona un procedimiento de produccion de un vector adenovirico. El procedimiento comprende la introduccion de un vector adenovirico del serotipo 41 o un vector
50 adenovirico del serotipo 35 que comprende un genoma adenovirico deficiente en una o mas funciones del gen esenciales para la replicacion de la region E1A del genoma adenovirico y la region E1B del genoma adenovirico que codifica la proteina E1B de 55K dentro de una celula que comprende una secuencia de acido nucleico adenovirico del subgrupo C que codifica la una o mas funciones del gen esenciales para la replicacion de la region E1A y la region E1B que son deficientes en el vector adenovirico. La celula comprende ademas un marco de lectura abierto 6
55 (ORF6) de una region E4 adenovirica del subgrupo C. La celula no comprende una secuencia de acido nucleico del nosubgrupo C que codifica la una o mas funciones de la region E1A y la region E1B deficientes en el vector adenovirico. El procedimiento comprende ademas la propagacion del vector adenovirico.
2
Breve descripción de los dibujos
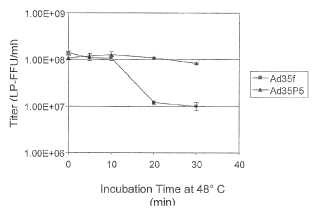
La Figura 1 es una grafica que ilustra el titulo del virus de los vectores adenoviricos Ad35f y Ad35P5 en funcion del tiempo a 48ºC.
La Figura 2 es una grafica que ilustra los resultados del analisis mediante espectroscopia de masas del Ad35 de tipo salvaje y un vector adenovirico Ad35 eliminada la E1.
La Figura 3 es un diagrama que ilustra el genoma de un vector adenovirico Ad35 que comprende la secuencia de acido nucleico que codifica la piX ligada de manera operable a un promotor AAV p5.
La Figura 4 representa un analisis mediante gel de poliacrilamida tefido con plata de la proteinas codificadas por el Ad35 de tipo salvaje y el vector adenovirico Ad35f.
Descripción detallada de la invención
La invencion proporciona materiales y su uso para la induccion de una respuesta inmune en un mamifero. En particular, la invencion proporciona vectores adenoviricos adecuados para el suministro de secuencias de acido nucleico que codifican uno o mas antigenos a celulas huespedes y procedimientos de uso de dichos vectores adenoviricos para inducir una respuesta inmune contra uno o mas antigenos codificados. En una realizacion, la invencion proporciona el uso de un vector adenovirico para la induccion de una respuesta inmune en un mamifero, que comprende la administracion al mamifero de un vector adenovirico del nosubgrupo C que comprende una proteina de fibra adenovirica que comprende una secuencia de aminoacido que comprende aproximadamente 80% o mas de identidad con la secuencia de aminoacido que codifica una proteina de fibra adenovirica del subgrupo C. El vector adenovirico comprende ademas una secuencia de acido nucleico que codifica al menos un antigeno que esta expresado en el mamifero, para inducir una respuesta inmune.
Pueden usarse adenovirus procedentes de cualquier origen, cualquier subgrupo, mezcla de subgrupos, o cualquier adenovirus quimerico como la fuente del genoma virico para el vector adenovirico de la invencion. Preferiblemente, se usa un adenovirus humano como la fuente del genoma virico para un vector adenovirico suministrado a pacientes humanos. A este respecto, el adenovirus puede ser del subgrupo C (por ejemplo, serotipos 2 y 5) . Sin embargo, en el contexto del procedimiento de la invencion, preferiblemente el adenovirus no es un adenovirus del subgrupo C. Por ejemplo, un adenovirus puede ser del subgrupo A (por ejemplo, serotipos 12, 18, y 31) , del subgrupo B (por ejemplo, serotipos 3, 7, 11, 14, 16, 21, 34, 35, y 50) , del subgrupo D (por ejemplo, serotipos 8, 9, 10, 13, 15, 17, 19, 20, 2230, 32, 33, 3639, y 4248) , del subgrupo E (por ejemplo, serotipo 4) , del subgrupo F (por ejemplo, serotipos 40 y 41) , o de un subgrupo no clasificado... [Seguir leyendo]
Reivindicaciones:
1. Uso de un vector adenovirico del no subgrupo C en la fabricacion de una composicion farmaceutica para la induccion de una respuesta inmune en un mamifero, en el que (a) el vector adenovirico del no subgrupo C comprende una proteina de fibra adenovirica que comprende una secuencia de aminoacido que comprende 80% o mas de identidad con una secuencia de aminoacido de una proteina de fibra adenovirica del subgrupo C, (b) la proteina de fibra adenovirica se une a un virus Coxsackie y al receptor de adenovirus (CAR) , y (c) el vector adenovirico comprende ademas una secuencia de acido nucleico que codifica un antigeno el cual es expresado en el mamifero para inducir una respuesta inmune.
2. El uso de la reivindicacion 1, en el que el vector adenovirico es un vector adenovirico del subgrupo B o un vector adenovirico del subgrupo F.
3. El uso de la reivindicacion 2, en el que el vector adenovirico es un vector adenovirico del serotipo 35.
4. El uso de cualquiera de las reivindicaciones 13, en el que la proteina de fibra adenovirica del subgrupo C es una proteina de fibra adenovirica del serotipo 5.
5. El uso de la reivindicacion 4, en el que la proteina de fibra adenovirica comprende un dominio tallo de una proteina de fibra adenovirica del serotipo 5 y un dominio boton de una proteina de fibra del serotipo 5.
6. El uso de la reivindicacion 5, en el que la proteina de fibra adenovirica comprende un dominio tallo de una proteina de fibra adenovirica del serotipo 5, un dominio cola de una proteina de fibra del serotipo 35, y un dominio boton de una proteina de fibra del serotipo 5.
7. El uso de la reivindicacion 2, en el que el vector adenovirico es un vector adenovirico del serotipo 41.
8. El uso de cualquiera de las reivindicaciones 17, en el que el vector adenovirico comprende un genoma adenovirico que es deficiente en una o mas funciones del gen esenciales para la replicacion de la region E1 y/o la region E4 del genoma adenovirico.
9. El uso de la reivindicacion 8, en el que la secuencia de acido nucleico que codifica el antigeno esta posicionada en la region E1 o la region E4 del genoma adenovirico.
10. El uso de cualquiera de las reivindicaciones 19, en el que el vector de transferencia del gen de cebado que comprende una secuencia de acido nucleico que codifica un antigeno, es para ser administrada al mamifero antes de administrar al mamifero el vector adenovirico.
11. El uso de la reivindicacion 10, en el que el vector de transferencia del gen de cebado comprende una secuencia de acido nucleico que codifica un primer antigeno, el vector adenovirico comprende una secuencia de acido nucleico que codifica un segundo antigeno, y el primer antigeno y el segundo antigeno son el mismo antigeno.
12. El uso de la reivindicacion 10, en el que el vector de transferencia del gen de cebado comprende una secuencia de acido nucleico que codifica un primer antigeno, el vector adenovirico comprende una secuencia de acido nucleico que codifica un segundo antigeno, y el primer antigeno y el segundo antigeno son diferentes.
13. El uso de cualquiera de las reivindicaciones 1012, en el que el vector de transferencia del gen de cebado es un vector adenovirico.
14. El uso de cualquiera de las reivindicaciones 113, en el que multiples vectores adenoviricos, comprendiendo cada vector adenovirico una o mas secuencias de acido nucleico que codifican uno o mas antigenos, son para ser administrados al mamifero.
15. El uso de cualquiera de las reivindicaciones 114, en el que el vector adenovirico comprende una proteina de recubrimiento quimerica que comprende una secuencia de aminoacido no nativa que codifica un antigeno.
16. El uso de la reivindicacion 15, en el que al menos un antigeno esta presente mediante complejos de histocompatibilidad principal tipo i (MHC i) y al menos un antigeno esta presente mediante complejos MHC ii.
17. El uso de cualquiera de las reivindicaciones 116, en el que el vector adenovirico comprende unas secuencias de acido nucleico nativas que carecen de genoma adenovirico que codifican proteinas adenoviricas.
18. El uso de cualquiera de las reivindicaciones 817, en el que una secuencia espaciadora esta posicionada en la region E4 del genoma adenovirico.
19. El uso de cualquiera de las reivindicaciones 118, en el que el vector adenovirico comprende multiples secuencias de acido nucleico que codifican diferentes antigenos.
20. El uso de la reivindicacion 19, en el que dos o mas secuencias de acido nucleico que codifican antigenos dife
rentes estan ligadas de manera operable a diferentes promotores. 34
21. El uso de cualquiera de las reivindicaciones 118, en el que el vector adenovirico comprende multiples secuencias de acido nucleico que codifican el mismo antigeno.
22. El uso de la reivindicacion 21, en el que dos o mas secuencias de acido nucleico que codifican el mismo antigeno estan ligadas de manera operable a diferentes promotores.
23. El uso de cualquiera de las reivindicaciones 122, en el que el vector adenovirico comprende una proteina de recubrimiento quimerica que comprende una secuencia de aminoacido no nativa, y en la que la secuencia de aminoacido no nativa comprende un motivo RGD.
Fi ura 1
iempo de incubación a 488C min Fi ura 2 Fi ura 3
Patentes similares o relacionadas:
Composiciones útiles en el tratamiento de la deficiencia de ornitina transcarbamilasa (OTC), del 8 de Julio de 2020, de THE TRUSTEES OF THE UNIVERSITY OF PENNSYLVANIA: Un vector vírico recombinante que comprende una secuencia de ácido nucleico que codifica la proteína ornitina transcarbamilasa humana (hOTC) y secuencias […]
Composiciones y métodos para la expresión de ARNs de guía de CRISPR utilizando el promotor de H1, del 29 de Enero de 2020, de THE JOHNS HOPKINS UNIVERSITY: Un sistema CRISPR-Cas no natural que comprende un vector que comprende un promotor H1 bidireccional, en donde el promotor de H1 bidireccional comprende: a) elementos […]
Métodos y composiciones para tratar depósitos amiloides, del 22 de Enero de 2020, de UNIVERSITY OF IOWA RESEARCH FOUNDATION: Una partícula de rAAV2 que comprende una proteína de la cápside de AAV2 y un vector que comprende un ácido nucleico que codifica para una […]
 Células dendríticas alogénicas mejoradas para uso en el tratamiento de cáncer, del 30 de Octubre de 2019, de IMMUNICUM AB: Un método para proporcionar células dendríticas proinflamatorias, teniendo dichas células dendríticas proinflamatorias una capacidad mejorada para activar células T alogénicas […]
Células dendríticas alogénicas mejoradas para uso en el tratamiento de cáncer, del 30 de Octubre de 2019, de IMMUNICUM AB: Un método para proporcionar células dendríticas proinflamatorias, teniendo dichas células dendríticas proinflamatorias una capacidad mejorada para activar células T alogénicas […]
Adenovirus que expresan antígenos oncógenos heterólogos, del 4 de Septiembre de 2019, de BOARD OF REGENTS THE UNIVERSITY OF TEXAS SYSTEM: Un adenovirus oncolítico recombinante que tiene un genoma que comprende una o más secuencias de ácido nucleico heterólogas que codifican un antígeno oncógeno, […]
Vector de virus adenoasociado, del 28 de Agosto de 2019, de KING'S COLLEGE LONDON: Un vector de virus adenoasociado (AAV) recombinante que comprende: (a) una proteína de la cápside del AAV2 variante, en el que la proteína de la cápside del AAV2 variante […]
Mutantes de E1A y E1B de adenovirus selectivos de tumor, del 10 de Julio de 2019, de THE REGENTS OF THE UNIVERSITY OF CALIFORNIA: Un adenovirus recombinante que comprende una secuencia de ADN que se inserta en un sitio de inserción de E1b- 19K, en el que dicho sitio de inserción […]
Composiciones de SYN3 y métodos, del 12 de Junio de 2019, de MERCK SHARP & DOHME CORP: Una composicion farmaceutica liofilizada que comprende N-(3-colamidopropil)-N-(3(actobionamidopropil))-colamida (SYN3), hidroxipropil-beta-ciclodextrina (HPßCD) y un sistema […]