Procedimiento para preparar ésteres dialquílicos del ácido tiodiglicólico.
Procedimiento para preparar ésteres alquílicos del ácido tiodiglicólico de fórmula general (I)
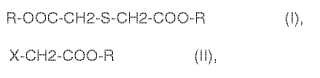
R-OOC-CH2-S-CH2-COO-R (I),
en la que R representa un resto de alquilo C1 a C10 ramificado o no ramificado, caracterizado porque un éster alquílico de ácido haloacético de fórmula general (II)
X-CH2-COO-R (II),
en la que X representa un átomo de cloro o de bromo y R tiene el significado tal como se indica para compuestos de fórmula (I), se hace reaccionar con una solución acuosa de sulfuro alcalino o hidrogenosulfuro alcalino en presencia de una solución acuosa de tampón de pH en el intervalo de pH entre 5 y 8.
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E08169741.
Solicitante: SALTIGO GMBH.
Nacionalidad solicitante: Alemania.
Dirección: KATZBERGSTRASSE 1 40764 LANGENFELD ALEMANIA.
Inventor/es: RODEFELD, LARS, DR., BRODA, WITOLD, DR., RICHTER, HARTMUT, Sommer,Joachim, Westen,Joachim.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07C319/14 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07C COMPUESTOS ACICLICOS O CARBOCICLICOS (compuestos macromoleculares C08; producción de compuestos orgánicos por electrolisiso electroforesis C25B 3/00, C25B 7/00). › C07C 319/00 Preparación de tioles, de sulfuros, de hidropolisulfuros o de polisulfuros. › de sulfuros.
- C07C323/52 C07C […] › C07C 323/00 Tioles, sulfuros, hidropolisulfuros o polisulfuros sustituidos por halógenos, átomos de oxígeno o de nitrógeno o por átomos de azufre que no forman parte de grupos tio. › en que la estructura carbonada es acíclica y saturada.
PDF original: ES-2380267_T3.pdf
Fragmento de la descripción:
Procedimiento para preparar ésteres dialquílicos del ácido tiodiglicólico La invención se refiere a un nuevo procedimiento para preparar ésteres dialquílicos del ácido tiodiglicólico C1-C10.
Los ésteres dialquílicos del ácido tiodiglicólico son precursores importantes para la preparación de productos químicos especiales por ejemplo para el uso en polímeros electrónicamente conductores.
La síntesis de diésteres del ácido tiodiglicólico se conoce en principio ya desde hace tiempo.
Existen esencialmente dos modos para sintetizar ésteres dialquílicos del ácido tiodiglicólico:
a) esterificación de ácido tiodiglicólico con alcoholes con catálisis acida.
b) reacción de ésteres del ácido cloroacético con sulfuro de sodio.
Un inconveniente esencial de la variante a) es que para la esterificación del ácido tiodiglicólico con alcoholes con ayuda de ácido clorhídrico (Schulze, Zeitschrift für Chemie 1865, pág. 78) o con ayuda de ácido sulfúrico (Seka, Berichte 58, 1925, pág. 1786) se requiere ácido tiodiglicólico. Esto significa que el ácido tiodiglicólico muy soluble en agua debe separarse de la fase acuosa. A este respecto queda siempre una parte del ácido tiodiglicólico en la solución madre y además precipita en caso de aislamiento como sólido el ácido tiodiglicólico junto con sales inorgánicas, de modo que debe recristalizarse otra vez. Por tanto, una esterificación a partir de la solución acuosa proporciona resultados insatisfactorios (documento US 2.425.225) .
Para evitar el costoso aislamiento del ácido tiodiglicólico como sólido se describe en el documento US 2.425.225 un procedimiento en el que se extrae el ácido tiodiglicólico directamente con el alcohol que va esterificarse de la fase acuosa. Sin embargo este procedimiento funciona sólo con alcoholes con más de tres átomos de carbono y por tanto es inadecuado para la síntesis de éster metílico, éster etílico y éster propílico del ácido tiodiglicólico, dado que los alcoholes correspondientes con menos de cuatro átomos de carbono son completamente solubles en agua y por tanto no pueden actuar como agentes de extracción.
Una dificultad especial en caso de la reacción de ésteres del ácido cloroacético con sulfuro de sodio consiste en que sulfuro de sodio es una base muy fuerte, mientras que los ésteres del ácido cloroacético son muy sensibles al pH y saponifican fácilmente.
Si se introduce una solución acuosa de sulfuro de sodio en éster metílico del ácido cloroacético, se obtiene debido a la saponificación del producto de partida y/o del producto sólo rendimientos moderados de éster metílico del ácido tiodiglicólico. En el documento WO 00/45451 se índice un rendimiento del 39 % en caso de la reacción de éster etílico del ácido bromoacético con sulfuro de sodio.
Una posibilidad de evitar la saponificación del éster del ácido cloroacético es, tal como se describe en el documento US 2.262.686, realizar la reacción en un disolvente inerte tal como acetona. En caso de esta variante libre de agua para la síntesis de ésteres del ácido tiodiglicólico se requiere sulfuro de sodio libre de agua, que es claramente más caro que con contenido de agua, y el tiempo de reacción es desproporcionadamente largo con 15 h a 20 h de ebullición a reflujo.
El objetivo de la presente invención era facilitar un procedimiento para preparar un éster dialquílico del ácido tiodiglicólico, que produzca el producto deseado de manera simplificada y con mejor rendimiento que según el estado de la técnica hasta ahora.
Sorprendentemente pudo comprobarse que, mediante el ajuste de condiciones de reacción adecuadas, la reacción de éster metílico del ácido cloroacético con sulfuro alcalino o hidrogenosulfuro alcalino para dar éster dimetílico del ácido tiodiglicólico en solución acuosa proporciona sin embargo rendimientos muy altos. Es decisivo que el compuesto de sulfuro se consuma por reacción rápidamente y con ello se mantenga el valor de pH en la solución en el intervalo de 5 < pH < 8.
Por tanto es objeto de la invención un procedimiento para preparar ésteres alquílicos del ácido tiodiglicólico de fórmula general (I)
R-OOC-CH2-S-CH2-COO-R (I) , en la que R representa un resto de alquilo C1 a C10 ramificado o no ramificado, caracterizado por que un éster alquílico de ácido haloacético de fórmula general (II)
X-CH2-COO-R (II) , en la que X representa un átomo de cloro o bromo y R tiene el significado tal como se indica para compuestos de fórmula (I) , se hace reaccionar con una solución acuosa de sulfuro alcalino o hidrogenosulfuro alcalino en presencia de una solución acuosa de tampón de pH en el intervalo de pH entre 5 y 8.
Preferentemente, la solución acuosa de tampón es una solución de tampón hidrogenofosfato dialcalino o dihidrogenofosfato alcalino o acetato de amonio o cloruro de amonio. Ejemplos de hidrogenofosfato dialcalino son K2HPO4 o Na2HPO4. Ejemplo de dihidrogenofosfato alcalino son KH2PO4 y NaH2PO4.
Como fuente de sulfuro pueden usarse disoluciones acuosas tanto de sulfuro alcalino (sulfuro de sodio o potasio) como de hidrogenosulfuro alcalino (hidrogenosulfuro de sodio o potasio) . La concentración de la solución acuosa de sulfuro alcalino se encuentra, a este respecto, entre el 5 % y el 20 % en peso y la de la solución de hidrogenosulfuro alcalino se encuentra entre el 5 % y el 50 % en peso.
La dosificación de los reactivos a la solución de tampón acuosa puede realizarse con agitación de manera en sí conocida, por ejemplo en un recipiente de doble revestimiento que puede calentarse a través de bombas, mediante conductos separados o a través de una mezcladora estática.
Habitualmente se dosifica el éster alquílico de ácido haloacético C1-C10 junto con el sulfuro alcalino o el hidrogenosulfuro alcalino en una proporción molar entre 1:1 a 3:1. Preferentemente, esta proporción molar asciende a 2:1. La dosificación puede realizarse, a este respecto, simultáneamente, o en porciones, sin embargo preferentemente de manera simultánea.
A este respecto, la dosificación simultánea se realiza por regla general durante un espacio de tiempo de 0, 5 a 24 horas. La temperatura, a la que se realiza la dosificación, debía en el intervalo entre 10 º C y 60 º C, preferentemente de 20 º C a 40 º C.
Preferentemente se realiza la reacción en presencia de un catalizador de transferencia de fases. Se prefieren a este respecto los catalizadores que pueden obtenerse comercialmente cloruro de tetrabutilamonio, cloruro de tributilmetilamonio, cloruro de metiltrioctilamonio, cloruro de metiltridecilamonio, polietilenglicol 400 - 40.000, éteres corona, tris[2- (2-metoxietoxi) etil]amina o sales de trialquilfosfonio. De manera especialmente preferente se usa como catalizador de transferencia de fases cloruro de tetrabutilamonio o polietilenglicol 400.
Debe presentarse atención a que el valor del pH durante la reacción se mantenga entre 5 y 8.
Tras realizar la reacción se separa el producto bruto de la solución de tampón acuosa. Esto puede realizarse por ejemplo mediante extracción. Para ello se mezcla la solución de reacción con un disolvente no miscible con agua y se separa la fase acuosa de la fase orgánica. De la fase orgánica puede separarse entonces a continuación, por ejemplo mediante destilación, el agente de extracción. El residuo contiene el producto deseado en rendimientos del 88 % al 95 % de la teoría.
Como agentes de extracción para separar el producto bruto de la solución de tampón acuosa pueden usarse dialquil (C2-C4) éteres ramificados o no ramificados, tales como dietiéter (DEE) y metil-terc-butiléter (MTBE) , o dialquilcetonas ramificadas o no ramificadas, tales como metilisobutilcetona (MIBK) , o hidrocarburos C4-C10 ramificados o no ramificados tales como pentano, hexano, heptano o ciclohexano, o compuestos aromáticos tales como benceno, tolueno, xileno o diclorobenceno. Preferentemente se usa tolueno como agente de extracción.
Según el procedimiento según la invención pueden prepararse ésteres dialquílicos del ácido tiodiglicólico con restos alquilo C1-C10 en las partes de éster usando el correspondiente éster alquílico C1-C10 de ácido haloacético. Preferentemente se prepara el éster alquílico C1-C4, o sea éster dimetílico del ácido tiodiglicólico, éster dietílico del ácido tiodiglicólico,... [Seguir leyendo]
Reivindicaciones:
1. Procedimiento para preparar ésteres alquílicos del ácido tiodiglicólico de fórmula general (I) R-OOC-CH2-S-CH2-COO-R (I) , en la que R representa un resto de alquilo C1 a C10 ramificado o no ramificado, caracterizado porque un éster alquílico de ácido haloacético de fórmula general (II) X-CH2-COO-R (II) , en la que X representa un átomo de cloro o de bromo y R tiene el significado tal como se indica para compuestos de
fórmula (I) , se hace reaccionar con una solución acuosa de sulfuro alcalino o hidrogenosulfuro alcalino en presencia de una solución acuosa de tampón de pH en el intervalo de pH entre 5 y 8.
2. Procedimiento según la reivindicación 1, caracterizado porque el procedimiento se realiza en presencia de un catalizador de transferencia de fases.
3. Procedimiento según una de las reivindicaciones 1 a 2, caracterizado porque la solución de tampón acuosa contiene un tampón hidrogenofosfato dialcalino, uno dihidrogenofosfato alcalino, uno hidrogenocarbonato de sodio, uno acetato de amonio o uno cloruro de amonio.
4. Procedimiento según una de las reivindicaciones 1 a 3, caracterizado porque el intervalo de pH se encuentra entre 6 y 8.
5. Procedimiento según una de las reivindicaciones 1 a 4, caracterizado porque como solución acuosa de sulfuro alcalino se usa una solución acuosa de sulfuro de sodio con un contenido entre el 5 % y el 30 % en peso o una solución acuosa de hidrogenosulfuro de sodio con un contenido entre el 5 % y el 50 % en peso.
6. Procedimiento según una de las reivindicaciones 1 a 5, caracterizado porque el éster alquílico de ácido haloacético de fórmula (II) es un éster metílico, éster etílico, éster propílico, éster butílico, éster pentílico, éster hexílico o éster ciclohexílico del ácido cloroacético o un éster metílico, éster etílico, éster propílico, éster butílico, éster pentílico, éster hexílico o éster ciclohexílico del ácido bromoacético.
7. Procedimiento según una de las reivindicaciones 1 a 6, caracterizado porque el éster alquílico de ácido haloacético de fórmula (II) y la solución de sulfuro alcalino o hidrogenosulfuro alcalino se dosifican uno con respecto al otro simultáneamente en una proporción molar de 1:1 a 3:1.
8. Procedimiento según una de las reivindicaciones 1 a 7, caracterizado porque la temperatura de la solución de reacción se encuentra en el intervalo de 0 º C a 60 º C.
9. Procedimiento según una de las reivindicaciones 2 a 8, caracterizado porque como catalizador de transferencia de fases se usa cloruro de tetrabutilamonio, cloruro de tributilmetilamonio, cloruro de metiltrioctilamonio, cloruro de metiltridecilamonio, polietilenglicol 400 - 40.000, éteres corona, tris[2- (2-metoxietoxi) etil]aminas o una sal de trialquilfosfonio.
10. Procedimiento según una de las reivindicaciones 1 a 9, caracterizado porque se separa de la solución de reacción acuosa los ésteres dialquílicos del ácido tiodiglicólico C1-C10 mediante extracción con un disolvente orgánico no miscible con agua.
Patentes similares o relacionadas:
Compuesto de tioéter para la protección del grupo 2''-hidroxi en nucleósidos que van a ser utilizados en la síntesis de oligonucleótidos, del 6 de Mayo de 2020, de Bonac Corporation: Un éter representado por la siguiente fórmula química : **(Ver fórmula)** en dicha fórmula química , R4 es un grupo alquilo de cadena lineal o ramificada […]
Procedimiento para preparar ácidos 2-alquil-4-trifluorometil-3-alquilsulfonilbenzoicos, del 19 de Febrero de 2020, de BAYER CROPSCIENCE AKTIENGESELLSCHAFT: Procedimiento para preparar ácidos 2-alquil-4-trifluorometil-3-alquilsulfonilbenzoicos de la fórmula general (I), caracterizado porque a) en una […]
Procedimiento para la preparación de ácidos 2-alquil-4-trifluorometil-3-alquilsulfonilbenzoicos mediante oxidación quimioselectiva de tioéter, del 25 de Septiembre de 2019, de BAYER CROPSCIENCE AKTIENGESELLSCHAFT: Procedimiento para la preparación de ácidos 2-alquil-4-trifluorometil-3-alquilsulfonilbenzoicos de la fórmula general (I), caracterizado porque a) en una […]
Proceso para la preparación de análogos alfa-hidroxi de metionina a partir de azúcares y derivados de los mismos, del 25 de Septiembre de 2019, de HALDOR TOPS E A/S: Un proceso para la preparación de un análogo α-hidroxi de metionina y sus derivados de la fórmula: R'-S-CH2-CH2-CHOH-COO-R (I) en la que R se selecciona […]
Proceso de preparación de un compuesto de cetona poliinsaturada, del 20 de Marzo de 2019, de AVEXXIN AS: Un procedimiento de preparación de una cetona poliinsaturada que comprende: hacer reaccionar un alcohol poliinsaturado en presencia de un […]
Procedimiento para la obtención de derivados de 1,1-dióxido de 1,4-benzotiepina, del 24 de Enero de 2018, de SANOFI-AVENTIS DEUTSCHLAND GMBH: Procedimiento para la obtención del compuesto de la fórmula I **Fórmula** donde significan R2, R2', R3, R3', R4, R4', R5, R5', independientemente entre […]
Fosforamidatos de nucleósidos para producir ácidos nucleicos, del 31 de Mayo de 2017, de Bonac Corporation: Un compuesto de glucósido representado por la siguiente fórmula química , uno de sus enantiómeros, uno de sus tautómeros o estereoisómeros o una de […]
Derivados fenólicos azufrados, del 28 de Diciembre de 2016, de ARKEMA FRANCE: Procedimiento de preparación, a partir de materias primas de origen renovable, de compuestos fenólicos azufrados que responden a la siguiente fórmula :**Fórmula** […]