PELLETS ENTÉRICOS DE DULOXETINA.
La presente invención se refiere a pellets que comprenden un núcleo con duloxetina,
una capa intermedia no porosa que comprende uno o más polímeros solubles en agua formadores de película, y una capa entérica que comprende un polímero entérico diferente a acetato ftalato de polivinilo, a un procedimiento para preparar los mismos, al uso de los pellets para fabricar una forma farmacéutica de dosificación, y a una forma farmacéutica que contiene los mismos.
Tipo: Patente de Invención. Resumen de patente/invención. Número de Solicitud: P201130420.
Solicitante: LABORATORIOS DEL DR. ESTEVE, S.A..
Nacionalidad solicitante: España.
Inventor/es: GARCIA ROVIRA,MONTSERRAT, CASADEVALL PUJALS,GEMMA.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/381 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › teniendo ciclos de cinco eslabones.
- A61K9/50 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › Microcápsulas (A61K 9/52 tiene prioridad).
Fragmento de la descripción:
PELLETS ENTÉRICOS DE DULOXETINA
CAMPO DE LA INVENCIÓN
La presente invención se refiere a pellets entéricos de duloxetina o sales farmacéuticamente aceptables de la misma y a un método para su fabricación.
ANTECEDENTES DE LA INVENCIÓN
La duloxetina es un inhibidor selectivo de la recaptación de serotonina y norepinefrina que tiene el nombre químico (+) - (S) -N-metil-!- (1-naftaleniloxi) -2tiofenopropilamina. La duloxetina, comercializada como su sal de clorhidrato, se describe en la solicitud de patente europea EP 273 658.
Las formulaciones de liberación retardada son ventajosas, dado que estas impiden la exposición de un principio activo farmacéutico (API) sensible a ácido al entorno ácido del estómago de un paciente, impidiendo la degradación del API y/o la irritación del estómago del paciente.
Dado que la duloxetina es un API lábil en medio ácido, es aconsejable formularlo como una formulación entérica.
La solicitud de patente europea EP 0 693 282 A2 describe una formulación de duloxetina de liberación retardada en forma de pellet recubierto de duloxetina entérico. El polímero de recubrimiento entérico seleccionado es el acetato succinato de hidroxipropilmetilcelulosa (HPMCAS) . Cuando el polímero entérico se aplica como una suspensión acuosa, a menudo surge un problema en la obtención de una película uniforme, coherente. Es importante garantizar que la suspensión permanece homogénea, y que no se producen las condiciones responsables de la aglomeración del polímero. En particular, es aconsejable enfriar la suspensión de HPMCAS por debajo de 20º C antes de la aplicación, enfriar los tubos y la boquilla mediante el bombeo de una pequeña cantidad de agua fría a través de los mismos, antes de empezar a bombear la suspensión, y usar tubos de suministro con un diámetro tan pequeño como permita la velocidad de pulverización de manera que la suspensión pueda mantenerse en movimiento rápidamente en los tubos. Se prefiere aplicar el polímero entérico como una disolución acuosa siempre que sea posible hacerlo. La disolución de HPMCAS se puede obtener mediante la neutralización del polímero, preferiblemente con amoníaco.
La solicitud de patente internacional WO 2007/139886 describe una formulación de liberación retardada de clorhidrato de duloxetina que comprende un núcleo inerte, una capa de fármaco que comprende clorhidrato de duloxetina, una capa de separación, una capa entérica que comprende al menos uno de un copolímero de ácido metacrílico y ftalato de hidroxipropilmetilcelulosa, y opcionalmente una capa de acabado. La capa entérica se aplica para lograr la liberación retardada del clorhidrato de duloxetina principalmente en el intestino delgado. Preferiblemente, la capa entérica es sustancialmente insoluble en entornos ácidos, tales como el estómago, pero es soluble en entornos casi neutros, tales como el intestino delgado. Por tanto, la formulación se mantiene intacta a medida que pasa a través del entorno ácido del estómago, pero se disuelve y libera el clorhidrato de duloxetina una vez que pasa al entorno casi neutro del intestino delgado. La capa entérica contiene preferiblemente un polímero que disuelve a un pH aproximadamente superior a 5, 5.
La solicitud de patente internacional WO 2008/020286 se refiere a una composición farmacéutica retardada que comprende un núcleo que contiene duloxetina y un recubrimiento entérico que comprende copolímero de ácido metacrílico (Eudragit®) . Las capas entéricas a base de copolímero de ácido metacrílico no se disuelven a un pH inferior a 6.
Con el fin de empezar la disolución de las capas entéricas a un pH inferior, Eudragit® puede tratarse químicamente, por ejemplo, mediante neutralización con NaOH, o mediante reacción de los grupos carboxílicos libres del copolímero de ácido metacrílico para formar ésteres, por ejemplo ftalatos, acetatos, etc. Incluso aplicando esos tratamientos, el copolímero de ácido metacrílico no empieza a disolver hasta un pH superior a 5.
La solicitud de patente internacional WO 2008/077939 se refiere a una composición farmacéutica de microgránulos que comprende duloxetina o una sal farmacéuticamente aceptable de la misma, particularmente, la sal de clorhidrato, una capa de separación que comprende una sal inorgánica soluble en agua en forma de cristales, y una capa entérica. Los pellets descritos en los ejemplos 2 y 4 contienen una capa intermedia que comprende hipromelosa y una capa entérica que comprende acetato ftalato de polivinilo.
La solicitud de patente US 2008/0226711 se refiere a composiciones farmacéuticas orales sólidas que comprenden un núcleo que comprende duloxetina, una capa de separación opcional y un recubrimiento entérico. Se describen pellets que comprenden núcleos recubiertos con clorhidrato de duloxetina, una capa de separación que comprende HPMC y una capa entérica que comprende acetato ftalato de polivinilo y ftalato dietílico.
La patente US 5 776 969 describe pellets que contienen granulados de almidónsacarosa con un recubrimiento que comprende duloxetina, una capa intermedia que comprende HPMC, una capa entérica que comprende acetato succinato de HPMC y una capa de acabado. Se menciona el acetato ftalato de polivinilo entre otros polímeros entéricos adecuados.
FIGURAS
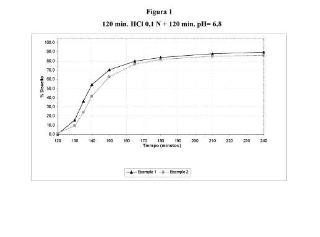
Figura 1: gráfico que muestra los perfiles de disolución de formulaciones que corresponden al ejemplo 1.
BREVE DESCRIPCIÓN DE LA INVENCIÓN
Todavía hay una necesidad en el estado de la técnica de preparar formulaciones entéricas de duloxetina con estabilidad mejorada con respecto a la degradación y que proporcionan una absorción mejor y más rápida de dicho principio activo. Además, sería deseable que este tipo de formulaciones se fabrique usando procedimientos sencillos y seguros.
Los inventores han desarrollado una formulación farmacéutica entérica de duloxetina que permite la disolución del principio activo duloxetina a un pH de aproximadamente 6, manteniendo su protección frente a la acidez. Esto es muy relevante, ya que la solubilidad de la duloxetina es superior a aproximadamente este pH que a cualquier otro valor de pH fisiológicamente aceptable. En consecuencia, cuando esta duloxetina altamente soluble llega al intestino delgado a dicho pH, se absorberá mejor y más rápidamente.
Las formulaciones farmacéuticas entéricas de duloxetina según la presente invención, que adoptan la forma de pellets, logran una ventaja inesperada con respecto a las formulaciones del estado de la técnica al incluir en la formulación del pellet una capa de recubrimiento entérico que comprende un polímero entérico diferente a acetato ftalato de polivinilo y una capa intermedia no porosa que actúa como barrera con el fin de detener la transferencia de protones desde el medio externo al núcleo.
Por tanto, según un aspecto, la presente invención se refiere a un pellet que comprende:
a) un núcleo que comprende duloxetina o una sal farmacéuticamente aceptable de la misma y excipientes farmacéuticamente aceptables, b) una capa intermedia no porosa que comprende uno o más polímeros solubles en agua formadores de película, c) una capa de recubrimiento entérico que comprende un polímero entérico diferente a acetato ftalato de polivinilo, y d) una capa de acabado opcional.
Un segundo aspecto de la invención es el uso de un pellet tal como se describió anteriormente para la fabricación de una forma farmacéutica de dosificación.
Un tercer aspecto de la invención es una forma farmacéutica de dosificación que comprende un pellet tal como se describió anteriormente.
Un cuarto aspecto de la invención es un procedimiento para la fabricación de un pellet tal como se describió anteriormente que comprende:
a) preparar un núcleo que comprende duloxetina o una sal farmacéuticamente aceptable de la misma, c) recubrir dicho núcleo con una capa intermedia no porosa que comprende uno o más polímeros solubles en agua formadores de película, y c) recubrir dicha capa intermedia con una capa de recubrimiento entérico que comprende un polímero entérico diferente a acetato ftalato de polivinilo.
El pellet de la invención muestra un perfil de disolución satisfactorio que se obtiene usando un polímero entérico y polímeros útiles para preparar la capa intermedia no porosa que puede encontrarse en el comercio y usarse sin tratamiento adicional.
Reivindicaciones:
1. Pellet que comprende: a) un núcleo que comprende duloxetina o una sal farmacéuticamente aceptable de la misma y excipientes farmacéuticamente aceptables, b) una capa intermedia no porosa que comprende uno o más polímeros solubles en agua formadores de película, c) una capa de recubrimiento entérico que comprende un polímero entérico
diferente a acetato ftalato de polivinilo, y d) una capa de acabado opcional.
2. Pellet según la reivindicación 1, en el que la sal farmacéutica de duloxetina es la sal de clorhidrato.
3. Pellet según cualquiera de las reivindicaciones 1 ó 2, en el que la capa intermedia no porosa comprende copovidona o polímero de alcohol de polivinilo como el polímero soluble en agua.
4. Pellet según cualquiera de las reivindicaciones 1 a 3, en el que el polímero soluble en agua de la capa intermedia está presente en una cantidad que oscila desde el 4 hasta el 9% en peso.
5. Pellet según cualquiera de las reivindicaciones 1 a 4, en el que la capa de recubrimiento entérico comprende copolímero de ácido metacrílico como el polímero entérico.
6. Pellet según cualquiera de las reivindicaciones 1 a 4, en el que la capa de recubrimiento entérico comprende además excipientes farmacéuticamente aceptables.
7. Pellet según la reivindicación 6, en el que uno de los excipientes es un plastificante.
8. Pellet según la reivindicación 7, en el que el plastificante es citrato de trietilo.
9. Pellet según la reivindicación 8, en el que el citrato de trietilo está presente en una cantidad que oscila desde el 0, 4 hasta el 3% en peso.
10. Uso de un pellet según cualquiera de las reivindicaciones 1 a 9 para fabricar una forma farmacéutica de dosificación.
11. Forma farmacéutica de dosificación que comprende un pellet según cualquiera de las reivindicaciones 1 a 9.
12. Forma farmacéutica de dosificación que comprende un pellet según cualquiera de las reivindicaciones 1 a 9, en la que la forma farmacéutica es un comprimido o una cápsula.
13. Procedimiento para fabricar un pellet según cualquiera de las reivindicaciones 1 a 9, que comprende: a) preparar un núcleo que comprende duloxetina o una sal farmacéuticamente aceptable de la misma, b) recubrir dicho núcleo con una capa intermedia no porosa que comprende uno o más polímeros solubles en agua formadores de película, y
c) recubrir dicha capa intermedia con una capa de recubrimiento entérico que comprende copolímero de ácido metacrílico como el polímero entérico.
14. Procedimiento según la reivindicación 13, que comprende además aplicar una capa de acabado tras realizar la etapa c) .
15. Procedimiento para fabricar un pellet según cualquiera de las reivindicaciones 13 ó 14, en el que la preparación del núcleo en la etapa a) comprende:
i) disolver duloxetina o una sal farmacéuticamente aceptable de la misma en agua, y ii) pulverizar la disolución obtenida en i) sobre una perla inerte, en el que, las etapas i) y ii) se llevan a cabo a una temperatura de entre 30º C y 50º C.
OFICINA ESPAÑOLA DE PATENTES Y MARCAS
Nº solicitud: 201130420
ESPAÑA
Fecha de presentación de la solicitud: 23.03.2011
Fecha de prioridad:
INFORME SOBRE EL ESTADO DE LA TECNICA
51 Int. Cl. : A61K9/50 (2006.01) A61K31/381 (2006.01)
DOCUMENTOS RELEVANTES
Categoría 56 Documentos citados Reivindicaciones afectadas X US 2009226517 A1 (VYAS VINITA UMASHANKAR et al.) 10.09.2009, 1-15 párrafos [0075]-[0083], [0092]-[0100]; ejemplos. X WO 2009001043 A2 (ARROW INT LTD et al.) 31.12.2008, 1-15 página 2, línea 6 - página 7, línea 31; ejemplo 1-8. X US 2006165776 A1 (SESHA RAMESH) 27.07.2006, 1-15 párrafos [0066]-[0069]; ejemplos; reivindicaciones 1, 7, 16. X WO 2008077939 A2 (LEK PHARMACEUTICALS et al.) 03.07.2008, 1-15 página 6, línea 20 - página 10, línea 20; ejemplos 1, 3, 5, 6. X WO 2008020286 A2 (TORRENT PHARMACEUTICALS LTD et al.) 21.02.2008, 1-15 página 3, línea 32 - página 5, línea 24; página 7, línea 19 - página 9, línea 27; ejemplos. X EP 0693282 A2 (LILLY CO ELI et al.) 24.01.1996, 1-15 página 2, línea 27 - página 6, línea 25; ejemplos. X US 2010040680 A1 (LAI FELIX et al.) 18.02.2010, 1-15 párrafos [0022]-[0044]; ejemplos. X ES 2309371 T3 (BOEHRINGER INGELHEIM INT) 16.12.2008, 1-15 ejemplo 3. Categoría de los documentos citados X: de particular relevancia Y: de particular relevancia combinado con otro/s de la misma categoría A: refleja el estado de la técnica O: referido a divulgación no escrita P: publicado entre la fecha de prioridad y la de presentación de la solicitud E: documento anterior, pero publicado después de la fecha de presentación de la solicitud El presente informe ha sido realizado • para todas las reivindicaciones • para las reivindicaciones nº : Fecha de realización del informe 14.03.2012 Examinador N. Vera Gutierrez Página 1/4INFORME DEL ESTADO DE LA TÉCNICA
Nº de solicitud: 201130420
Documentación mínima buscada (sistema de clasificación seguido de los símbolos de clasificación) A61K Bases de datos electrónicas consultadas durante la búsqueda (nombre de la base de datos y, si es posible, términos de búsqueda utilizados) INVENES, EPODOC
Informe del Estado de la Técnica Página 2/4
OPINIÓN ESCRITA
Nº de solicitud: 201130420
Fecha de Realización de la Opinión Escrita: 14.03.2012
Declaración
Novedad (Art. 6.1 LP 11/1986) Reivindicaciones Reivindicaciones 1-15 SI NO Actividad inventiva (Art. 8.1 LP11/1986) Reivindicaciones Reivindicaciones 1-15 SI NOSe considera que la solicitud cumple con el requisito de aplicación industrial. Este requisito fue evaluado durante la fase de examen formal y técnico de la solicitud (Artículo 31.2 Ley 11/1986) .
Base de la Opinión.
La presente opinión se ha realizado sobre la base de la solicitud de patente tal y como se publica.
Informe del Estado de la Técnica Página 3/4
OPINIÓN ESCRITA
Nº de solicitud: 201130420
1. Documentos considerados.
A continuación se relacionan los documentos pertenecientes al estado de la técnica tomados en consideración para la realización de esta opinión.
Documento Número Publicación o Identificación Fecha Publicación D01 US 2009226517 A1 10.09.2009 D02 WO 2009001043 A2 31.12.2008 D03 US 2006165776 A1 27.07.2006 D04 WO 2008077939 A2 03.07.2008 D05 WO 2008020286 A2 21.02.2008 D06 EP 0693282 A2 24.01.1996 D07 US 2010040680 A1 18.02.2010 D08 ES 2309371 T3 16.12.20082. Declaración motivada según los artículos 29.6 y 29.7 del Reglamento de ejecución de la Ley 11/1986, de 20 de marzo, de Patentes sobre la novedad y la actividad inventiva; citas y explicaciones en apoyo de esta declaración La invención se refiere a un pellet que comprende: a) un núcleo que comprende duloxetina o una sal farmacéuticamente aceptable y excipientes farmacéuticamente aceptables; b) una capa intermedia no porosa que comprende uno o más polímeros solubles en agua formadores de película; c) una capa de recubrimiento entérico que comprende un polímero entérico diferente a acetato ftalato de polivinilo, y d) una capa de acabado opcional.
El documento D01 divulga pellets que comprenden: a) un núcleo con duloxetina; b) una capa intermedia que comprende copovidona o hidroxipropilmetilcelulosa y c) una capa entérica que comprende ftalato de hidroxipropilmetilcelulosa o Eudragit (ejemplos 1-3, 5-6) . En el ejemplo 5 se aplica una capa de acabado sobre la capa entérica de los pellets.
El documento D02 divulga una formulación de duloxetina que comprende: a) un núcleo con hidrocloruro de duloxetina; b) una capa intermedia que comprende alcohol polivinílico e hidroxipropilmetilcelulosa y c) una capa entérica que comprende ftalato de hidroxipropilmetilcelulosa (ejemplos) .
En el documento D03 se describen composiciones farmacéuticas que comprenden: a) un núcleo inerte con duloxetina; b) una capa intermedia de hidroxipropilmetilcelulosa y c) una capa que comprende un copolímero de ácido metacrílico (ejemplos) . En el párrafo [0068] y en la reivindicación 16 se cita el alcohol polivinílico como polímero para la capa intermedia.
El documento D04 divulga una composición farmacéutica en forma de pellets que comprenden: a) un núcleo inerte con hidrocloruro de duloxetina; b) una capa intermedia que comprende hipromelosa y c) una capa entérica que comprende Eudragit L30 D-55 o ftalato de hidroxipropilmetilcelulosa (ejemplos 1, 3, 5, 6) . Los pellets se preparan pulverizando una solución de duloxetina sobre núcleos inertes (a una temperatura de 40º C) , los cuales son recubiertos a continuación con la capa intermedia y posteriormente con la capa entérica.
En el documento D05 se recogen composiciones de duloxetina en forma de pellets que comprenden: a) un núcleo inerte recubierto con hidrocloruro de duloxetina; b) una capa intermedia que comprende polímeros formadores de película, (hidroxipropilmetilcelulosa en ejemplos) y c) una capa entérica que comprende un copolímero de metacrilato-ácido metacrílico.
El documento D06 divulga pellets entéricos de duloxetina que comprenden: a) un núcleo con duloxetina; b) una capa intermedia con hidroxipropilmetilcelulosa, hidroxipropilcelulosa o polivinilpirrolidona; c) una capa entérica que comprende acetato succinato de hidroxipropilmetilcelulosa, y d) una capa de acabado (ejemplos) .
En el documento D07 se describe una composición farmacéutica multiparticulada que comprende: a) un núcleo con hidrocloruro de duloxetina; b) una capa intermedia con hipromelosa y c) una capa entérica con ftalato de hidroxipropilmetilcelulosa. Los pellets se preparan pulverizando una solución de hidrocloruro de duloxetina sobre núcleos de azúcar en lecho fluido a una temperatura entr.
2. 47º C. A continuación se recubren con la capa intermedia y posteriormente con la capa entérica (ejemplos) .
El documento D08 divulga una composición farmacéutica a base de un agonista de receptor adrenérgico beta-3 y un inhibidor de la reabsorción de serotonina y/o norepinefrina. En el ejemplo 3 se prepara una cápsula de gelatina dura rellena con pellets de duloxetina que comprenden: a) un núcleo inerte con hidrocloruro de duloxetina; b) una capa de separación con hidroxipropilmetilcelulosa y una capa entérica con acetato succinato de hidroxipropilmetilcelulosa.
En consecuencia, se considera que la invención recogida en las reivindicaciones 1-15 de la solicitud no cumple los requisitos de novedad y actividad inventiva (Artículos 6.1 y 8.1 L.P.) .
Informe del Estado de la Técnica Página 4/4
Patentes similares o relacionadas:
Composición que comprende hidrocortisona, del 22 de Julio de 2020, de Diurnal Limited: Una composición farmacéutica adaptada para administración oral que comprende: i) un portador que consiste esencialmente en partículas de celulosa microcristalina […]
Microesferas o micropartículas biodegradables o bioerosionables de liberación con el tiempo en suspensión en una formulación de fármaco inyectable de formación de depósito solidificante, del 8 de Julio de 2020, de ALLERGAN, INC.: Material compuesto para la administración de fármacos, que comprende: una pluralidad de micropartículas dispersas en una composición de medios; en el que las micropartículas […]
MATERIAL QUE INCORPORA VITAMINA D PARA SU POSTERIOR LIBERACIÓN Y MÉTODO PARA OBTENER DICHO MATERIAL, del 2 de Julio de 2020, de UNIVERSIDAD DE SANTIAGO DE CHILE: La presente invención se relaciona al campo de los materiales, más en específico al tratamiento de materiales para la liberación de compuestos activos […]
Composiciones y métodos no hormonales para la anticoncepción masculina que comprenden (R)-Silodosina, del 1 de Julio de 2020, de Laboratoires Major: Composición para su uso en un método anticonceptivo no hormonal para un sujeto masculino, en la que dicha composición es una formulación de liberación prolongada […]
Sales de butirato para uso en enfermedades inflamatorias, del 17 de Junio de 2020, de Birrbeheer B.V: Una preparación que comprende una sal de butirato para uso en el tratamiento de un sujeto que padece una enfermedad que está asociada con inflamación sistémica, […]
Composiciones de polifenol, del 3 de Junio de 2020, de Nugerontix Limited: Enoteína B para uso en terapia para tratar, prevenir o retrasar la aparición de disfunción endotelial donde el tratamiento, prevención o retraso comprende […]
Formulaciones de ganaxolona y procedimientos para la preparación y uso de las mismas, del 3 de Junio de 2020, de Marinus Pharmaceuticals, Inc: Una composición que comprende partículas que comprenden ganaxolona; un polímero hidrófilo; un agente humectante; y un agente complejante, en la que el diámetro medio ponderado […]
Sistema para dirigir agentes hacia dentro de un ojo, del 3 de Junio de 2020, de UNIVERSITY OF MARYLAND: Un sistema para dirigir un agente hacia el interior o a traves de un tejido, que comprende: (a) un agente que es magnetico o magnetizable o que responde magneticamente; […]