Parche transdérmico de buprenorfina para ser usado en el tratamiento del dolor para un intervalo de dosificación de por lo menos 4 días.
Sistema de administración transdérmica de buprenorfina que comprende una capa de matriz polimérica que incluye buprenorfina o una sal farmacéuticamente aceptable de la misma y una capa de refuerzo realizada con un material farmacéuticamente aceptable que es impermeable a la buprenorfina,
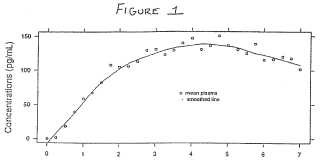
en donde el sistema de administración transdérmica comprende un 10% en peso de base de buprenorfina, entre un 10 y un 15% en peso de ácido levulínico, aproximadamente un 10% en peso de oleiloleato, entre un 55 y un 70% en peso de poliacrilato y entre un 0 y un 10% en peso de polivinilpirrolidona, para su uso en el tratamiento del dolor en un paciente humano durante un intervalo de dosificación de por lo menos 4 días, en donde dicho sistema de administración transdérmica proporciona durante el intervalo de dosificación de aproximadamente 72 horas una velocidad de liberación de buprenorfina tal que se logra una concentración plasmática máxima de entre 20 pg/ml y 850 pg/ml, y el sistema de administración transdérmica, cuando se mantiene sobre la piel del paciente durante el intervalo de dosificación de por lo menos 24 horas adicionales, proporciona concentraciones plasmáticas de buprenorfina en los pacientes por encima de las concentraciones efectivas mínimas de la buprenorfina, de tal modo que los pacientes continúan experimentando una gestión eficaz del dolor durante este intervalo de dosificación adicional.
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E05011213.
Solicitante: EURO-CELTIQUE S.A..
Nacionalidad solicitante: Luxemburgo.
Dirección: 2, AVENUE CHARLES DE GAULLE 1653 LUXEMBOURG LUXEMBURGO.
Inventor/es: REDER, ROBERT, F., GOLDENHEIM, PAUL, D., KAIKO, ROBERT, F..
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61F13/00 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61F FILTROS IMPLANTABLES EN LOS VASOS SANGUINEOS; PROTESIS; DISPOSITIVOS QUE MANTIENEN LA LUZ O QUE EVITAN EL COLAPSO DE ESTRUCTURAS TUBULARES, p. ej. STENTS; DISPOSITIVOS DE ORTOPEDIA, CURA O PARA LA CONTRACEPCION; FOMENTACION; TRATAMIENTO O PROTECCION DE OJOS Y OIDOS; VENDAJES, APOSITOS O COMPRESAS ABSORBENTES; BOTIQUINES DE PRIMEROS AUXILIOS (prótesis dentales A61C). › Vendas o apósitos (suspensorios A61F 5/40; apósitos radiactivos A61M 36/14 ); Compresas absorbentes (aspectos químicos de las vendas, apósitos o compresas absorbentes* A61L 15/00, A61L 26/00).
- A61K31/00 A61 […] › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › Preparaciones medicinales que contienen ingredientes orgánicos activos.
- A61K31/485 A61K […] › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › Derivados del morfinano, p. ej. morfina, codeína.
- A61K9/22 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › del tipo de liberación prolongada o discontinua.
- A61K9/70 A61K 9/00 […] › Bases para tiras, hojas o filamentos.
- A61P25/00 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Medicamentos para el tratamiento de trastornos del sistema nervioso.
- A61P25/04 A61P […] › A61P 25/00 Medicamentos para el tratamiento de trastornos del sistema nervioso. › Analgésicos que actúan sobre el sistema nervioso central, p.ej. opioides.
- A61P29/00 A61P […] › Agentes analgésicos, antipiréticos o antiinflamatorios que no actúan sobre el sistema nervioso central, p. ej. agentes antirreumáticos; Antiinflamatorios no esteroideos (AINEs).
PDF original: ES-2380023_T3.pdf
Fragmento de la descripción:
Parche transdérmico de buprenorfina para ser usado en el tratamiento del dolor para un intervalo de dosificación de por lo menos 4 días Campo de la invención [0001] La presente invención se refiere al uso de un medicamento farmacéutico para tratar con buprenorfina pacientes con dolor, el cual consigue una gestión prolongada y eficaz del dolor.
Antecedentes de la invención [0002] El propósito de todas las preparaciones farmacéuticas de liberación sostenida es proporcionar un periodo de efecto farmacológico, después de la administración de un fármaco, más duradero que el experimentado comúnmente después de la administración de preparaciones de liberación inmediata del mismo fármaco. Estos periodos de eficacia más duraderos pueden proporcionar muchas ventajas terapéuticas inherentes que no se alcanzan con las correspondientes preparaciones de liberación inmediata. Las ventajas de la analgesia prolongada que alcanzan las preparaciones analgésicas orales de liberación sostenida han llegado a ser reconocidas universalmente y hay disponibles comercialmente preparaciones de liberación sostenida de analgésicos opioides.
La analgesia prolongada es particularmente deseable en pacientes que padecen un dolor entre moderado y severo, tales como pacientes con cáncer. Las preparaciones orales disponibles proporcionan una duración del efecto que se prolonga, por ejemplo, aproximadamente doce horas (y en ocasiones 24 horas) de tal manera que puede que a un paciente solamente se le tenga que administrar un fármaco entre una y tres veces por día. Por ejemplo, la morfina, la cual se ha considerado como el analgésico opioide prototípico, se ha formulado en formulaciones orales de liberación controlada, de dos veces al día (por ejemplo, los comprimidos de MS Contin®, disponibles comercialmente en The Purdue Frederick Company) .
Otro de los planteamientos para la administración sostenida de un agente terapéuticamente activo consiste en los dispositivos de administración transdérmica, tales como los parches transdérmicos. En general, los parches transdérmicos contienen un agente terapéuticamente activo (por ejemplo, un analgésico opioide) , un reservorio o matriz que contiene el opioide u otro (s) ingrediente (s) activo (s) y un adhesivo que permite pegar a la piel el dispositivo transdérmico, permitiendo el paso del agente activo desde el dispositivo a través de la piel del paciente. Una vez que el agente activo ha penetrado en la capa de piel, el fármaco es absorbido en la corriente sanguínea en la que puede ejercer un efecto farmacoterapéutico deseado, tal como la analgesia.
Se han contemplado dispositivos de administración transdérmica en los cuales el ingrediente activo es un analgésico opioide. Por ejemplo, una de las formulaciones transdérmicas analgésicas opioides comercialmente disponibles es el Duragesic® (disponible comercialmente en Janssen Pharmaceutical; el ingrediente activo es el fentanilo) . Se dice que el parche de Duragesic® proporciona una analgesia adecuada de hasta entre 48 y 72 horas (entre 2 y 3 días) .
Para obtener una analgesia prolongada también se ha contemplado la buprenorfina, un opiáceo parcialmente sintético. Aunque en la bibliografía se dispone de informes sobre otros tipos de formulaciones transdérmicas analgésicas opioides (tales como el fentanilo, mencionado anteriormente) , los dispositivos de administración transdérmica de buprenorfina tienen un interés específico ya que la buprenorfina es un potente analgésico opioide agonista parcial con unas propiedades terapéuticas deseables. Por ejemplo, la buprenorfina es entre 50 y 100 veces más potente que la morfina, aunque tiene un índice terapéutico mucho más seguro que la morfina (véase Crossover Trials in Clinical Analgesic Assays: Studies of Buprenorphine and Morphine, Pharmacotherapy, G (5) : 225-235, 1986, de Wallenstein SL, et al.) . Además, las propiedades de agonista parcial de la buprenorfina son útiles en el tratamiento de la adicción a los opioides.
Existen varios tipos de formulaciones transdérmicas de buprenorfina de las cuales se dispone de informes en la bibliografía. Véase, por ejemplo, la patente U.S. nº 5.240.711 (Hille et al.) , la patente U.S. nº 5.225.199 (Hidaka et al.) , la patente U.S. nº 5.069.909 (Sharma et al.) , la patente U.S. nº 4.806.341 (Chien et al.) , y la patente U.S. nº 5.026.556 (Drust et al.) .
La buprenorfina tiene una baja biodisponibilidad oral y ha sido considerada por algunos de los expertos en la materia como similar a otros narcóticos que crean hábito (véase, por ejemplo, la patente U.S. nº 5.240.711 de Hille, et al.) e inducen tolerancia (véase, por ejemplo, la patente U.S. nº 5.613.958 de Konchinke, et al.) . Tal como se publica en el documento de Hille, et al., los expertos son de la opinión de que la forma de administración de un fármaco medicinal contribuye al riesgo de adicción, y unos niveles sanguíneos más altos de lo necesario creados inmediatamente después de la administración de un fármaco tal como la buprenorfina, seguida por una reducción drástica (que provoca sucesivamente euforia y a continuación un tratamiento ineficaz del dolor) , provocan que el paciente comience a echar 2 10
EP 1570823
de menos la siguiente dosificación (a lo cual se hace referencia como adicción "iatrogénica") . En el caso de la buprenorfina, Hille, et al. publicaron que la infusión continua se consideraría el modo más adecuado de evitar dicha adicción iatrogénica proporcionando niveles sanguíneos constantes; no obstante, una infusión continua requiere un control médico y la inserción de una cánula (lo cual puede provocar inflamación en el sitio) . Este problema se considera superado por Hille, et al., gracias al uso de su dispositivo de administración transdérmica el cual incluye buprenorfina o una de sus sales farmacéuticamente compatibles y el cual libera el fármaco durante un periodo de por lo menos 24 horas de una forma controlada, y garantiza que la buprenorfina no se descompone de manera importante cuando el dispositivo de administración transdérmica se almacena, y el cual garantiza además que la buprenorfina in vivo penetra a través de la piel en la cantidad requerida.
Kochinke et al. describen un dispositivo transdérmico para la administración modulada de fármacos inductores de tolerancia. En dicho documento la buprenorfina se identifica como uno de estos fármacos. El dispositivo está diseñado para administrar el fármaco a través de la piel del paciente por medio de un perfil de administración del fármaco de tres fases. En la primera fase, la cual comienza con la aplicación del parche y finaliza entre 2 y 10 horas después de la aplicación de dicho parche, se obtienen los niveles plasmáticos del fármaco. Esta fase viene seguida por una segunda fase en la cual se mantienen los niveles plasmáticos terapéuticos del fármaco. La segunda fase comienza aproximadamente entre dos y diez horas después de la aplicación del parche y finaliza aproximadamente entre 8 y 18 horas después de la aplicación del parche. En una tercera fase, se mantienen niveles subterapéuticos del fármaco, a través de un diseño inherente del parche y/o la retirada del mismo. Los fundamentos que subyacen tras el perfil de administración de fármacos de Kochinke et al. , es que los niveles sanguíneos elevados iniciales pueden resultar más eficaces cuando vienen seguidos por un periodo de reducción de la dosificación (bajando hasta niveles subterapéuticos) , que si los niveles sanguíneos se mantienen en el nivel bien superior o bien inferior (es decir, niveles subterapéuticos) durante todo el periodo de administración. Gracias a este perfil modulado, se dice que se puede evitar o reducir considerablemente el comienzo de la tolerancia al fármaco que se está administrando.
A pesar de estos avances en la materia, sigue existiendo la necesidad de métodos de tratamiento de pacientes con buprenorfina que proporcionen niveles analgésicos eficaces de buprenorfina durante periodos de tiempo prolongados y al mismo tiempo que eliminen o minimicen la dependencia, la tolerancia, y los efectos secundarios, proporcionando de este modo un método seguro y eficaz de gestión del dolor. Además, sigue existiendo la necesidad de una formulación transdérmica de un analgésico opioide, preferentemente, buprenorfina, que proporcione niveles analgésicos eficaces de buprenorfina durante periodos de tiempo más allá de los contemplados o llevados a la práctica en la técnica anterior, y que al mismo tiempo elimine o minimice la dependencia, la tolerancia,... [Seguir leyendo]
Reivindicaciones:
1. Sistema de administración transdérmica de buprenorfina que comprende una capa de matriz polimérica que incluye buprenorfina o una sal farmacéuticamente aceptable de la misma y una capa de refuerzo realizada con un 5 material farmacéuticamente aceptable que es impermeable a la buprenorfina, en donde el sistema de administración transdérmica comprende un 10% en peso de base de buprenorfina, entre un 10 y un 15% en peso de ácido levulínico, aproximadamente un 10% en peso de oleiloleato, entre un 55 y un 70% en peso de poliacrilato y entre un 0 y un 10% en peso de polivinilpirrolidona, para su uso en el tratamiento del dolor en un paciente humano durante un intervalo de dosificación de por lo menos 4 días, en donde dicho sistema de administración 10 transdérmica proporciona durante el intervalo de dosificación de aproximadamente 72 horas una velocidad de liberación de buprenorfina tal que se logra una concentración plasmática máxima de entre 20 pg/ml y 850 pg/ml, y el sistema de administración transdérmica, cuando se mantiene sobre la piel del paciente durante el intervalo de dosificación de por lo menos 24 horas adicionales, proporciona concentraciones plasmáticas de buprenorfina en los pacientes por encima de las concentraciones efectivas mínimas de la buprenorfina, de tal modo que los pacientes continúan experimentando una gestión eficaz del dolor durante este intervalo de dosificación adicional.
2. Sistema de administración transdérmica de buprenorfina según la reivindicación 1, en el que las velocidades de liberación relativas medias logradas durante el intervalo de dosificación son las siguientes:
una velocidad de liberación relativa media de entre 3 μg/hora y 5 μg/hora desde el inicio del intervalo de dosificación hasta 72 horas después del inicio del intervalo de dosificación, y una velocidad de liberación relativa media de entre 0, 3 μg/hora y 0, 6 μg/hora desde 72 horas después del inicio del intervalo de dosificación hasta el final del intervalo de dosificación.
3. Sistema de administración transdérmica de buprenorfina según la reivindicación 1, en el que las velocidades de liberación relativas medias logradas durante el intervalo de dosificación son las siguientes:
una velocidad de liberación relativa media de entre 6 μg/hora y 11 μg/hora desde el inicio del intervalo de dosificación hasta 72 horas después del inicio del intervalo de dosificación, y 30 una velocidad de liberación relativa media de entre 0, 7 μg/hora y 1 μg/hora desde 72 horas después del inicio del intervalo de dosificación hasta el final del intervalo de dosificación.
4. Sistema de administración transdérmica de buprenorfina según la reivindicación 1, en el que las velocidades de liberación relativas medias logradas durante el intervalo de dosificación son las siguientes:
una velocidad de liberación relativa media de entre 13 μg/hora y 21 μg/hora desde el inicio del intervalo de dosificación hasta 72 horas después del inicio del intervalo de dosificación, y una velocidad de liberación relativa media de entre 1 μg/hora y 2 μg/hora desde 72 horas después del inicio del intervalo de dosificación hasta el final del intervalo de dosificación.
5. Sistema de administración transdérmica de buprenorfina según la reivindicación 1, en el que las velocidades de liberación relativas medias logradas durante el intervalo de dosificación son las siguientes:
una velocidad de liberación relativa media de entre 26 μg/hora y 43 μg/hora desde el inicio del intervalo de 45 dosificación hasta 72 horas después del inicio del intervalo de dosificación, y una velocidad de liberación relativa media de entre 3 μg/hora y 4 μg/hora desde 72 horas después del inicio del intervalo de dosificación hasta el final del intervalo de dosificación.
6. Sistema de administración transdérmica de buprenorfina según la reivindicación 1, en el que las velocidades de 50 liberación relativas medias logradas durante el intervalo de dosificación son las siguientes:
una velocidad de liberación relativa media de entre 39 μg/hora y 64 μg/hora desde el inicio del intervalo de dosificación hasta 72 horas después del inicio del intervalo de dosificación, y una velocidad de liberación relativa media de entre 4 μg/hora y 7 μg/hora desde 72 horas después del inicio 55 del intervalo de dosificación hasta el final del intervalo de dosificación.
7. Sistema de administración transdérmica de buprenorfina según la reivindicación 1, en el que las velocidades de liberación relativas medias logradas durante el intervalo de dosificación son las siguientes:
60 una velocidad de liberación relativa media de entre 51 μg/hora y 86 μg/hora desde el inicio del intervalo de dosificación hasta 72 horas después del inicio del intervalo de dosificación, y una velocidad de liberación relativa media de entre 5 μg/hora y 9 μg/hora desde 72 horas después del inicio del intervalo de dosificación hasta el final del intervalo de dosificación.
EP 1570823
8. Sistema de administración transdérmica de buprenorfina según la reivindicación 1, en el que el Tmax se produce entre 3 y 5 días después de la aplicación de dicho sistema de administración transdérmica.
9. Sistema de administración transdérmica de buprenorfina según la reivindicación 1, en el que al final del intervalo de dosificación, en el sistema de administración transdérmica queda entre el 68% y el 95% de la buprenorfina.
EP 1570823
EP 1570823
EP 1570823
EP 1570823
EP 1570823
Patentes similares o relacionadas:
Uso de inhibidores de la PDE4 para la profilaxis y/o la terapia de la dislipoproteinemia y trastornos relacionados, del 27 de Mayo de 2020, de Albert-Ludwigs-Universität Freiburg: Inhibidor específico de la fosfodiesterasa 4 (PDE 4) para uso en el tratamiento profiláctico o terapéutico de la dislipoproteinemia, en donde el inhibidor […]
Métodos y composiciones para trastornos relacionados con la proliferación celular, del 27 de Mayo de 2020, de Agios Pharmaceuticals, Inc: Un método in vitro para diagnosticar a un sujeto que tiene un trastorno relacionado con la proliferación celular o que se sospecha que tiene un trastorno relacionado con […]
Un canal catiónico no selectivo en células neurales y compuestos que bloquean el canal para su uso en el tratamiento de la inflamación del cerebro, del 6 de Mayo de 2020, de UNIVERSITY OF MARYLAND, BALTIMORE: Un antagonista de SUR1 que bloquea el canal de NCCa-ATP para su uso en (a) la prevención o el tratamiento de la inflamación de las células neurales […]
Inhibidores de ERK y sus usos, del 8 de Abril de 2020, de Celgene CAR LLC: Un compuesto de fórmula VIII: **(Ver fórmula)** o una de sus sales farmacéuticamente aceptables, en donde: el anillo A se selecciona de **(Ver fórmula)** […]
Procedimiento de uso de inmunoconjugados anti-CD79b, del 8 de Abril de 2020, de F. HOFFMANN-LA ROCHE AG: Un inmunoconjugado que comprende un anticuerpo anti-CD79b unido a un agente citotóxico para su uso en un procedimiento para tratar un trastorno proliferativo […]
IMIPRAMINA PARA USO COMO INHIBIDOR DE LA SOBREXPRESIÓN DE LA FASCINA 1, del 2 de Abril de 2020, de FUNDACION UNIVERSITARIA SAN ANTONIO: La presente invención se refiere a imipramina para su uso como inhibidor de la sobreexpresión de la fascina 1, preferiblemente dicha sobreexpresión de la fascina 1 está asociada […]
Mutación novedosa del receptor de andrógenos, del 25 de Marzo de 2020, de NOVARTIS AG: Una composicion terapeutica para su uso en el tratamiento de un paciente que padece cancer de prostata o de mama, asociado con una mutacion del receptor de […]
Composiciones y métodos para la distribución de moléculas en células vivas, del 25 de Marzo de 2020, de THE TEXAS A & M UNIVERSITY SYSTEM: Un compuesto que tiene la fórmula: **(Ver fórmula)** En donde X es un resto de unión, Y es un residuo de aminoácido acoplado de forma covalente […]