Modelos de cáncer quimérico.
Procedimiento para preparar un modelo de cáncer de ratón quimérico que comprende:
a) proporcionar una célula ES de ratón que comprende una mutación que suprime o inactiva un gensupresor de tumores,
b) transfectar la célula ES con
(i) un primer vector que comprende un oncogén recombinante unido operativamente a un promotorinducible que incluye un elemento de respuesta cuya actividad depende de un transactivador, y
(ii) un segundo vector que codifica el gen transactivador unido operativamente a un promotor específicode tejido,
c) inyectar la célula ES en un embrión de ratón, y
d) transferir el embrión a una madre sustituta de ratón.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2004/028098.
Solicitante: AVEO PHARMACEUTICALS, INC.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 75 SIDNEY STREET, 4TH FLOOR CAMBRIDGE, MA 02139 ESTADOS UNIDOS DE AMERICA.
Inventor/es: ROBINSON, MURRAY, O., CLARK, STEVEN, C., DEPINHO,RONALD,A, HEYER,JOERG, RIDEOUT,WILLIAM III, ZHOU,YINGHUI, JACKS,TYLER, O\'\'HAGAN,RONAN.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A01K67/027 NECESIDADES CORRIENTES DE LA VIDA. › A01 AGRICULTURA; SILVICULTURA; CRIA; CAZA; CAPTURA; PESCA. › A01K CRÍA DE ANIMALES; AVICULTURA; APICULTURA; PISCICULTURA; PESCA; ANIMALES PARA CRIA O REPRODUCCIÓN, NO PREVISTOS EN OTRO LUGAR; NUEVAS VARIEDADES DE ANIMALES. › A01K 67/00 Cría u obtención de animales, no prevista en otro lugar; Nuevas razas de animales. › Nuevas razas de vertebrados.
- C07K14/47 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › de mamíferos.
- C07K14/82 C07K 14/00 […] › Productos de traducción de oncogenes.
- C12N15/63 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Introducción de material genético extraño utilizando vectores; Vectores; Utilización de huéspedes para ello; Regulación de la expresión.
- C12N5/10 C12N […] › C12N 5/00 Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00). › Células modificadas por introducción de material genético extraño, p. ej. células transformadas por virus.
PDF original: ES-2390076_T3.pdf
Fragmento de la descripción:
Modelos quiméricos de cáncer
Antecedentes de la invención
Las tecnologías transgénicas y de knockout han hecho posible la simulación de mutaciones genéticas humanas en animales de laboratorio tales como ratones. Sin embargo, es un procedimiento que consume tiempo generar modelos de enfermedad complejos que contengan múltiples mutaciones genéticas debido a la necesidad de
emparejar diversas cepas animales para obtener las combinaciones de alelos deseadas en un animal no humano. Existe la necesidad de producción rápida de animales no humanos que alberguen múltiples mutaciones genéticas en un número sustancial de sus células y de este modo que sean propensos a enfermedades tales como cáncer.
Descripción resumida de la invención
Se ha descubierto que es posible realizar más de dos alteraciones genéticas en una célula madre embrionaria de mamífero no humano (ES) manteniendo a la vez la pluripotencialidad de la célula ES. Además, se ha descubierto que cuando se inyectan células madre embrionarias no humanas que contienen un oncogén recombinante en un embrión no humano de etapa temprana, el mamífero no humano quimérico resultante es un modelo de cáncer in
vivo útil. Tales animales no humanos quiméricos proporcionan ciertas ventajas frente a animales transgénicos no humanos convencionales que contienen la misma o las mismas modificaciones genéticas presentes en las células modificadas genéticamente de dicho animal quimérico.
La invención proporciona un método para preparar un modelo de cáncer de ratón quimérico, que comprende:25 a) proporcionar una célula ES de ratón que comprende una mutación que suprime o inactiva un gen supresor de tumores, b) transfectar la célula ES con
(i) un primer vector que comprende un oncogén recombinante unido operativamente a un promotor 30 inducible que incluye un elemento de respuesta cuya actividad depende de un transactivador, y
(ii) un segundo vector que codifica el gen transactivador unido operativamente a un promotor específico
de tejido, c) inyectar la célula ES en un embrión de ratón, y d) transferir el embrión a una madre sustituta de ratón.
Se describe en la presente memoria un mamífero no humano quimérico, algunas de cuyas células, pero no todas de cuyas células, contienen un oncogén recombinante. El oncogén recombinante, por ejemplo, un oncogén activado, se une operativamente a un promotor inducible. Las células que contienen un oncogén recombinante también contienen una mutación genética que provoca que el mamífero no humano tenga mayor susceptibilidad a cáncer que un
mamífero no humano que no contiene la mutación genética. El mamífero no humano es un ratón.
Los ejemplos de oncogenes recombinantes útiles en el método de la invención incluyen HER2, K-RS y EGFR. La mutación genética útil para provocar que el ratón tenga una susceptibilidad aumentada a cáncer es una mutación que suprime o inactiva un gen supresor de tumores. Los ejemplos de genes supresores de tumores que pueden
45 suprimirse o inactivarse en el método de la invención son Ink4a, P53 y PTEN. De acuerdo con a invención, el promotor inducible incluye un elemento de respuesta cuya actividad depende de un transactivador codificado por un gen transactivador unido operativamente a un promotor específico de tejido. Un ejemplo de un promotor inducible tal es un promotor TetO (operador de tetraciclina) .
50 También se describe en la presente memoria una célula ES murina que contiene un genoma que comprende un oncogén recombinante unido operativamente a un promotor inducible; y una mutación genética que provoca que un ratón que contiene células que descienden de la célula ES tenga mayor susceptibilidad a cáncer que un ratón que no contiene células que descienden de la célula ES. La célula ES es una célula ES de ratón.
55 Se describe en la presente memoria un método para obtener un mamífero no humano quimérico, algunas de cuyas células, pero no todas de cuyas células, contienen un genoma que comprende: (a) un oncogén recombinante unido operativamente a un promotor inducible, y (b) una mutación genética que provoca que el mamífero tenga mayor susceptibilidad a cáncer que un mamífero que no contiene la mutación genética. El método de acuerdo con la invención incluye: (a) proporcionar una célula ES de ratón que contiene un genoma que comprende un oncogén
60 recombinante unido operativamente a un promotor inducible; y una mutación genética que provoca que un ratón que contiene células que descienden de la célula ES tenga mayor susceptibilidad a cáncer que un ratón que no contiene células que descienden de la célula ES; (b) introducir la célula ES en un embrión de ratón hospedador, por ejemplo por inyección, produciendo de este modo un embrión manipulado y (c) implantar el embrión manipulado en una madre sustituta.
A no ser que se defina de otro modo, todos los términos técnicos y científicos usados en la presente memoria tienen
el mismo significado que se entiende habitualmente por un experto habitual en la materia a la que pertenece la presente invención. Se describen posteriormente métodos y materiales ilustrativos, aunque también pueden usarse métodos y materiales similares o equivalentes a los descritos en al presente memoria en la práctica o ensayo de la presente invención. Los materiales, métodos y ejemplos son solamente ilustrativos y no pretenden ser limitantes. En toda la presente memoria descriptiva y reivindicaciones, se entenderá que la palabra “comprender” o variaciones
tales como “comprende” o “que comprende” implican la inclusión de un número entero indicado o grupo de números enteros pero no la exclusión de cualquier otro número entero o grupo de números enteros. Otras características y ventajas de la invención se describen en la siguiente descripción detallada.
Breve descripción de los dibujos
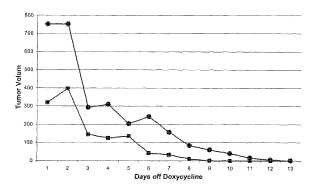
La Figura 1 es un gráfico de datos que muestran la regresión de dos tumores de un ratón de modelo Her2 de mama (ratón Nº 259) después de retirada de doxiciclina del agua para beber. Los cuadrados representan el tumor que surge en la cuarta glándula mamaria izquierda. Los círculos representan el tumor que surge en la cuarta glándula mamaria derecha. El ratón ha estado tomando doxiciclina durante 6 semanas. El día 1 representa la primera
medición de los tumores. Después de medir el tamaño del tumor, se retiró doxiciclina del agua para beber. Los tumores se midieron cada día durante 2 semanas. La retirada de doxiciclina dio como resultado regresión completa de los tumores.
La Figura 2 es un gráfico de datos que muestra la regresión de dos tumores de un ratón de modelo Her2 de mama
(ratón Nº 331) después de retirada de doxiciclina del agua para beber. Los cuadrados representan el tumor que surgió en la cuarta glándula mamaria derecha. Los círculos representan el tumor que surgió en la cuarta glándula mamaria izquierda. El ratón estuvo tomando doxiciclina durante 7 semanas. El día 1 representa la primera medición de los tumores. El día 7, después de medir el tamaño del tumor, se retiró doxiciclina del agua. Los tumores se midieron cada día durante 23 días. La retirada de doxiciclina dio como resultado regresión completa de un tumor y la
regresión casi completa del otro tumor durante el periodo de estudio.
Descripción detallada de la invención
Se describen en la presente memoria métodos para estudiar el papel de una proteína dada en el desarrollo de
enfermedad (por ejemplo, desarrollo de tumores) , la oncogenicidad dependiente de contexto de una mutación genética, la toxicidad de una proteína dada en el desarrollo de órganos (incluyendo supervivencia) . Las células útiles en estos métodos son, por ejemplo, células ES no humanas que tienen más de dos (por ejemplo, tres, cuatro, cinco, seis, siete u ocho) alteraciones genéticas recombinantes (es decir, de origen no natural) en sus genomas. También se describe en la presente memoria un mamífero no humano quimérico algunas de cuyas células difieren
genéticamente de otras células en el mamífero y derivan de tales células ES. Este animal no humano se produce a partir de un embrión... [Seguir leyendo]
Reivindicaciones:
1. Procedimiento para preparar un modelo de cáncer de ratón quimérico que comprende:
a) proporcionar una célula ES de ratón que comprende una mutación que suprime o inactiva un gen supresor de tumores, b) transfectar la célula ES con
(i) un primer vector que comprende un oncogén recombinante unido operativamente a un promotor inducible que incluye un elemento de respuesta cuya actividad depende de un transactivador, y10 (ii) un segundo vector que codifica el gen transactivador unido operativamente a un promotor específico
de tejido, c) inyectar la célula ES en un embrión de ratón, y d) transferir el embrión a una madre sustituta de ratón.
15 2. El procedimiento de la reivindicación 1, en el que el oncogén recombinante se selecciona del grupo que consiste en K-RAS, H-RAS, N-RAS, EGFR, MDM2, RhoC, AKT1, AKT2, c-myc, n-myc, !-catenina, PDGF, C-MET, PI3K-CA, CDK4, ciclina B1, ciclina D1, gen del receptor de estrógenos, gen del receptor de progesterona, Her2, ErbB1, ErbB3, ErbB4, TGF∀, TGF-!, ras-GAP, Shc, Nck, Src, Yes, Fyn, Wnt, Bcl2 PyV MT, y SV40 LT.
20 3. El procedimiento de la reivindicación 2, en el que el oncogén recombinante es HER2, K-RAS o EGFR.
4. El procedimiento de cualquiera de las reivindicaciones precedentes, en el que la mutación implica un par de alelos nulos supresores de tumores seleccionados del grupo que consiste en Rb, P53, INK4a, PTEN, LATS, Apaf1, Caspasa 8, APC, DPC4, KLF6, GSTP1, ELAC2/HPC2 o NKX3.1, ATM, CHK2, ATR, BRCA1, BRAC2, MSH2, MSH6,
PMS2, Ku70, Ku80, DNA/PK, XRCC4 o MLH1, NF1, NF2, APC, WT, Patched y FHIT.
5. El procedimiento de la reivindicación 4, en el que el par de alelos nulos supresores de tumor es un par de alelos nulos Ink4a.
6. El procedimiento de cualquiera de las reivindicaciones precedentes, en el que el promotor inducible es un promotor de Tet-O.
7. El procedimiento de cualquiera de las reivindicaciones precedentes, en el que el gen transactivador unido operativamente a un promotor específico de tejido es MMTV-rtTA o CCSP-rtTA.
REFERENCIAS CITADAS EN LA DESCRIPCIÓN
Esta lista de referencias citadas por el solicitante es únicamente para la comodidad del lector. No forma parte del documento de la patente europea. A pesar del cuidado tenido en la recopilación de las referencias, no se pueden5 excluir errores u omisiones y la EPO niega toda responsabilidad en este sentido.
Documentos de patentes citados en la descripción
Literatura diferente de patentes citadas en la descripción
Patentes similares o relacionadas:
Método y medios para purificar vectores retrovíricos, del 29 de Julio de 2020, de Autolus Limited: Una célula productora de retrovirus que expresa una proteína de marcaje en la superficie celular, de tal manera que los vectores retrovíricos producidos por la célula se […]
Biblioteca de péptidos y su uso, del 8 de Julio de 2020, de DAIICHI SANKYO COMPANY, LIMITED: Una biblioteca de péptidos que comprende una pluralidad de péptidos diferentes en la que los péptidos comprenden cada uno una secuencia de aminoácidos […]
Marcador de células endoteliales corneales, del 17 de Junio de 2020, de OSAKA UNIVERSITY: Método para producir una célula endotelial corneal, comprendiendo el método la etapa de clasificar, a partir de una población celular que comprende una célula […]
Vectores de AAV dirigidos a oligodendrocitos, del 10 de Junio de 2020, de THE UNIVERSITY OF NORTH CAROLINA AT CHAPEL HILL: Un ácido nucleico que codifica una cápside de AAV, comprendiendo el ácido nucleico una secuencia codificante de la cápside de AAV que es al menos el 96 % idéntica […]
Anticuerpo contra péptido codificado por exón-21 de periostina y composición farmacéutica para prevenir o tratar enfermedades asociadas a inflamación que contienen el mismo, del 6 de Mayo de 2020, de OSAKA UNIVERSITY: Anticuerpo que se une a uno o más péptidos seleccionados del grupo que consiste en un péptido codificado por el exón-21 de periostina que […]
Reconocimiento de unión a diana celular mediante un agente bioactivo usando transferencia de energía de resonancia de bioluminiscencia intracelular, del 6 de Mayo de 2020, de PROMEGA CORPORATION: Un sistema de ensayo que comprende: (a) una biblioteca de agentes bioactivos, cada uno de los cuales está fijado a un fluoróforo; (b) una diana celular fusionada a […]
Combinación de dos elementos genéticos para el control del desarrollo del tipo floral de una planta dicotiledónea, y utilización en procedimientos de detección y selección, del 1 de Abril de 2020, de Institut national de recherche pour l'agriculture, l'alimentation et l'environnement: Utilización de una combinación de dos elementos genéticos para el control del desarrollo del tipo floral de una planta dicotiledónea, comprendiendo dicha combinación, respectivamente: […]
Producción de proteínas en medios de cultivo celular libres de glutamina, del 25 de Marzo de 2020, de F. HOFFMANN-LA ROCHE AG: Un procedimiento para producir un polipéptido en una célula huésped de mamífero que expresa dicho polipéptido, que comprende cultivar la célula […]