Método para preparar la proteína beta-NGF humana.
Un método para fabricar la proteína NGF-B humana a gran escala,
caracterizado por que comprende las etapasde:
1) sustituir el gen NGF-B de un ratón por el gen NGF-B humano utilizando las técnicas de recombinaciónhomóloga, haciendo que el ratón así obtenido exprese el gen NGF-B humano y fabricando de ese modo laproteína NGF-B humana,
2) extraer proteína NGF-B humana de las glándulas submandibulares, que puede expresar la proteínaNGF-B humana, del ratón obtenido en la etapa 1).
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/CN2008/070438.
Solicitante: Staidson (Beijing) BioPharmaceutical Co., Ltd.
Inventor/es: ZHOU,Zhiwen, CHEN,Hongbo, ZHANG,Hongshan.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A01K67/027 NECESIDADES CORRIENTES DE LA VIDA. › A01 AGRICULTURA; SILVICULTURA; CRIA; CAZA; CAPTURA; PESCA. › A01K CRÍA DE ANIMALES; AVICULTURA; APICULTURA; PISCICULTURA; PESCA; ANIMALES PARA CRIA O REPRODUCCIÓN, NO PREVISTOS EN OTRO LUGAR; NUEVAS VARIEDADES DE ANIMALES. › A01K 67/00 Cría u obtención de animales, no prevista en otro lugar; Nuevas razas de animales. › Nuevas razas de vertebrados.
- A61K38/18 A […] › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › Factores de crecimiento; Reguladores de crecimiento.
- A61P25/00 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Medicamentos para el tratamiento de trastornos del sistema nervioso.
- C07K14/48 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › Factor de crecimiento de tejido nervioso (NGF).
- C12N15/12 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Genes que codifican proteínas animales.
- C12N15/63 C12N 15/00 […] › Introducción de material genético extraño utilizando vectores; Vectores; Utilización de huéspedes para ello; Regulación de la expresión.
- C12N15/85 C12N 15/00 […] › para células animales.
- C12N15/89 C12N 15/00 […] › utilizando la micro-inyección.
- C12N15/90 C12N 15/00 […] › Introducción estable de ADN extraño en el cromosoma.
PDF original: ES-2386710_T3.pdf
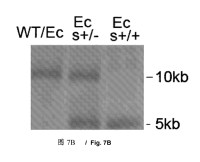
Fragmento de la descripción:
Método para preparar la proteína B-NGF humana.
Sector de la técnica
La presente invención hace referencia al método de preparar la proteína B-NGF humana de un gen objetivo ("target") utilizando el roedor transgénico que expresa el gen objetivo de forma estable utilizando la tecnología de cultivo de células madre embrionarias (ME) y la tecnología de recombinación homóloga para integrar el gen objetivo en el genoma y sustituir el correspondiente gen del roedor.
Estado de la técnica
El NGF (Factor de Crecimiento Nervioso) fue el primer regulador de crecimiento neuronal que fue descubierto y confirmado y el factor neurotrófico mejor descrito. [Ho JL, He S, Hu A et al., J Exp Med, 1995, 181 (4) :1493 1505.]. El NGF desempeña papeles importantes en las etapas de la proliferación y diferenciación fenotípica de las células madre neuronales, el desarrollo de neuronas, el crecimiento de axones, la síntesis de neurotransmisores y apoptosis celular, etc. [Sayada C, Denamur E, Elion J et al., Gene, 1992, 120 (1) :129-130. ]. El NGF regula la diferenciación y maduración de las neuronas simpáticas y sensoriales, está involucrada en soportar el funcionamiento normal de las neuronas simpáticas adultas, y participa en la nutrición de las neuronas sensoriales adultas [Zhang O, Yang X, Berr y J, et al., J In2fect Dis, 1997, 176 (4) : 1035-1040.]. Los desarrollos y diferenciaciones de las neuronas colinérgicas del lóbulo frontal basal y las interneuronas colinérgicas del cuerpo estriado del cerebro en el sistema nervioso central también están regulados por el NGF [pal S, Barnhart KM, Wei Q, et al., Vaccine, 1999, 17 (5) :459-465.]. Dada la importancia de la actividad fisiológica del NGF, está demostrado que tiene unos valores de aplicación clínica muy importantes.
El NGF humano se compone de tres tipos de cadenas de péptidos: o, B y y, unidas por enlaces no covalentes en forma de o2B2Y2. También se ha demostrado que la subunidad B posee toda la bioactividad del NGF, en el que la subunidad B es un regulador compuesto de dos cadenas de 118-amino-ácidos unidas por enlaces no covalentes. En cada monómero hay tres enlaces disulfuro; y la correcta formación de los tres enlaces disulfuro (Cys58-Cys108, Cys68-Cys110, Cys15-Cys80) es la base crítica para el plegamiento de proteínas, y luego afecta a la bioactividad de la NGF-B. Debido a la concentración evanescente y al contenido de NGF-B humana en el cuerpo del adulto humano y a la indisponibilidad de tejido humano, no puede producirse en grandes cantidades a través de la extracción de tejidos humanos. Y, el preparado de NGF-B a partir de bacterias generales (por ejemplo, E. coli) y sistemas de expresión en levaduras mediante tecnologías de recombinación muestra menos bioactividad que la NGF-B extraída de órganos de animales. Esto se debe a que no existe modificación y dimerización natural en estos dos sistemas [De Bernardez Clark E, Schwarz E, Rudolph, Ret al., 1999; 309:217-36. Ikemura H, Takagi H, Inouye M, et al., J Biol Chem. 1987 Jun 5;262 (16) :7859-64. Nishizawa M, Ozawa F, Higashizaki T, et al., Appl. Microbiol Biotechnol. 1993 Feb; 38 (5) :62430.]. Teóricamente, sería más ventajoso utilizar células de mamíferos para expresar y preparar NGF-B humana; sin embargo, su bajo nivel de expresión y elevado coste tienden a obstaculizar su producción a gran escala. [C. ANTHONY ALTAR, Louis E. BURTON, GREGORY L. Proc. Natl. Acad. Sci. USA Vol. 88, pp. 281-285, Januar y 1991 ) ]. Además, la bioactividad de la NGF-B humana preparada por el sistema celular de mamíferos no humanos es incomparable al NGF extraído de humanos. Un ensayo clínico basado en NGF humano recombinante para neuropatía diabética desarrollado por Genentech, Inc. falló en la Fase 111 debido al deficiente efecto terapéutico [Apfel SC. Int. Rev. Neurobiol 50: 393-413, 2002]. Mientras se escribe este texto, ningún NGF humano recombinante ha sido autorizado como medicamento en el mercado, aunque continuamente se han presentado varias estrategias y esfuerzos basados en tecnología recombinante en diferentes sistemas de expresión tales como bacterias, levaduras, células CHO y células de insectos.
El contenido de NGF en la glándula submandibular es más alto que en el resto de tejidos u órganos de ratones macho adultos. Además, los ratones se reproducen rápidamente y son fáciles de criar a gran escala de acuerdo con los requisitos industriales. Por lo tanto, se supone que los ratones son una fuente ideal para extraer y purificar NGF. El NGF-B con mayor actividad biológica y con abundancia ilimitada en el mercado se extrae de la glándula submandibular de los ratones. Sin embargo, en comparación con el NGF humano, la eficacia terapéutica del NGF del ratón sobre modelos experimentales de roedores de mioencefalitis alérgica y enfermedad de Parkinson no es tan buena como la del NGF humano. Además, teóricamente el NGF del ratón es más inmunogénico a los humanos que el factor de crecimiento nervioso humano. Y la estabilidad y seguridad del NGF humano pueden ser mejores que las del NGF de ratón cuando se aplican a los humanos.
Hay una serie de genes humanos que son homólogos a los del ratón, y el ratón es fácil de alimentar debido a su pequeño tamaño y ciclo vital relativamente más corto, por lo tanto el ratón es uno de los mejores modelos animales para investigar la función genética de los mamíferos y las enfermedades humanas. Durante los últimos años, se han modificado genéticamente muchas clases de ratones para expresar las proteínas heterogéneas a través de la tecnología "gene targeting". La función biológica del NGF y la interacción del NGF con su receptor despiertan siempre mucho interés en el campo de la neurobiología y la biología del desarrollo. Crowley et al utilizaron la tecnología knock-out para destruir el gen NGF del ratón, e investigaron la influencia de NGF en el desarrollo de neuronas (Crowley C, Spencer SD, Nishimura MC, et. al, Cell. 1994 Mar 25; 76 (6) : 1001-11.) . Está demostrado que el desarrollo y supervivencia de neuronas simpáticas y sensoriales depende estrictamente del NGF, y que esta dependencia no puede ser compensada por otras neurotrofinas. Además, Smeyne et al. Aplicaron técnicas de knock-out al receptor celular de alta afinidad TrkA del NGF para investigar la función de TrkA en el desarrollo de neuronas (Smeyne RJ, Klein R, Schnapp A, et al .Nature. 1994 Mar 17; 368 (6468) :193-4.) . Sin embargo, si se bloquean todos los genes NGF o los de su receptor TrkA, o bien morirá el ratón durante su desarrollo embrionario temprano o bien nacerá con poca vitalidad debido a la reducción de la actividad fisiológica del NGF. Esta puede ser también una de las razones para que no se investigue la aplicación de la estrategia del bloqueo al estudio de la interacción específica entre el NGF y su receptor. El NGF mutante obtenido in vitro proporciona una buena base para investigar la interacción entre el NGF y su receptor. Por ejemplo, el NGF mutante que une al TrkA solamente (en lugar del receptor de baja afinidad P75) puede ser utilizado para investigar la función del P75, lo cual hace que la investigación esté más centrada, y sea más pertinente y específica (Horton A, Laramee G, Wyatt S, et al., Mol Cel! Neurosci. 1997; 10 (3-4) :162-72. Ry den M, Hempstead B, Ibanez CF, et al., J Biol Chem. 1997 Jun 27; 272 (26) :16322-8) . Pero la mutación genética in vitro no puede revelar el efecto de las mutaciones durante el desarrollo individual en la compleja situación in vivo. Por lo tanto, queda por elucidar cómo modificar el gen NGF de animales para expresar establemente muteínas de NGF de dicho animal y estudiar la función del NGF mutante y su receptor a nivel de todo el animal.
Descripción breve de la invención
El objeto de la presente invención es resolver los problemas de la técnica anterior: la expresión de la NGF-B humana y su mutación utilizando células de mamífero presenta poca producción y es difícil de realizar a gran escala; el NGF de ratón es de bajo efecto terapéutico y de posible gran inmunogenicidad; y existen algunas limitaciones asociadas al método de bloqueo genético para investigar las interacciones específicas entre el NGF y su receptor.
La presente invención proporciona un método para fabricar la proteína NGF-B humana a gran escala, caracterizado por que comprende las etapas de:
1) sustituir el gen NGF-B de un ratón por el gen NGF-B humano utilizando las técnicas de recombinación homóloga, haciendo que el ratón así obtenido exprese el gen NGF-B humano, y fabricando por lo tanto proteína NGF-B humana, 2) extraer la proteína NGF-B... [Seguir leyendo]
Reivindicaciones:
1. Un método para fabricar la proteína NGF-B humana a gran escala, caracterizado por que comprende las etapas de:
1) sustituir el gen NGF-B de un ratón por el gen NGF-B humano utilizando las técnicas de recombinación homóloga, haciendo que el ratón así obtenido exprese el gen NGF-B humano y fabricando de ese modo la proteína NGF-B humana, 2) extraer proteína NGF-B humana de las glándulas submandibulares, que puede expresar la proteína
NGF-B humana, del ratón obtenido en la etapa 1) .
2. El método de la reivindicación 1, caracterizado por que dicha proteína se formula en una fórmula farmacéuticamente aceptable.
3. El método de la reivindicación 1, caracterizado por que dicha proteína se formula en forma de inyección o colirio.
Patentes similares o relacionadas:
Neuregulina para tratar la insuficiencia cardíaca, del 29 de Julio de 2020, de Zensun (Shanghai) Science & Technology, Co., Ltd: Neuregulina para usar en un método para tratar la insuficiencia cardíaca crónica en un paciente, donde el paciente tiene un nivel plasmático de NT-proBNP […]
Dispositivo médico que tiene un revestimiento que comprende ACCS, del 15 de Julio de 2020, de Noveome Biotherapeutics, Inc: Un dispositivo médico implantable que tiene un revestimiento en su superficie, útil para la implantación quirúrgica en el cuerpo de un sujeto, […]
Composiciones que comprenden cócteles de fagos antibacterianos y usos de las mismas para el tratamiento de infecciones bacterianas, del 24 de Junio de 2020, de Tecnifar-Indústria Técnica Farmacêutica, S.A: Una composicion que comprende: una primera y una segunda cepa purificada de bacteriofago, cada una de dichas cepas que tiene un genoma que comprende […]
Combinacion de peptidos tolerogenos con TFG-â para inducir y mantener la tolerancia oral en mamiferos jovenes, del 3 de Junio de 2020, de SOCIETE DES PRODUITS NESTLE S.A.: Una composición nutricional - que contiene al menos un péptido de cinco hasta doce aminoácidos de longitud e incluye una secuencia elegida entre […]
Formulaciones con oxidación reducida, del 3 de Junio de 2020, de F. HOFFMANN-LA ROCHE AG: Una formulación líquida que comprende un anticuerpo y un compuesto que previene la oxidación del anticuerpo en la formulación líquida, en la que el compuesto es […]
Trampas de GDF, del 3 de Junio de 2020, de ACCELERON PHARMA, INC: Un polipéptido aislado que comprende la secuencia de aminoácidos de SEQ ID NO: 28.
Modulación de la actividad del factor de crecimiento epidérmico de unión a heparina para la curación de la membrana timpánica, del 6 de Mayo de 2020, de THE BOARD OF TRUSTEES OF THE LELAND STANFORD JUNIOR UNIVERSITY: Un agente que proporciona actividad de factor de crecimiento epidérmico de unión a heparina (HB-EGF) para su uso en el tratamiento de una perforación crónica de la membrana […]
Composiciones para lograr niveles plasmáticos deseados del factor 2 de crecimiento glial, del 6 de Mayo de 2020, de ACORDA THERAPEUTICS, INC: Factor de crecimiento glial 2 (GGF2) para su uso en la promocion de la remielinizacion celular en un paciente, donde el GGF2 se administra al paciente en una cantidad de […]