RECONOCIMIENTO DE LA VASCULATURA TUMORAL COMO DIANA MEDIANTE EL ANTICUERPO L19 RADIOMARCADO DIRIGIDO CONTRA EL DOMINIO ED-B DE FIBRONECTINA.
Un miembro de unión específica que se une a ED-B humano, en el que el miembro de unión específica está marcado con un isótopo y comprende un sitio de unión a un antígeno que comprende un dominio de anticuerpo VH y un dominio de anticuerpo VL,
en que el isótopo es 131 I y en que el dominio de anticuerpo VH comprende una CDR1 de VH, una CDR2 de VH y una CDR3 de VH, en que la CDR3 de VH es la CDR3 de VH de L19 de SEQ ID NO. 3, la CDR1 de VH es la CDR1 de VH de L19 de SEQ ID NO. 1 y la CDR2 de VH es la CDR2 de VH de L19 de SEQ ID NO. 2; y en que el dominio de anticuerpo VL comprende una CDR1 de VL, una CDR2 de VL y una CDR3 de VL, en que la CDR3 de VL es la CDR3 de VL de L19 de SEQ ID NO. 6, la CDR1 de VL es la CDR1 de VL de L19 de SEQ ID NO. 4 y la CDR2 de VL es la CDR2 de VL de L19 de SEQ ID NO. 5; en que el miembro de unión específica comprende una miniinmunoglobulina que comprende dichos dominio de anticuerpo VH y dominio de anticuerpo VL fusionados a εS2-CH4 y dimerizados
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2004/009733.
Solicitante: PHILOGEN S.P.A.
BAYER SCHERING PHARMA AKTIENGESELLSCHAFT.
Nacionalidad solicitante: Italia.
Dirección: PIAZZA LA LIZZA, 7 53100 SIENA ITALIA.
Inventor/es: HILGER, CHRISTOPH-STEPHAN, FRIEBE,MATTHIAS, BORSI,Laura,Ist. Naz. per la Ricerca sul Cancro, CARNEMOLLA,B.,Inst. Naz. per Ricerca sul Cancro, BALZA,Enrica,Ist. Naz. per la Ricerca sul Cancro, CASTELLANI,P.Ist. Naz. per la Ricerca sul Cancro, ZARDI,L.,Ist. Naz. per la Ricerca sul Cancro.
Fecha de Publicación: .
Fecha Solicitud PCT: 1 de Septiembre de 2004.
Clasificación Internacional de Patentes:
- A61K51/10B30
Clasificación PCT:
- A61K51/10 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 51/00 Preparaciones que contienen sustancias radioactivas utilizadas para la terapia o para el examen in vivo. › Anticuerpos o inmunoglobulinas; Sus fragmentos.
- A61P35/00 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Agentes antineoplásicos.
Clasificación antigua:
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre.
PDF original: ES-2361743_T3.pdf





Fragmento de la descripción:
La presente invención se refiere al reconocimiento de la vasculatura tumoral como diana mediante moléculas de anticuerpos radiomarcadas de acuerdo con la reivindicación 1. En particular, la invención se refiere al uso de moléculas de anticuerpos que se unen al dominio ED-B de fibronectina y que son de utilidad demostrada en el reconocimiento de tumores como diana. En particular, las moléculas de anticuerpos son miniinmunoglobulinas, como las que se generan por la fusión de una molécula de anticuerpo scFv con el dominio constante CH4 de una isoforma secretora de IgE que contiene de manera natural una cisteína en su extremo COOH, la cual forma un dímero ligado covalentemente. La velocidad de aclaramiento sanguíneo, la estabilidad in vivo y otras propiedades ventajosas se emplean en diferentes aspectos y realizaciones de la invención, por ejemplo, en el reconocimiento de tumores como diana. El diferente comportamiento in vivo de diferentes formatos de las moléculas de anticuerpo puede explotarse para distintos fines de diagnóstico y/o terapéuticos, en función de las necesidades clínicas y de la enfermedad.
A pesar de su enorme potencial como agentes terapéuticos, los anticuerpos monoclonales (mAb) de origen no humano no han dado buenos resultados en ensayos clínicos debido a su inmunogenia (1 Shawlert y col., 1985; 2 Miller y col., 1983), sus deficientes propiedades farmacocinéticas (3 Hakimi y col., 1991; 4 Stephens y col., 1995) y la ineficiencia en la búsqueda de funciones efectoras (5 Riechmann y col, 1988; 6 Junghens y col., 1990). La perspectiva reciente de aislar fragmentos de anticuerpos humanos a partir de bibliotecas de expresión en fagos (7 McCafferty y col., 1990; 8 Lowman y col., 1991; véanse los artículos de revisión 9 Nilsonn y col., 2000 y 10 Winter y col., 1994) transciende de estos problemas, a la vez que revitaliza estudios y revive las esperanzas de usar estos reactivos para el tratamiento de enfermedades de importancia. De hecho, estas moléculas deberían servir como elementos constructivos ideales para nuevas herramientas de diagnóstico y tratamiento (11 Reichert, 2001; Huls y col., 1999). Además, estos anticuerpos pueden “madurarse” para alcanzar afinidades en el intervalo picomolar (13 Pini y col., 1998), lo que al menos es deseable, si no necesario, para su uso clínico.
No obstante, las aplicaciones clínicas de fragmentos de anticuerpos humanos para la administración selectiva de agentes de diagnóstico o terapéuticos requieren dianas de gran especificidad. En el caso de los tumores, las dianas más populares son antígenos de la superficie celular, los cuales habitualmente no son abundantes ni estables. Sin embargo, durante la progresión del tumor, el microentorno que rodea a las células tumorales sufre una amplia modificación que genera un “entorno tumoral”, el cual representa una diana para la terapia tumoral a base de anticuerpos (14 Neri y Zardi, 1998). De hecho, el concepto de que el microentorno tumoral alterado es un carcinógeno en sí mismo que puede utilizarse como diana es cada vez más aceptado. Por lo tanto, las moléculas capaces de suministrar eficazmente agentes terapéuticos al microentorno tumoral representan nuevas herramientas prometedoras e importantes para el tratamiento del cáncer (15 Bissel, 2001; 14 Neri y Zardi, 1998).
La fibronectina es un componente de la matriz extracelular (MEC) que se expresa ampliamente en diversos tejidos normales y fluidos corporales. Es posible generar isoformas diferentes de FN por un corte y empalme alternativo del pre-ARNm de FN, un proceso modulado por citocinas y el pH extracelular (16 Balza y col., 1988; 17 Carnemolla y col., 1989; 18 Borsi y col., 1990; 19 Borsi y col., 1995). La repetición completa de tipo III EDB, también conocida como la repetición extra de tipo III B (EIIIB) puede estar presente o totalmente ausente en la molécula de FN (20 Zardi y col., 1987). La repetición ED-B está muy conservada en distintas especies, con una homología del 100% en todos los mamíferos estudiados hasta ahora (humanos, ratas, ratones, perros) y una homología del 96% con un dominio similar en pollos. La isoforma de FN que contiene ED-B (B-FN) no puede detectarse por medios inmunohistoquímicos en los tejidos adultos normales, con la excepción de los tejidos que sufren una reorganización fisiológica (por ejemplo, el endometrio y el ovario) y durante la cicatrización de las heridas (17 Carnemolla y col., 1989; 21 French-Constant y col., 1989). Por el contrario, su expresión es alta en tumores y tejidos fetales (17 Carnemolla y col., 1989). Además, se ha demostrado que B-FN es un marcador de la angiogénesis (22 Castellani y col., 1994) y que las células endoteliales que invaden los tejidos tumorales migran a lo largo de fibras de MEC que contienen B-FN (23 Tarli y col., 1999).
El reconocimiento selectivo de la vasculatura tumoral como diana se ha descrito mediante el uso de un anticuerpo recombinante humano, scFv(L19) (13 Pini y col., 98), específico para la isoforma B-FN (24 Carnemolla y col., 1996; 23 Tarli y col., 99; 25 Viti y col., 99; 26 Neri y col, 97; 27 Demartis y col., 2001). El anticuerpo puede usarse tanto en el diagnóstico in vivo (inmunoescintografía) como en estrategias terapéuticas que implican la administración selectiva de radioisótopos terapéuticos o agentes tóxicos a la vasculatura tumoral. Además, Birchler y col. (28 1999) demostraron que scFv(L19) acoplado químicamente a un fotosensibilizante se acumula selectivamente en los vasos sanguíneos de nueva formación en el modelo angiogénico de córnea de conejo y, después de la irradiación con luz del infrarrojo próximo, da lugar a una oclusión completa y selectiva de la neovasculatura ocular.
Más recientemente, Nilsson y col. (29 2001) describieron que el inmunoconjugado de scFv(L19) con el dominio extracelular del factor tisular da lugar a un infarto selectivo en distintos tipos de modelos tumorales murinos. Además, las proteínas de fusión de scFv(L19) e IL-2 o IL-12 han demostrado la mejora de la eficacia terapéutica de estas dos citocinas (30 Halin y col., enviado; 31 Carnemolla y col., 2002). Véase también el documento WO01/62298 para el uso de fusiones en el tratamiento de lesiones de angiogénesis patológica, incluyendo tumores. Finalmente, dado que L19 reacciona igualmente bien con ED-B de ratones y humanos, puede usarse tanto para estudios preclínicos como clínicos.
Véanse también los documentos PCT/GB97/01412, PCT/EP99/03210, PCT/EP01/02062 y PCT/IB01/00382.
Diferentes formatos de anticuerpos han mostrado un comportamiento diferente en cuanto a la estabilidad in vivo, aclaramiento y rendimiento en el reconocimiento de tumores como diana (32 Wu y col., 2000). Una miniinmunoglobulina o inmunoproteína pequeña (SIP) se describe en (33 Li y col., 1997).
La presente invención se basa en la preparación, caracterización e investigación de la biodistribución in vivo de moléculas del anticuerpo humano L19 en el formato de miniinmunoglobulina y marcadas con el radioisótopo
131I.
Breve descripción de las figuras
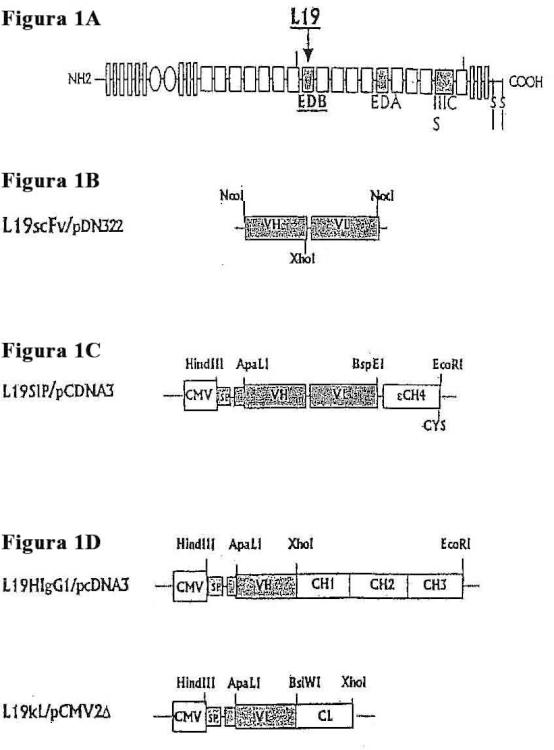
La figura 1 muestra modelos que ilustran las estructuras de distintas proteínas. A: modelo de la estructura de dominios de una subunidad de FN. Las secuencias de la proteína que sufren un corte y empalme alternativo se indican en color gris. Tal como se indica, el epítopo del anticuerpo recombinante L19 se localiza dentro de la repetición ED-B. B-D: esquemas de las construcciones usadas para expresar, respectivamente, L19(scFv) (comparación) (B), L19-SIP (C) y L19-IgG1/κ (comparación).
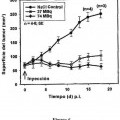
La figura 2 muestra curvas de crecimiento de tumores SK-MEL-28 en ratones sin pelo (triángulos) y de tumores F9 en ratones de la cepa 129 (círculos). Se representa el volumen (mm3) frente al tiempo (días). Cada punto de datos es la media de seis ratones ± SD.
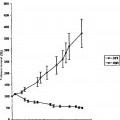
La figura 3 muestra los resultados de cromatografía de exclusión por tamaños para los diferentes formatos de L19. En los paneles A, B y C se muestran perfiles de cromatografía de exclusión por tamaños (Superdex 200) de los formatos scFv, miniinmunoglobulina e IgG1 de L19, respectivamente, después de la radioyodación. Los paneles D, E y F muestran perfiles de cromatografía de exclusión por tamaños (Superdex 200) de plasma en los tiempos indicados después de la inyección i.v. de los formatos de L19 radioyodados scFv, miniimunoglobulina e IgG1, respectivamente. No se detectaron cambios en los perfiles de las curvas de L19-SIP o L19-IgG1 al cargar el plasma a tiempos diferentes después de la inyección, mientras que 3 h... [Seguir leyendo]
Reivindicaciones:
1. Un miembro de unión específica que se une a ED-B humano, en el que el miembro de unión específica está marcado con un isótopo y comprende un sitio de unión a un antígeno que comprende un dominio de anticuerpo VH y un dominio de anticuerpo VL, en que el isótopo es 131I y en que el dominio de anticuerpo VH comprende una CDR1 de VH, una CDR2 de VH y una CDR3 de VH, en que la CDR3 de VH es la CDR3 de VH de L19 de SEQ ID NO. 3, la CDR1 de VH es la CDR1 de VH de L19 de SEQ ID NO. 1 y la CDR2 de VH es la CDR2 de VH de L19 de SEQ ID NO. 2; y en que el dominio de anticuerpo VL comprende una CDR1 de VL, una CDR2 de VL y una CDR3 de VL, en que la CDR3 de VL es la CDR3 de VL de L19 de SEQ ID NO. 6, la CDR1 de VL es la CDR1 de VLdeL19deSEQIDNO.4 yla CDR2 de VL es laCDR2deVLdeL19deSEQIDNO.5;enqueelmiembrode unión específica comprende una miniinmunoglobulina que comprende dichos dominio de anticuerpo VH y dominio de anticuerpo VL fusionados a εS2-CH4 y dimerizados.
2. Un miembro de unión específica de acuerdo con la reivindicación 1, en que el miembro de unión específica compite por la unión a ED-B con un dominio de unión a ED-B de un anticuerpo que comprende el dominio VH de L19 y el dominio VL de L19.
3. Un miembro de unión específica de acuerdo con la reivindicación 1 o la reivindicación 2 que comprende el dominio VH de L19.
4. Un miembro de unión específica de acuerdo con la reivindicación 3 que comprende el dominio VL de L19.
5. Un miembro de unión específica de acuerdo con la reivindicación 4, en que el dominio de anticuerpo VH y el dominio de anticuerpo VL se encuentran en una molécula de anticuerpo scFv fusionada con εS2-CH4.
6. Un miembro de unión específica de acuerdo con la reivindicación 5, en que la molécula de anticuerpo scFv está fusionada a εS2-CH4 por medio de un péptido enlazante.
7. Un miembro de unión específica de acuerdo con la reivindicación 6, en que el péptido enlazante tiene la secuencia de aminoácidos GGSG (SEQ ID NO. 7).
8. Un procedimiento para la producción de un miembro de unión específica de acuerdo con una cualquiera de las reivindicaciones 1 a 7, en que el procedimiento comprende el marcaje de un miembro de unión específica con el isótopo 131I.
9. Un procedimiento de acuerdo con la reivindicación 8, en que el marcaje comprende la oxidación de un haluro en presencia del miembro de unión específica, en que el haluro es 131I-.
10. Un procedimiento de acuerdo con la reivindicación 8, en que el marcaje comprende la conjugación de un portador de halógeno bifuncional activado que contiene un radioisótopo con un resto de lisina o cisteína o con el extremo N del miembro de unión específica, en que el radioisótopo es 131I.
11. Un procedimiento de acuerdo con una cualquiera de las reivindicaciones 8 a 10, en que el procedimiento comprende la expresión del ácido nucleico que codifica el miembro de unión específica antes del marcaje.
12. Un procedimiento de acuerdo con la reivindicación 11 que comprende el cultivo de las células hospedadoras en las condiciones para la producción del miembro de unión específica
13. Un procedimiento de acuerdo con una cualquiera de las reivindicaciones 8 a 12 que comprende además el aislamiento y/o purificación del miembro de unión específica.
14. Un procedimiento de acuerdo con una cualquiera de las reivindicaciones 8 a 13 que comprende además la formulación del miembro de unión específica en una composición que incluye al menos un componente adicional.
15. Un procedimiento de acuerdo con una cualquiera de las reivindicaciones 8 a 14 que comprende además la unión del miembro de unión específica a ED-B o a un fragmento de ED-B in vitro.
16. Un procedimiento que comprende la unión a ED-B o a un fragmento de ED-B de un miembro de unión específica que se une a ED-B de acuerdo con una cualquiera de las reivindicaciones 1 a 7, en que dicha unión tiene lugar in vitro.
17. Un procedimiento de acuerdo con las reivindicaciones 15 ó 16 que comprende la determinación de la cantidad de unión a ED-B o a un fragmento de ED-B del miembro de unión específica.
18. Una composición que comprende un miembro de unión específica de acuerdo con una cualquiera de las reivindicaciones 1 a 7 para usar en un procedimiento para el tratamiento terapéutico del cuerpo humano o animal.
19. Una composición de acuerdo con la reivindicación 18 para usar en un procedimiento para el tratamiento de una lesión de angiogénesis patológica.
20. Una composición de acuerdo con la reivindicación 18 para usar en un procedimiento para el tratamiento de un tumor.
21. Una composición de acuerdo con una cualquiera de las reivindicaciones 1 a 7 para usar en un procedimiento de diagnóstico.
22. Uso de un miembro de unión específica de acuerdo con un cualquiera de las reivindicaciones 1 a 7 en la preparación de un medicamento para el tratamiento de una lesión de angiogénesis patológica.
23. Uso de un miembro de unión específica de acuerdo con una cualquiera de las reivindicaciones 1 a 7 en la preparación de un medicamento para el tratamiento de un tumor.
24. Uso de un miembro de unión específica de acuerdo con una cualquiera de las reivindicaciones 1 a 7 en la preparación de un reactivo de diagnóstico.
Patentes similares o relacionadas:
ANTICUERPOS ANTI-TAT226 E INMUNOCONJUGADOS, del 1 de Febrero de 2012, de GENENTECH, INC.: Anticuerpo monoclonal que se une a TAT226, donde el anticuerpo comprende una HVR-H1 que comprende la secuencia de aminoácidos de SEC ID NO:4; una HVR-H2 […]
 USOS DEL ANTICUERPO MONOCLONAL 8H9, del 26 de Abril de 2011, de SLOAN-KETTERING INSTITUTE FOR CANCER RESEARCH: Un anticuerpo aislado, en el que la región determinante de la complementariedad es NYDIN para CDR1, WIFPGDGSTQYNE para CDR2, QTTATWFAY para […]
USOS DEL ANTICUERPO MONOCLONAL 8H9, del 26 de Abril de 2011, de SLOAN-KETTERING INSTITUTE FOR CANCER RESEARCH: Un anticuerpo aislado, en el que la región determinante de la complementariedad es NYDIN para CDR1, WIFPGDGSTQYNE para CDR2, QTTATWFAY para […]
 COMPOSICIONES DE ANTICUERPO OVR110 Y METODOS DE USO, del 9 de Agosto de 2010, de DIADEXUS, INC.: Método para detectar cáncer de cabeza y cuello en un sujeto, comprendiendo el método,
(a) combinar una muestra de líquido corporal de un sujeto con un anticuerpo anti-Ovr110 […]
COMPOSICIONES DE ANTICUERPO OVR110 Y METODOS DE USO, del 9 de Agosto de 2010, de DIADEXUS, INC.: Método para detectar cáncer de cabeza y cuello en un sujeto, comprendiendo el método,
(a) combinar una muestra de líquido corporal de un sujeto con un anticuerpo anti-Ovr110 […]
 DETECCION DE CANCER, del 19 de Abril de 2010, de MORO, RICARDO J: SE DESCRIBE UN METODO PARA DETECTAR EL CANCER EN UN PACIENTE QUE COMPRENDE LOS PASOS DE INTRODUCCION DE UNOS ANTICUERPOS ETIQUETADOS O UN AFP ETIQUETADO […]
DETECCION DE CANCER, del 19 de Abril de 2010, de MORO, RICARDO J: SE DESCRIBE UN METODO PARA DETECTAR EL CANCER EN UN PACIENTE QUE COMPRENDE LOS PASOS DE INTRODUCCION DE UNOS ANTICUERPOS ETIQUETADOS O UN AFP ETIQUETADO […]
USO DE CONJUGADOS DE ACIDO BILIAR O SAL BILIAR CON ACIDO GRASO, del 19 de Noviembre de 2009, de GALMED INTERNATIONAL LTD.: Un conjugado de ácido biliar o sal biliar con ácido graso de fórmula general II W- X - G en la que G es un radical de ácido biliar o sal biliar, que, si se desea, está conjugado […]
Compuestos y procedimientos de uso, del 29 de Julio de 2020, de Medivation Technologies LLC: Un compuesto de fórmula (Aa-1): **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en la que: A representa H, halógeno, amino, […]
Complejos de agentes terapéuticos de base vírica y poli(beta-amino-ésteres) modificados, del 29 de Julio de 2020, de Sagetis Biotech, SL: Un complejo de un agente terapéutico de base vírica con un polímero de fórmula I: **(Ver fórmula)** donde cada L1 y L2 están seleccionados […]
Compuestos de alquinilbenceno heterocíclicos, y composiciones médicas y usos de los mismos, del 29 de Julio de 2020, de Guangzhou Healthquest Pharma Co., Ltd: Un compuesto de alquinilbenceno heterocíclico que tiene la fórmula (I) y una sal farmacéuticamente aceptable, o estereoisómero del mismo, **(Ver […]