PURIFICACIÓN DE COMPUESTOS DE BETA-LACTAMA.
Procedimiento para convertir en 7α-metoxi cefalosporinas las 7α
-metiltio-cefalosporinas que están contenidas como impurezas en cantidades inferiores al 0,5% en las 7α-metoxi cefalosporinas, caracterizado porque una 7α-metoxi-cefalosporina que contiene un grupo amida en la posición 7, e impurificada con el correspondiente análogo 7α-metiltio, se trata con un agente de halogenación seleccionado del grupo que comprende bromo, Nbromosuccinimida, N-clorosuccinimida, N-cloroacetamida, cloramina T, diclorouretano y 1,3-dibromo-5,5-dimetilhidantoína, en solución metanólica, a una temperatura entre 0o C y +5 o C durante un tiempo entre 30 minutos y 3 horas, para obtener la conversión completa de la impureza sulfurada en el correspondiente análogo metoxi
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E06119113.
Solicitante: ACS DOBFAR S.P.A..
Nacionalidad solicitante: Italia.
Dirección: VIALE ADDETTA 6/8/10 20067 TRIBIANO (MILANO) ITALIA.
Inventor/es: ZENONI, MAURIZIO, FORZATTI,MARCO, FOGLIATO,GIOVANNI.
Fecha de Publicación: .
Fecha Solicitud PCT: 17 de Agosto de 2006.
Fecha Concesión Europea: 15 de Septiembre de 2010.
Clasificación Internacional de Patentes:
- C07D501/00 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › Compuestos heterocíclicos que contienen sistemas cíclicos tia-5 aza-1 biciclo [4.2.0] octano, es decir, compuestos que contienen un sistema cíclico de fórmula: , p. ej. cefalosporinas; Estando estos sistemas cíclicos adicionalmente condensados, p. ej. condensados en posición 2, 3 con heterociclos que contienen oxígeno, nitrógeno o azufre.
Clasificación PCT:
- C07D501/00 C07D […] › Compuestos heterocíclicos que contienen sistemas cíclicos tia-5 aza-1 biciclo [4.2.0] octano, es decir, compuestos que contienen un sistema cíclico de fórmula: , p. ej. cefalosporinas; Estando estos sistemas cíclicos adicionalmente condensados, p. ej. condensados en posición 2, 3 con heterociclos que contienen oxígeno, nitrógeno o azufre.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
Descripción:
Las 7α-metoxi-cefalosporinas son un tipo particular de cefalosporinas que tienen un grupo metoxi en la posición 7α. Este grupo metoxi confiere una marcada estabilidad frente a la acción de diferentes β-lactamas, motivo por el cual algunos representantes de este tipo de cefalosporina se han introducido en la utilización clínica. Las que se conocen mejor son cefoxitina, cefmetazol y cefotetán, aunque también existen los homólogos 6α-metoxipenicilina y 7α-metoxi-oxacefalosporina.
Por lo tanto, el procedimiento que se utiliza para la introducción del grupo metoxi en la posición 7α de las cefalosporinas y 6α de las penicilinas tiene una importancia evidente.
Los documentos US 4109084, US 4158657, US 4154927 y US 4119778 reivindican métodos para la preparación de tiooximas de cefalosporina que se caracterizan por el grupo R1-S-N= en la posición 7. En particular, los documentos US 4119778, US 4154927 y US 4158657 reivindican tiooximas de penicilina y cefalosporina en las que también está presente un (1-metil-1 H-tetrazol-5-il) tiometilo en la posición 3, y un método para su preparación a partir de 6-APA, 7-ADCA, 7-ACA y derivados; en este caso, el mencionado grupo tetrazol es un sustituyente de la molécula de cefmetazol, una de las 7α-metoxi-cefalosporinas que se ha introducido ampliamente en la utilización clínica.
Los núcleos 7α-metoxi se pueden obtener a partir de estas tiooximas mediante el tratamiento con trifenilfosfina y un catalizador adecuado en presencia de metanol. A continuación, los núcleos 7α-metoxi que se obtienen de esta manera se transforman en los derivados acilamino correspondientes, es decir, en las 7βacilamino-7α-cefalosporinas o en los intermedios relativos para su preparación.
Desafortunadamente, el procedimiento mencionado anteriormente presenta el inconveniente de dar lugar a un producto que es impuro a causa de la presencia de derivados 7α-metiltio, tal como se describe en J.A.C.S. 1980, 120, págs. 1690-1702, que se originan de la transposición del grupo -SH3 de un aducto intermedio unido a la trifenilfosfina. Obviamente, la impureza se introduce en las etapas posteriores de la síntesis que da lugar a las 7α-metoxi
cefalosporinas, dando como resultado que éstas se contaminen con la impureza sulfurada.
El objetivo principal de la presente invención es la eliminación del tiocompuesto desde las etapas iniciales del procedimiento, para evitar además un gasto inútil de reactivos que se consumen para la transformación de los derivados sulfurados.
Este objetivo se consigue mediante un procedimiento para convertir en 7α-metoxi-cefalosporinas las 7α-metiltiocefalosporinas contenidas como impurezas en cantidades inferiores al 0,5% en las 7α-metoxi-cefalosporinas, que se caracteriza porque se trata una 7α-metoxi-cefalosporina que contiene un grupo amida en la posición 7, e impurificada con el correspondiente análogo 7αmetiltio, con un agente de halogenación seleccionado del grupo que comprende bromo, N-bromosuccinimida, N-clorosuccinimida, Ncloroacetamida, cloramina T, diclorouretano y 1,3-dibromo-5,5dimetilhidantoína, en solución metanólica, a una temperatura entre 0ºC y +5ºC durante un tiempo entre 30 minutos y 3 horas, para obtener la conversión completa de la impureza sulfurada en el correspondiente análogo metoxi.
Preferentemente, el agente de halogenación es Nbromosuccinimida o bromo.
Con la acilación mencionada anteriormente de los núcleos 7β-amino-7α-metoxi, se obtiene un intermedio contaminado con el derivado metiltio, que se transforma sorprendentemente en el correspondiente derivado metoxi, permitiendo que se obtenga un producto final libre del análogo metiltio.
El valor de la presente invención se ve aumentado en gran medida por el hecho de que los agentes de halogenación utilizados en el nuevo procedimiento mencionado anteriormente ya se
han utilizado en la química de las β-lactamas, pero con un efecto bastante diferente al que se demuestra en la presente invención, por lo que no era esperable que éstos dieran lugar a la reacción utilizada según la presente invención. En este sentido, se conoce bien que la NBS y NCS se utilizan en la transformación de sulfóxidos de penicilina (documentos US 4052387, US 4159266) en haluros de sulfinilo de acetidinona y que éstos también se pueden utilizar para la halogenación de derivados 3-metil-cefem para dar como resultado análogos 3-halo-metil-cefem los cuales, a continuación, se transforman en derivados 3-hexometilen-cefam (documentos US 4985554, US 4994454). Los siguientes ejemplos sirven únicamente para ilustrar la presente invención, sin constituir una limitación de la misma. EJEMPLO 1
3-[(1-metil-1H-tetrazol-5-il)tio]metil-7α-metoxi-7β-bromoacetamido3-cefem-4-carboxilato de benzhidrilo
Se disuelven 20 g de 3-[(1-metil-1H-tetrazol-5
il)tio]metil-7α-metoxi-3-cefem-4-carboxilato de benzhidrilo que contiene el 0,5% de derivado 7α-metiltio en 120 ml de cloruro de metileno. Se añaden 3,6 ml de piridina, la mezcla se enfría hasta -30ºC y se añaden 8,73 g de bromuro de bromoacetilo. La mezcla se mantiene con agitación durante 1 hora entre -30ºC y -20ºC, a continuación se lava dos veces con 40 ml de agua entre 0ºC y +5ºC. Se añaden 50 ml de metanol, a continuación 1 g de Nbromosuccinimida, manteniendo la temperatura entre 0ºC y +5ºC. Después de 60 minutos de reacción la fase orgánica se lava con 65 ml de una solución acuosa de tiosulfato sódico al 1,5%, mientras se mantiene la temperatura por debajo de 10ºC. La fase orgánica se lava nuevamente con 65 ml de agua, se concentra al vacío y el residuo aceitoso se recoge con 150 ml de metanol. La mezcla se mantiene con agitación durante 30 minutos a temperatura ambiente, a continuación, el producto cristalino se filtra y se lava con metanol.
Se obtienen 20 g del producto que se indica en el título sin trazas de derivado de 7α-metiltio. EJEMPLO 2 3-[(1-metil-1H-tetrazol-5-il)tio]metil-7α-metoxi-7β-bromoacetamido3-cefem-4-carboxilato de benzhidrilo
Se disuelven 20 g del producto que se indica en el título pero que contiene el 0,2% de derivado 7α-metiltio en una mezcla de 100 ml de cloruro de metileno y 40 ml de metanol a temperatura ambiente. La mezcla se enfría hasta una temperatura entre 0ºC y +5ºC, se añaden 0,45 g de bromo diluido en 5 ml de cloruro de metileno y se dejan reaccionar durante 2 horas. La mezcla de reacción se lava con una solución de 2 g de tiosulfato sódico en 100 ml de agua, a continuación, se lava sólo con agua y la fase orgánica se concentra a presión reducida. El residuo aceitoso se recoge con 200 ml de metanol y se mantiene con agitación durante 30 minutos a temperatura ambiente. El sólido obtenido se filtra y se lava con metanol.
Rendimiento: 18 g del producto que se indica en el título, libre de derivado 7α-metiltio. EJEMPLO 3 3-[(1-metil-1H-tetrazol-5-il)tio]metil-7α-metoxi-7β-bromoacetamido3-cefem-4-carboxilato de benzhidrilo
Se disuelven 20 g del producto que se indica en el título pero que contiene el 0,2% de derivado 7α-metiltio en una mezcla de 100 ml de cloruro de metileno y 40 ml de metanol a temperatura ambiente. La mezcla se enfría hasta una temperatura entre 0ºC y +5ºC, se añaden 0,5 g de N-bromosuccinimida y se dejan reaccionar durante 2 horas. La mezcla de reacción se lava con una solución de 2 g de tiosulfato sódico en 100 ml de agua, a continuación, se lava sólo con agua y la fase orgánica se concentra a presión reducida. El aceite residual se recoge con 200 ml de metanol y se mantiene con agitación durante 30 minutos a temperatura ambiente. El sólido obtenido se filtra y se lava con metanol.
Rendimiento: 18 g del producto que se indica en el título, libre de derivado 7α-metiltio.
Trabajando de la forma de los ejemplos 1, 2 y 3, pero utilizando N-clorosuccinimida, N-cloroacetamida, cloramina T,
diclorouretano y 1,3-dibromo-5,5-dimetilhidantoína en lugar de Nbromosuccinimida o bromo, la impureza de derivado 7α-metiltio se convierte también en el análogo 7α-metoxi.
Reivindicaciones:
1. Procedimiento para convertir en 7α-metoxicefalosporinas las 7α-metiltio-cefalosporinas que están contenidas como impurezas en cantidades inferiores al 0,5% en las 7α-metoxi
cefalosporinas, caracterizado porque una 7α-metoxi-cefalosporina que contiene un grupo amida en la posición 7, e impurificada con el correspondiente análogo 7α-metiltio, se trata con un agente de halogenación seleccionado del grupo que comprende bromo, Nbromosuccinimida, N-clorosuccinimida, N-cloroacetamida, cloramina T, diclorouretano y 1,3-dibromo-5,5-dimetilhidantoína, en solución metanólica, a una temperatura entre 0ºC y +5ºC durante un tiempo entre 30 minutos y 3 horas, para obtener la conversión completa de la impureza sulfurada en el correspondiente análogo metoxi.
2. Procedimiento, según la reivindicación 1, que se caracteriza porque el agente de halogenación es N-bromosuccinimida.
3. Procedimiento, según la reivindicación 1, que se caracteriza porque el agente de halogenación es bromo.
Patentes similares o relacionadas:
Proceso para la producción de compuestos 3-alquenilcefem, del 10 de Mayo de 2017, de OTSUKA CHEMICAL CO., LTD.: Un proceso para la preparación del ácido 7-amino-3-[(E/Z)-2-(4-metiltiazol-5-il)vinil]-3-cefem-4-carboxílico de fórmula y una sal de un metal alcalino del […]
Sales de clorhidrato de un compuesto antibiótico, del 20 de Enero de 2016, de Theravance Biopharma Antibiotics IP, LLC: Un compuesto de fórmula I:**Fórmula** en el que x está en el intervalo de 1 a 2.
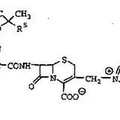 Compuestos de cefem, del 1 de Abril de 2015, de ASTELLAS PHARMA INC.: Un compuesto de la fórmula [I]: (Ver fórmula) en la que R 1 es alquilo C1-C6, hidroxialquilo (C1-C6) o haloalquilo (C1-C6), y R 2 es hidrógeno o un grupo protector amino, […]
Compuestos de cefem, del 1 de Abril de 2015, de ASTELLAS PHARMA INC.: Un compuesto de la fórmula [I]: (Ver fórmula) en la que R 1 es alquilo C1-C6, hidroxialquilo (C1-C6) o haloalquilo (C1-C6), y R 2 es hidrógeno o un grupo protector amino, […]
Producción mejorada de cefalosporina, del 20 de Septiembre de 2013, de DSM Sinochem Pharmaceuticals Netherlands B.V: Una cepa de Penicillium productora de cefalosporina que ha adquirido la capacidad de producir cefalosporinasdespués de haber sido transformada con un […]
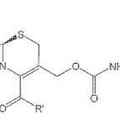 Compuesto de cefem, del 10 de Abril de 2013, de DSM Sinochem Pharmaceuticals Netherlands B.V: Un compuesto de cef-3-em caracterizado por la fórmula [I]
o una sal o éster del mismo,
en el que R se selecciona del grupo que consiste […]
Compuesto de cefem, del 10 de Abril de 2013, de DSM Sinochem Pharmaceuticals Netherlands B.V: Un compuesto de cef-3-em caracterizado por la fórmula [I]
o una sal o éster del mismo,
en el que R se selecciona del grupo que consiste […]
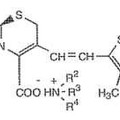 Compuestos de 3-alquenilcefem y procedimiento para su producción, del 16 de Mayo de 2012, de OTSUKA CHEMICAL CO., LTD.: Un compuesto de 3-alquenilcefem de fórmula **Formula**
en la que R1 es bencilo o fenoximetilo, R2, R3 y R4 son iguales o diferentes, siendo cada uno de ellos un […]
Compuestos de 3-alquenilcefem y procedimiento para su producción, del 16 de Mayo de 2012, de OTSUKA CHEMICAL CO., LTD.: Un compuesto de 3-alquenilcefem de fórmula **Formula**
en la que R1 es bencilo o fenoximetilo, R2, R3 y R4 son iguales o diferentes, siendo cada uno de ellos un […]
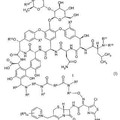 Antibióticos entrecruzados de glucopéptidos y cefalosporinas, del 2 de Mayo de 2012, de THERAVANCE, INC.: Un compuesto con la fórmula I:
O una sal farmacológicamente aceptable del mismo, en el que R1 es -Ya- (W) n-Yb-; R2 es hidrógeno o un alquilo C1-6; cada R3 se […]
Antibióticos entrecruzados de glucopéptidos y cefalosporinas, del 2 de Mayo de 2012, de THERAVANCE, INC.: Un compuesto con la fórmula I:
O una sal farmacológicamente aceptable del mismo, en el que R1 es -Ya- (W) n-Yb-; R2 es hidrógeno o un alquilo C1-6; cada R3 se […]
Procesos para producir compuestos de 3-cefem, del 18 de Abril de 2012, de OTSUKA KAGAKU KABUSHIKI KAISHA: Un proceso para preparar un compuesto de 3-halogenometilcefem de la fórmula o una sal del mismo en la que X1 es un átomo de halógeno, caracterizado por que […]