COMPOSICIÓN QUE COMPRENDE UN VECTOR SINTÉTICO COLOIDAL BIORESORBIBLE Y UN VECTOR VIAL.
Composición farmacéutica que comprende: - un vector sintético coloidal constituido por micropartículas bioresorbibles no tóxicas que comprende un antígeno proteico o varios antígenos proteicos,
y - un vector viral que comprende al menos una secuencia nucleotídica que codifica uno o más antígenos proteicos comprendidos en el vector sintético
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/FR2006/051039.
Solicitante: CENTRE NATIONAL DE LA RECHERCHE SCIENTIFIQUE (CNRS).
Nacionalidad solicitante: Francia.
Dirección: 3, RUE MICHEL ANGE 75016 PARIS FRANCIA.
Inventor/es: VERRIER, BERNARD, DELAIR, THIERRY, ATAMAN-ONAL,Yasemin.
Fecha de Publicación: .
Fecha Solicitud PCT: 17 de Octubre de 2006.
Clasificación Internacional de Patentes:
- A61K39/00D6
- A61K39/21 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Retroviridae, p. ej. virus de la anemia infecciosa equina.
- A61K47/48W8
Clasificación PCT:
- A61K39/00 A61K […] › Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53).
- A61K39/21 A61K 39/00 […] › Retroviridae, p. ej. virus de la anemia infecciosa equina.
- A61K47/34 A61K […] › A61K 47/00 Preparaciones medicinales caracterizadas por los ingredientes no activos utilizados, p. ej. portadores o aditivos inertes; Agentes de direccionamiento o agentes modificadores enlazados químicamente al ingrediente activo. › Compuestos macromoleculares obtenidos por reacciones distintas a aquellas en las que intervienen solamente enlaces insaturados carbono-carbono, p. ej. poliésteres, poly(amino ácidos), polisiloxanos, polifosfacinas, copolímeros de polialquilenglicol o poloxámeros (A61K 47/10 tiene prioridad).
- A61K47/48
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
PDF original: ES-2355943_T3.pdf




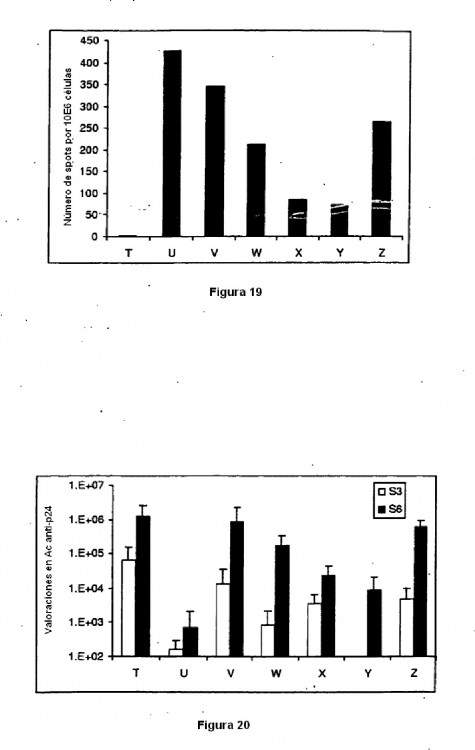
Fragmento de la descripción:
La presente invención se refiere al campo de la vacunación profiláctica y terapéutica. En particular, la presente invención tiene por objeto una composición vacunal que comprende un vector viral que permite expresar antígenos proteicos y un vector sintético que expresa antígenos proteicos. 5
Históricamente, los antígenos utilizados en las vacunas son bien microorganismos vivos cuyo poder patógeno se ha atenuado, o bien microorganismos muertos. Sin embargo, estas vacunas provocan a menudo efectos secundarios no deseables durante la administración y en raros casos complicaciones muy graves. De este modo, desde hace muchos años, para garantizar la seguridad vacunal, se privilegia el uso de fracciones purificadas de los 10 microorganismos en las vacunas. Tal inmunógeno, administrado solo, puede no inducir respuesta inmunosuficiente. Según la técnica anterior, se han desarrollado numerosas estrategias vacunales para aumentar u orientar la respuesta inmunitaria inducida por los inmunógenos purificados presentes en una vacuna.
La estrategia más directa consiste en asociar la sustancia proteica (inmunógeno) a un 15 adyuvante. Aunque numerosos tipos de adyuvantes estén en desarrollo, los hidróxidos de aluminio (alumbre) eran hasta hace poco el único adyuvante autorizado para una administración al hombre. Ahora bien, el alumbre es un adyuvante débil para la inducción de las respuestas humorales, no es apropiado para todos los antígenos y no permite obtener respuestas celulares. Entre los adyuvantes en desarrollo, los sistemas más eficaces para 20 inducir una fuerte inmunicidad son los vectores sintéticos a base de micropartículas y en particular las micropartículas de poli(lactido co glicolido) (PLGA) y poli(ácido láctico) (PLA). Debido a su dimensión, estas partículas permiten identificar células presentadoras de antígeno como los macrófagos o las células dendríticas y mejoran la toma a cargo del inmunógeno por el sistema inmunitario. La sustancia proteica se puede bien encapsular en micropartículas, bien 25 adsorber en la superficie. Los dos enfoques permiten inducir a la vez respuestas inmunocelulares y humorales, incluso si originariamente se utilizaban sobre todo para obtener una respuesta de anticuerpo. Sin embargo, la encapsulación presenta dos inconvenientes importantes. El primero es que es preciso una degradación parcial o total de la micropartícula para que la sustancia proteica se vuelva disponible para el sistema inmunitario, de este modo 30 se retrasa la puesta en práctica de la inmunidad. El segundo es que la sustancia proteica se puede desnaturalizar o degradar durante la encapsulación y de este modo perder sus propiedades inmunogénicas. Por estas razones, este procedimiento no se puede usar con cualquier tipo de sustancia proteica, mientras que el procedimiento por adsorción no presenta estos inconvenientes. En ambos casos, el obstáculo principal para su uso es su falta de 35 eficacia para generar respuestas celulares específicas. Si con respecto al alumbre las respuestas celulares inducidas son mucho mejores, están muy por debajo de lo que se puede obtener con un vector viral.
Los vectores virales recombinantes permiten que se exprese in vivo (en el animal o en el hombre) la sustancia proteica de interés. Se trata de una estrategia eficaz que permite una 5 fuerte movilización del sistema inmunitario. Pero la inducción de una respuesta inmune duradera en el tiempo necesita el uso de vectores vivos atenuados que pueden replicarse en el organismo vacunado. Ahora bien, por razones reglamentarias ligadas a la seguridad de uso de las vacunas, las nuevas generaciones de vacunas usan vectores virales no replicativos en el hombre, que conllevan una disminución de las respuestas inmunoespecíficas en el tiempo. De 10 este modo, en el caso de vacunas profilácticas, es a menudo todavía necesario reestimular la inmunidad específica para guardar una respuesta de memoria eficaz. En el ámbito de la inmunoterapia, la reestimulación de la inmunidad específica sigue siendo útil para mantener la intensidad de las respuestas inmunes que permiten controlar el organismo patógeno. De este modo, la administración repetida de vectores virales parece necesaria pero va acompañada de 15 un problema importante que es el de la inmunidad antivector. En efecto, el vector viral es él mismo un inmunógeno y puesto que se administra varias veces, aparece y a continuación aumenta la inmunidad específica del vector. Esta respuesta inmune que apunta a eliminar el vector viral impide también la expresión del gen que vehicula conllevando de este modo una disminución de la eficacia de las respuestas inmunes contra la sustancia proteica de interés. 20 Además, la inmunidad antivector impide el uso del vector en cuestión para vacunar contra otra enfermedad. Schagen y col. Describen algunos enfoques que permiten paliar esta inmunidad antivector tales como modificaciones al nivel del vector o también adaptaciones al nivel de los pacientes vacunados (2004, Critical Review in Oncology/Hematology 50 :51-70). Sin embargo, la aplicación de estos enfoques virales es difícil y no se puede realizar para todas las 25 enfermedades o todos los pacientes. Por lo tanto no se optimiza la estrategia que usa vectores virales.
Otra vía de mejora de la respuesta inmunoinducida por vacunación es la estrategia iniciador y refuerzo. Consiste en aumentar las respuestas inmunoespecíficas administrando secuencialmente dos vacunas diferentes que vehiculan una misma sustancia proteica en lugar 30 de administrar la misma vacuna varias veces. Por ejemplo, es posible usar un vector viral diferente a cada inyección (Negri DR, y col. 2004, Journal of General Virology, 85: 1191-1201). Sin embargo, esta estrategia tiene pocas posibilidades de éxito ya que el número de vectores virales cuyo empleo está autorizado en el hombre es muy limitado. Además, la administración repetida de estos vectores virales se encuentra de nuevo con el problema de la inmunidad 35 antivector. Con el fin de solucionar este problema, Otten y col. describen el uso de un ADN iniciador seguido de un refuerzo de micropartículas de PLGA en cuya superficie son adsorbidos antígenos proteicos (2003, Journal of Virology, 77 : 6087-6092) Sharpe y col. propusieron un ADN iniciador encapsulando el ADN en micropartículas basándose en PLGA y un refuerzo por un vector viral MVA (2003, Virology, 313: 13-21). O'hagan y col. Describen el 5 uso de un iniciador por ADN adsorbido sobre micropartículas de PLGA, seguido de un refuerzo por un vector de vacuna (2001, Journal of Virology, 75: 9037-9043). La solicitud de patente WO 98/56919A describe un ADN iniciador, seguido de un refuerzo por un poxvirus. El inconveniente del uso de un ADN iniciador es su baja eficacia especialmente en los primates y también cuando se trata de gen poco inmunógeno como por ejemplo el gen tat del VIH-1. La solicitud de 10 patente WO 98/569119A describe también el uso de un iniciador por VLP (“virus-like particles”), seguido de un refuerzo por un poxivirus. Las VLP son partículas virales defectuosas que no incorporan el genoma viral y que no pueden replicarse. Están a menudo formadas por autoensamblado de las proteínas estructurales de un virus o de un retrotransposón (elemento endógeno similar a un retrovirus) tales como el precursor Pr55 gag del VIH-1 o las proteínas 15 L1 o L2 del HPV-16 (papilomavirus humano). En función de las proteínas virales expresadas, la estructura de la VLP se puede acercar más o menos a la de virión nativo, de manera que las VLP se pueden comparar con un virus. El inconveniente de estas VLP es que proceden de la biotecnología y que su fabricación según las normas reglamentarias es muy difícil.
Los solicitantes han puesto ahora de manifiesto inesperadamente que la asociación 20 particular de un vector sintético coloidal bioresorbible que comprende antígenos proteicos y de un vector viral que comprende las secuencias nucleotídicas que codifican los antígenos proteicos correspondientes, permite aumentar la eficacia de la vacunación ligada al uso de un antígeno proteico, a la vez que reduce la inmunidad antivector.
De este modo un primer objeto de la invención consiste en una composición 25 farmacéutica que comprende o consiste en:
- un vector sintético coloidal constituido por micropartículas bioresorbibles no tóxicas que comprende un antígeno proteico o varios antígenos proteicos, y
- un vector viral que comprende al menos una secuencia nucleotídica que codifica uno o más antígenos proteicos comprendidos en el vector sintético 30
- eventualmente en asociación con un excipiente farmacéuticamente aceptable.
Otro... [Seguir leyendo]
Reivindicaciones:
1. Composición farmacéutica que comprende:
- un vector sintético coloidal constituido por micropartículas bioresorbibles no tóxicas que comprende un antígeno proteico o varios antígenos proteicos, y
- un vector viral que comprende al menos una secuencia nucleotídica que codifica 5 uno o más antígenos proteicos comprendidos en el vector sintético.
2. Composición según la reivindicación 1, caracterizado porque las micropartículas se preparan a partir al menos un polímero elegido entre los poli(ácidos α-hidroxilados),
3. Composición según la reivindicación 1, caracterizado porque las micropartículas se preparan a partir al menos un polímero natural. 10
4. Composición según las reivindicaciones 1 a 3, caracterizado porque las micropartículas
comprenden antígenos proteicos de tipos diferentes y constituyendo cada una un antígeno asociado a la misma enfermedad.
5. Composición según las reivindicaciones anteriores, caracterizado porque comprende, 15 como vector viral, un adenovirus o un poxvirus.
6. Composición según la reivindicación 5, caracterizado porque el poxvirus es el virus de la vacuna modificada de Ankara.
7. Composición según cualquiera de las reivindicaciones 1 a 6, caracterizado porque los antígenos proteicos son de origen viral. 20
8. Composición según la reivindicación 7, caracterizado porque los antígenos proteicos de origen viral son proteínas del virus VIH.
9. Composición según cualquiera de las reivindicaciones 1 a 6, caracterizada porque el antígeno proteico es un antígeno asociado a los tumores.
10. Uso de la composición tal como se define en las reivindicaciones 1 a 9 para la 25 preparación de una vacuna profiláctica o terapéutica.
11. Uso de la composición según la reivindicación 10 en el cual la vacuna es para la administración en el tratamiento o la prevención de las infecciones virales.
12. Uso de la composición según la reivindicación 10 en el cual la vacuna es para la administración en el tratamiento o la prevención de un cáncer. 30
13. Kit farmacéutico que comprende la composición según cualquiera de las reivindicaciones 1 a 9.
14. Kit farmacéutico según la reivindicación 13, para la administración simultánea, separada o escalonada del vector sintético y del vector viral.
15. Kit farmacéutico según la reivindicación 14, para la administración escalonada, siendo el vector sintético administrado antes que el vector viral.
Patentes similares o relacionadas:
Régimen de glicosidasa para el tratamiento de enfermedades infecciosas, del 15 de Abril de 2020, de Kline, Ellis: Una composición de glicosidasa de señalización inmunológica para uso en el tratamiento de un paciente que tiene una infección viral crónica, en donde un régimen […]
 Inmunógenos de anticuerpos ampliamente neutralizantes del VIH-1, métodos de generación y usos de los mismos, del 25 de Marzo de 2020, de INTERNATIONAL AIDS VACCINE INITIATIVE: Un inmunógeno 10E8 que consiste en la secuencia de aminoácidos:
**(Ver fórmula)**
Inmunógenos de anticuerpos ampliamente neutralizantes del VIH-1, métodos de generación y usos de los mismos, del 25 de Marzo de 2020, de INTERNATIONAL AIDS VACCINE INITIATIVE: Un inmunógeno 10E8 que consiste en la secuencia de aminoácidos:
**(Ver fórmula)**
Vacuna de trímero de Env VIH-1 bioquímicamente estabilizado, del 25 de Diciembre de 2019, de CHILDREN'S MEDICAL CENTER CORPORATION: Un trímero de gp140 de VIH que comprende un polipéptido gp140 de VIH que comprende una secuencia de aminoácidos al menos 95% idéntica a la secuencia: **(Ver secuencia)** […]
Tratamiento de trastornos inflamatorios, autoinmunitarios y neurodegenerativos con polipéptidos derivados de Tat inmunosupresores, del 4 de Septiembre de 2019, de PIN Pharma, Inc: Un polipéptido derivado del trans-activador de la transcripción (Tat) inmunosupresor, comprendiendo el polipéptido derivado de Tat una secuencia de aminoácidos que […]
Vectores víricos Isfahan recombinantes, del 10 de Julio de 2019, de THE BOARD OF REGENTS OF THE UNIVERSITY OF TEXAS SYSTEM: Un virus Isfahan competente en replicación, recombinante que comprende un gen de proteína N que codifica una proteína N que tiene una secuencia de aminoácidos […]
Procedimiento novedoso y composiciones, del 12 de Junio de 2019, de GLAXOSMITHKLINE BIOLOGICALS S.A.: Uno o más primeros polipéptidos inmunógenos para su uso en un procedimiento de generación de una respuesta inmunológica frente a Mycobacterium spp., en los […]
Vectores y construcciones de liberación de antígenos de virus de la gripe, del 8 de Mayo de 2019, de ALTIMMUNE UK LIMITED: Una construcción de vector fluorocarbonado-antígeno de estructura CmFN--CyHx-(Sp)-R, donde m = 3 a 30, n <= 2m + 1, y = 0 a 15, x <= 2y, […]
Vectores de transferencia de gen lentivírico y sus aplicaciones medicinales, del 11 de Abril de 2019, de INSTITUT PASTEUR: Una combinación de compuestos para su uso en el tratamiento terapéutico o profiláctico de una infección por un Virus de la Inmunodeficiencia en donde los […]