PROCEDIMIENTO DE ALMACENAMIENTO DE UN BANCO DE CÉLULAS VERO SIN SUERO.
Un medio de congelación de células sin suero, que consiste esencialmente en un medio sin suero de producción de virus (VP-SFM) complementado con (a) un hidrolizado enzimático crioestabilizante seleccionado del grupo que consiste en hidrolizado de soja e hidrolizado de arroz,
añadido a aproximadamente 2 g por litro de dicho medio, y (b) dimetilsulfóxido (DMSO)
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2004/041801.
Solicitante: WYETH LLC.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: FIVE GIRALDA FARMS MADISON, NJ 07940 ESTADOS UNIDOS DE AMERICA.
Inventor/es: ALLIKMETS,Ene, NICHOLS,Amy,Helen, PLUMMER,Dorothy,Jean.
Fecha de Publicación: .
Fecha Solicitud PCT: 10 de Diciembre de 2004.
Clasificación Internacional de Patentes:
- C12N5/00M2
Clasificación PCT:
- C12N5/00 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00).
- C12N5/07 C12N […] › C12N 5/00 Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00). › Células o tejidos animales.
- C12N7/00 C12N […] › Virus, p. ej. bacteriófagos; Composiciones que los contienen; Su preparación o purificación (preparaciones de uso médico que contienen virus A61K 35/76; preparación de composiciones de uso médico que contienen antígenos o anticuerpos virales, p. ej. vacunas virales, A61K 39/00).
Clasificación antigua:
- C12N5/00 C12N […] › Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00).
- C12N5/06
- C12N7/00 C12N […] › Virus, p. ej. bacteriófagos; Composiciones que los contienen; Su preparación o purificación (preparaciones de uso médico que contienen virus A61K 35/76; preparación de composiciones de uso médico que contienen antígenos o anticuerpos virales, p. ej. vacunas virales, A61K 39/00).
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
PDF original: ES-2360799_T3.pdf





Fragmento de la descripción:
Antecedentes de la invención
La presente invención se refiere a un medio de congelación de células sin suero y al uso de este medio en un procedimiento para generar bancos de células sin suero estables para la producción de vacunas virales.
El suero bovino fetal (FBS) es un agente crioestabilizante usado comúnmente en la generación de bancos de células. Sin embargo, los sistemas de cultivo que contienen suero se están volviendo indeseables para la producción de vacunas a gran escala. Existen varias desventajas para la complementación con suero, incluyendo la variación entre lotes en la composición, el alto contenido de proteína que dificulta la purificación de producto, y el potencial de contaminación por virus, micoplasmas o priones. Además, es probable que la reciente amenaza para la salud humana causada por los agentes no definidos de la encefalopatía espongiforme bobina (EEB) limite el uso continuo de suero bovino en procedimientos de cultivo usados para la síntesis de productos de asistencia sanitaria tales como vacunas virales [Butler, y col., Biotechnol. Prog., 16, 854-858 (2000)]. Por lo tanto, es necesario un agente crioestabilizante de origen no animal para sustituir el FBS.
Sumario de la invención
La presente invención proporciona un medio de congelación de células sin suero que consiste esencialmente en un medio sin suero de producción de virus (VP-SFM) complementado con (a) un hidrolizado enzimático crioestabilizante seleccionado del grupo que consiste en hidrolizado de soja e hidrolizado de arroz, añadido a aproximadamente 2 g por litro de dicho medio, y (b) dimetilsulfóxido (DMSO). En una realización, el medio de congelación de células sin suero se complementa con aproximadamente el 10% de DMSO.
La presente invención proporciona además el uso de este medio de congelación de células sin suero en un procedimiento que genera bancos de células maestros y de trabajo normalizados y uniformes, que se usan como material bruto en la producción de vacunas. Este procedimiento comprende las etapas de:
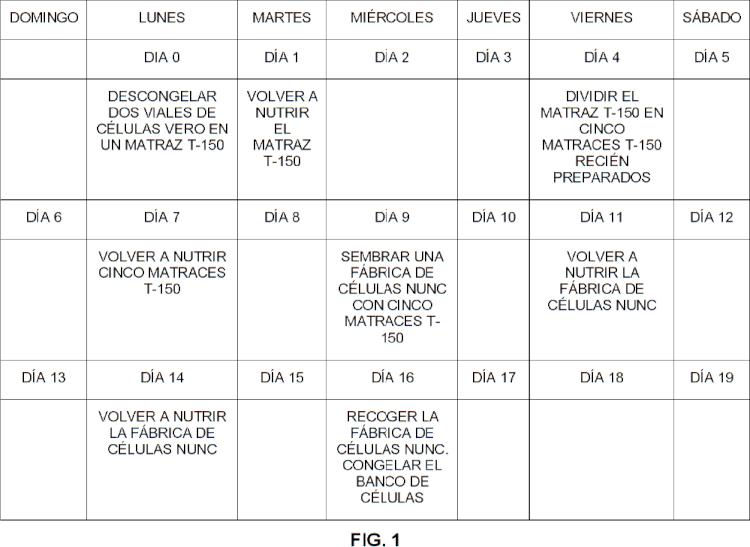
(a) iniciar un cultivo, que comprende descongelar células Vero congeladas y añadirlas a medios de cultivo en un matraz T-150 cm2, en el que el medio de cultivo consiste en VP-SFM con L-glutamina 4 mM, incubar las células durante una noche a 37 ºC y CO2 al 5%, y volver a nutrir el cultivo con medio de cultivo recién preparado al día siguiente;
(b) propagar y amplificar las células, lo que comprende cultivar las células hasta la confluencia en el matraz T150 cm2 incubado a 37 ºC y CO2 al 5%, retirar el medio, lavar el matraz con solución salina tamponada con fosfato (PBS) sin calcio ni magnesio, añadir tripsina al matraz e incubarlo a temperatura ambiente durante un tiempo suficiente para desprender las células del matraz, neutralizar la tripsina con inhibidor de tripsina de soja (STI) y añadir VP-SFM como sustento nutricional, sembrar la suspensión resultante en cinco matraces T-150 cm 2 y añadir VP-SFM a cada matraz a un nivel de 50 ml, incubar las células a 37 ºC y CO2 al 5% durante de tres a cuatro días, combinar las suspensiones de células de los cinco matraces, sembrar una fábrica de células con la suspensión combinada, volver a nutrir la fábrica de células y recoger la fábrica de células; y
(c) congelar el banco de células, lo que comprende centrifugar las células recogidas de la fábrica de células durante 10 minutos a 210 x g a 4 ºC, resuspender las células en el medio de congelación de células sin suero de la reivindicación 1 a una densidad de 2 x 106 a 2 x 107 células/ml, dispensar la suspensión de células en crioviales a un ml de suspensión de células por vial, congelar las células usando un congelador con control activo de la velocidad, y almacenar las células en nitrógeno líquido, en el que el banco de células Vero sin suero estable producido de este modo tiene una viabilidad celular de al menos el 80% y un tiempo de duplicación a la recuperación de entre 40 y 60 horas después de un año.
En una realización específica, este procedimiento comprenden las etapas de:
(a) iniciar un cultivo, que comprende descongelar 2 x 107 células Vero congeladas y añadirlas a 50 ml de medio de cultivo en un matraz T-150 cm² para obtener una densidad celular de 4-5 x 105 células/ml, en el que el medio de cultivo consiste en VP-SFM con L-glutamina 4 mM, incubar las células durante una noche a 37 ºC y CO2 al 5% y volver a nutrir el cultivo con medio de cultivo recién preparado al día siguiente;
(b) propagar y amplificar las células, lo que comprende cultivar las células hasta la confluencia en el matraz T150 cm² incubado a 37 ºC y CO2 al 5%, retirar el medio, lavar el matraz dos veces con 20 ml de solución salina tamponada con fosfato (PBS) sin calcio ni magnesio, añadir 5 ml de tripsina al matraz e incubarlo a temperatura ambiente durante un tiempo suficiente para desprender las células del matraz, neutralizar la tripsina con 5 ml de inhibidor de tripsina de soja (STI) y añadir 10 ml de VP-SFM como sustento nutricional, sembrar la suspensión resultante en cinco matraces T-150 cm2 a una concentración de 4 x 104 células/cm2 y añadir VP-SFM a cada matraz a un nivel de 50 ml, incubar las células a 37 ºC y CO2 al 5% durante de tres a cuatro días, combinar las suspensiones de células de los cinco matraces, sembrar una fábrica de células con la suspensión combinada, volver a nutrir la fábrica de células y recoger la fábrica de células; y
(c) congelar el banco de células, lo que comprende centrifugar las células recogidas de la fábrica de células durante 10 minutos a 210 x g a 4 ºC, resuspender las células en el medio de congelación de células sin suero
descrito anteriormente a una densidad de 1-2 x 107 células/ml, dispensar la suspensión de células en crioviales a 1 ml de suspensión de células por vial, congelar las células usando un congelador con control activo de la velocidad, y después almacenar las células en nitrógeno líquido, en el que el banco de células Vero sin suero estable producido de este modo tiene una viabilidad celular de al menos el 80% y un tiempo de duplicación a la recuperación de entre 40 y 60 horas después de un año.
La presente invención proporciona además un banco de células Vero sin suero estable para la producción de vacunas producido por el procedimiento descrito inmediatamente anteriormente, en el que el promedio de la viabilidad del banco de células es de al menos el 80% y el promedio del tiempo de duplicación a la recuperación es de entre 40 y 60 horas después de un año.
Breve descripción de los dibujos
La FIG. 1 es un esquema de aumento a escala para bancos de células de 100 viales. Los bancos de células de 200 viales y 400 viales siguen el mismo esquema, usando dos fábricas de células y cuatro fábricas de células, respectivamente. La FIG. 2 es una gráfica que compara las viabilidades celulares de bancos de células sin suero de 10 viales que contienen crioestabilizantes de origen vegetal con las de bancos de células que contienen FBS. La FIG. 3 es una gráfica que compara los tiempos de duplicación a la recuperación de bancos de células sin suero de 10 viales que contienen crioestabilizantes de origen vegetal con los de bancos de células que contienen FBS. La FIG. 4 es una gráfica que compara las viabilidades celulares de bancos de células a gran escala (100, 200 y 400 viales) que se generaron usando Hy-Soy® y HyPep® Rice como crioestabilizantes. La FIG. 5 es una gráfica que compara los tiempos de duplicación a la recuperación de bancos de células a gran escala (100, 200 y 400 viales) que se generaron usando Hy-Soy y HyPep Rice como crioestabilizantes.
Descripción detallada de la invención
La puesta en práctica de un procedimiento de generación de bancos de células normalizado y correcto es fundamental para el suministro de reservas de células con un rendimiento y características uniformes. La generación de bancos de células debería incluir un banco de células maestro de células fuente homogéneas y numerosos bancos de células de trabajo generados a partir del banco de células maestro. El número de viales de un banco dado variará dependiendo del uso deseado, pero un banco de células maestro típico puede contener 200 viales y un banco de células de trabajo típico puede contener hasta 400 viales, utilizando el procedimiento de generación de bancos de la presente invención. Este procedimiento asegura un suministro a largo plazo de células normalizadas que proporcionarán un sustrato estable para una producción uniforme.
Las células Vero (células de riñón de mono verde africano... [Seguir leyendo]
Reivindicaciones:
1. Un medio de congelación de células sin suero, que consiste esencialmente en un medio sin suero de producción de virus (VP-SFM) complementado con (a) un hidrolizado enzimático crioestabilizante seleccionado del grupo que consiste en hidrolizado de soja e hidrolizado de arroz, añadido a aproximadamente 2 g por litro de dicho medio, y (b) dimetilsulfóxido (DMSO).
2. El medio de congelación de células sin suero de la reivindicación 1, que está complementado con aproximadamente el 10% de DMSO.
3. Un procedimiento para generar un banco de células Vero sin suero estable, comprendiendo dicho procedimiento las etapas de:
(a) iniciar un cultivo, que comprende descongelar células Vero congeladas y añadirlas a medio de cultivo en un matraz T-150 cm2, en el que el medio de cultivo consiste en VP-SFM con L-glutamina 4 mM, incubar las células durante una noche a aproximadamente 37 ºC y CO2 al 5%, y volver a nutrir el cultivo con medio de cultivo recién preparado al día siguiente;
(b) propagar y amplificar las células, lo que comprende cultivar las células hasta la confluencia en el matraz T-150 cm 2 incubado a 37 ºC y CO2 al 5%, retirar el medio, lavar el matraz con solución salina tamponada con fosfato (PBS) sin calcio ni magnesio, añadir tripsina al matraz e incubarlo a temperatura ambiente durante un tiempo suficiente para desprender las células del matraz, neutralizar la tripsina con inhibidor de tripsina de soja (STI) y añadir VP-SFM como sustento nutricional, sembrar la suspensión resultante en cinco matraces T-150 cm2 y añadir VP-SFM a cada matraz a un nivel de 50 ml, incubar las células a aproximadamente 37 ºC y CO2 al 5% durante de tres a cuatro días, combinar las suspensiones de células de los cinco matraces, sembrar una fábrica de células con la suspensión combinada, volver a nutrir la fábrica de células y recoger la fábrica de células; y
(c) congelar el banco de células, lo que comprende centrifugar las células recogidas de la fábrica de células durante 10 minutos a 210 x g a 4 ºC, resuspender las células en el medio de congelación de células sin suero de la reivindicación 1 a una densidad de 2 x 106 a 2 x 107 células/ml, dispensar la suspensión de células en crioviales a un ml de suspensión de células por vial, congelar las células usando un congelador con control activo de la velocidad, y almacenar las células en nitrógeno líquido, en el que el banco de células Vero sin suero estable producido de este modo tiene una viabilidad celular de al menos el 80% y un tiempo de duplicación a la recuperación de entre 40 y 60 horas después de un año.
4. Un procedimiento para generar un banco de células Vero sin suero estable de acuerdo con la reivindicación 3, comprendiendo dicho procedimiento las etapas de:
(a) iniciar un cultivo, que comprende descongelar 2 x 107 células Vero congeladas y añadirlas a 50 ml de medio de cultivo en un matraz T-150 cm² para obtener una densidad celular de 4-5 x 105 células/ml, en el que el medio de cultivo consiste en VP-SFM con L-glutamina 4 mM, incubar las células durante una noche a 37 ºC y CO2 al 5%, y volver a nutrir el cultivo con medio de cultivo recién preparado al día siguiente;
(b) propagar y amplificar las células, lo que comprende cultivar las células hasta la confluencia en el matraz T-150 cm² incubado a 37 ºC y CO2 al 5%, retirar el medio, lavar el matraz dos veces con 20 ml de solución salina tamponada con fosfato (PBS) sin calcio ni magnesio, añadir 5 ml de tripsina al matraz e incubarlo a temperatura ambiente durante un tiempo suficiente para desprender las células del matraz, neutralizar la tripsina con 5 ml de inhibidor de tripsina de soja (STI) y añadir 10 ml de VP-SFM modificado como sustento nutricional, sembrar la suspensión resultante en cinco matraces T-150 cm2 a una concentración de 4 x 104 células/cm2 y añadir VP-SFM a cada matraz a un nivel de 50 ml, incubar las células a 37 ºC y CO2 al 5% durante de tres a cuatro días, combinar las suspensiones de células de los cinco matraces, sembrar una fábrica de células con la suspensión combinada, volver a nutrir la fábrica de células y recoger la fábrica de células; y
(c) congelar el banco de células, lo que comprende centrifugar las células recogidas de la fábrica de células durante 10 minutos a 210 x g a 4 ºC, resuspender las células en el medio de congelación de células sin suero de la reivindicación 2 a una densidad de 1-2 x 107 células/ml, dispensar la suspensión de células en crioviales a un ml de suspensión de células por vial, congelar las células usando un congelador con control activo de la velocidad, y almacenar las células en nitrógeno líquido, en el que el banco de células Vero sin suero estable producido de este modo tiene una viabilidad celular de al menos el 80% y un tiempo de duplicación a la recuperación de entre 40 y 60 horas después de un año.
5. El medio de congelación de células sin suero de la reivindicación 1 ó 2, en el que el hidrolizado enzimático crioestabilizante es un hidrolizado de soja.
6. El medio de congelación de células sin suero de la reivindicación 1 ó 2, en el que el hidrolizado enzimático crioestabilizante es un hidrolizado de arroz.
7. Un banco de células Vero estable que tiene una viabilidad celular de al menos el 80% y un tiempo de duplicación a la recuperación de entre 40 y 60 horas después de un año de congelación, en el que el banco de células está libre de productos de origen animal, y en el que el banco de células se genera usando un hidrolizado enzimático crioestabilizante que comprende un hidrolizado de soja o un hidrolizado de arroz.
Patentes similares o relacionadas:
MEDIO DE CULTIVO DE CÉLULAS EXENTO DE SUERO PARA MAMÍFEROS, del 20 de Junio de 2011, de ARES TRADING S.A.: Un procedimiento para la producción de hormona del crecimiento, que comprende la etapa de cultivar células de una línea celular que expresa hormona del […]
Métodos mejorados para la preparación de escualeno, del 15 de Julio de 2020, de NOVARTIS AG: Un procedimiento para la preparación de escualeno a partir de una composición que comprende escualeno a partir de una fuente animal, dicho procedimiento comprendiendo […]
Señal para el empaquetamiento de vectores del virus de la gripe, del 24 de Junio de 2020, de WISCONSIN ALUMNI RESEARCH FOUNDATION: Un vector del virus de la gripe para la expresión y empaquetamiento de ARNv recombinante, en el que el vector comprende: secuencias correspondientes […]
Nueva especie de tobamovirus, del 17 de Junio de 2020, de Nunhems B.V: Un tobamovirus cuyo genoma comprende al menos 83% de identidad de secuencia con la SEQ ID NÚM.: 1 y en el que el virus causa síntomas sistémicos en plantas homocigotas […]
Vectores de AAV dirigidos a oligodendrocitos, del 10 de Junio de 2020, de THE UNIVERSITY OF NORTH CAROLINA AT CHAPEL HILL: Un ácido nucleico que codifica una cápside de AAV, comprendiendo el ácido nucleico una secuencia codificante de la cápside de AAV que es al menos el 96 % idéntica […]
Métodos para la transducción y el procesamiento de células, del 27 de Mayo de 2020, de Juno Therapeutics, Inc: Un método de transducción, que comprende incubar, en una cavidad interna de una cámara de centrífuga, una composición de entrada que comprende células y partículas […]
Composiciones para tratar MPSI, del 22 de Abril de 2020, de THE TRUSTEES OF THE UNIVERSITY OF PENNSYLVANIA: Un vector que lleva un casete de expresión que comprende un gen de la alfa-L-iduronidasa humana (hIDUA) que tiene la secuencia de nucleótidos de SEQ ID NO: […]
Métodos mejorados para producir terapias celulares adoptivas, del 22 de Abril de 2020, de Bluebird Bio, Inc: Un método in vitro para producir un producto terapéutico de células T que comprende: a) proporcionar una población de células mononucleares […]