PRODUCTOS HIBRIDOS GLICOSILADOS Y SU PRODUCCION Y UTILIZACION.
Procedimiento para producir un producto glicosilado híbrido mediante la transferencia de una o varias fracciones de azúcar a una plantilla aglicona,
comprendiendo el procedimiento:
a) eliminar o inactivar uno o más genes en una célula huésped de microorganismo implicada en el procesamiento de una plantilla de aglicona endógena de manera que se suprime la producción de un producto natural glicosilado mediante dicha célula huésped de microorganismo;
b) transformar dicha célula huésped de microorganismo con ácido nucleico que codifica una glicosiltransferasa (GT), y,
c) proporcionar una plantilla de aglicona exógena a la GT de manera que la GT transfiere una o más fracciones de azúcar a la plantilla de aglicona exógena para producir un producto híbrido glicosilado;
en el que una o más de la fracción o fracciones de azúcar, la plantilla de aglicona exógena, la GT o la célula huésped es heteróloga con los otros componentes
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/GB01/01743.
Solicitante: BIOTICA TECHNOLOGY LIMITED.
Nacionalidad solicitante: Reino Unido.
Dirección: 112 HILLS ROAD,CAMBRIDGE, CAMBRIDGESHIRE C.
Inventor/es: LEADLAY, PETER, FRANCIS, STAUNTON, JAMES, GAISSER,SABINE.
Fecha de Publicación: .
Fecha Concesión Europea: 30 de Diciembre de 2009.
Clasificación Internacional de Patentes:
- C07H17/08F
- C12N15/52 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Genes que codifican enzimas o proenzimas.
- C12N9/10D
- C12P19/62 C12 […] › C12P PROCESOS DE FERMENTACION O PROCESOS QUE UTILIZAN ENZIMAS PARA LA SINTESIS DE UN COMPUESTO QUIMICO DADO O DE UNA COMPOSICION DADA, O PARA LA SEPARACION DE ISOMEROS OPTICOS A PARTIR DE UNA MEZCLA RACEMICA. › C12P 19/00 Preparación de compuestos que contienen radicales sacárido (ácido cetoaldónico C12P 7/58). › teniendo el heterociclo al menos ocho miembros y sólo oxígeno como heteroátomo del ciclo, p. ej. eritromicina, espiramicina, nistatina.
Clasificación PCT:
- C07H17/08 C […] › C07 QUIMICA ORGANICA. › C07H AZUCARES; SUS DERIVADOS; NUCLEOSIDOS; NUCLEOTIDOS; ACIDOS NUCLEICOS (derivados de ácidos aldónicos o sacáricos C07C, C07D; ácidos aldónicos, ácidos sacáricos C07C 59/105, C07C 59/285; cianohidrinas C07C 255/16; glicales C07D; compuestos de constitución indeterminada C07G; polisacáridos, sus derivados C08B; ADN o ARN concerniente a la ingeniería genética, vectores, p. ej. plásmidos o su aislamiento, preparación o purificación C12N 15/00; industria del azúcar C13). › C07H 17/00 Compuestos que contienen radicales heterocíclicos unidos directamente a los heteroátomos de los radicales sacárido. › Heterociclos que contienen ocho o más miembros cíclicos, p. ej. eritromicinas.
- C12N1/00 C12N […] › Microorganismos, p.ej. protozoos; Composiciones que los contienen (preparaciones de uso médico que contienen material de protozoos, bacterias o virus A61K 35/66, de algas A61K 36/02, de hongos A61K 36/06; preparación de composiciones de uso médico que contienen antígenos o anticuerpos bacterianos, p. ej. vacunas bacterianas, A61K 39/00 ); Procesos de cultivo o conservación de microorganismos, o de composiciones que los contienen; Procesos de preparación o aislamiento de una composición que contiene un microorganismo; Sus medios de cultivo.
- C12N1/21 C12N […] › C12N 1/00 Microorganismos, p.ej. protozoos; Composiciones que los contienen (preparaciones de uso médico que contienen material de protozoos, bacterias o virus A61K 35/66, de algas A61K 36/02, de hongos A61K 36/06; preparación de composiciones de uso médico que contienen antígenos o anticuerpos bacterianos, p. ej. vacunas bacterianas, A61K 39/00 ); Procesos de cultivo o conservación de microorganismos, o de composiciones que los contienen; Procesos de preparación o aislamiento de una composición que contiene un microorganismo; Sus medios de cultivo. › modificados por la introducción de material genético extraño.
- C12N15/54 C12N 15/00 […] › Transferasas (2).
- C12N15/76 C12N 15/00 […] › para Actinomyces; para Streptomyces.
- C12P19/00 C12P […] › Preparación de compuestos que contienen radicales sacárido (ácido cetoaldónico C12P 7/58).
- C12P19/62 C12P 19/00 […] › teniendo el heterociclo al menos ocho miembros y sólo oxígeno como heteroátomo del ciclo, p. ej. eritromicina, espiramicina, nistatina.
Clasificación antigua:
- C07H17/08 C07H 17/00 […] › Heterociclos que contienen ocho o más miembros cíclicos, p. ej. eritromicinas.
- C12N1/00 C12N […] › Microorganismos, p.ej. protozoos; Composiciones que los contienen (preparaciones de uso médico que contienen material de protozoos, bacterias o virus A61K 35/66, de algas A61K 36/02, de hongos A61K 36/06; preparación de composiciones de uso médico que contienen antígenos o anticuerpos bacterianos, p. ej. vacunas bacterianas, A61K 39/00 ); Procesos de cultivo o conservación de microorganismos, o de composiciones que los contienen; Procesos de preparación o aislamiento de una composición que contiene un microorganismo; Sus medios de cultivo.
- C12N1/21 C12N 1/00 […] › modificados por la introducción de material genético extraño.
- C12N15/54 C12N 15/00 […] › Transferasas (2).
- C12N15/76 C12N 15/00 […] › para Actinomyces; para Streptomyces.
- C12P19/00 C12P […] › Preparación de compuestos que contienen radicales sacárido (ácido cetoaldónico C12P 7/58).
- C12P19/62 C12P 19/00 […] › teniendo el heterociclo al menos ocho miembros y sólo oxígeno como heteroátomo del ciclo, p. ej. eritromicina, espiramicina, nistatina.
Fragmento de la descripción:
Productos híbridos glicosilados y su producción y utilización.
Campo de la invención
La presente invención se refiere a productos híbridos glucosilados, y, en particular, a productos naturales, tales como poliquétidos y glucopéptidos, y a procedimientos para su preparación. La invención se refiere especialmente a células recombinantes en las que una glicosiltransferasa microbiana clonada puede ser convenientemente probada para su capacidad para generar derivados glicosilados específicos cuando se suministran con poliquétidos, péptidos, o poliquetidos-péptidos como sustratos.
Antecedentes de la invención
La glicosilación es importante para la bioactividad de muchos productos naturales, incluidos los compuestos antibacterianos tales como la eritromicina de poliquétido A y la vancomicina de glucopéptido, y sus compuestos antitumorales tales como la daunorubicina de poliquétido aromática y la bleomicina glucopéptido-poliquétido. Los poliquétidos son una clase grande y estructuralmente diversa de productos naturales que incluye muchos compuestos que poseen propiedades antibióticas o farmacológicas de otro tipo, tal como eritromicina, tetraciclinas, rapamicina, avermectina, monensina, epotilonas y FK506. En particular, los poliquétidos son abundantemente producidos por Streptomyces actinomicetos y bacterias relacionadas. Son sintetizados por la condensación paso a paso repetida de aciltioésteres de una manera análoga a la de la biosíntesis de ácidos grasos. La mayor diversidad estructural encontrada entre los poliquétidos natural surge de la selección del acetato (usualmente), o del propionato como unidades "iniciadoras" o "extensoras", y de la existencia de distintos grados de transformación del grupo ß-ceto observado después de cada condensación. Ejemplos de etapas de procesamiento incluyen la reducción de ß-hidroxiacil-, reducción seguida por la deshidratación de 2-enoil-, y la reducción completa del aciltioéster saturado. El resultado estereoquímico de estas etapas de transformación también se especifica para cada ciclo de extensión de la cadena. Las cadenas de poliquétidos suelen ciclarse de manera específica y someterse a modificaciones adicionales de la enzima-catalizador para producir el poliquétido final. Los péptidos que se producen de manera natural producidos mediante sintetasas de péptido no ribosomales también se sintetizan mediante montaje paso a paso repetido, en este caso de aminoácidos activados, y las cadenas producidas son igualmente objeto de modificaciones adicionales para producir moléculas plenamente bioactivas. Los compuestos mezclados de poliquétido-péptido, denominado en lo sucesivo como incorporación de unidades de quétido y de aminoácidos, también son conocidos, y su bioactividad también está influenciada por su patrón de glicosilación y otras modificaciones. Los compuestos así producidos son especialmente valiosos, ya que incluyen un gran número de compuestos de utilidad conocida, por ejemplo, como antihelmínticos, insecticidas, inmunosupresores, agentes antifúngicos o antibacterianos.
Los Streptomyces y géneros estrechamente relacionados de bacterias filamentosas son productores abundantes de metabolitos de poliquétidos. Aunque un gran número de poliquétidos terapéuticamente importantes han sido identificados, sigue habiendo una necesidad de obtener poliquétidos nuevos que tengan propiedades mejoradas o que tengan una bioactividad completamente nueva. El aumento inexorable de la incidencia de organismos patógenos con resistencia a antibióticos como los macrólidos de 14 miembros o glucopéptidos representa una amenaza significativa para la salud humana y animal. Los procedimientos actuales de obtención de metabolitos de poliquétidos nuevos incluyen el cribado a gran escala de cepas de origen natural de Streptomyces y otros organismos, ya sea para la producción directa de moléculas útiles, o por la presencia de actividades enzimáticas que pueden bioconvertir un poliquétido existente, que se añade al medio de cultivo, en derivados específicos. Estos procedimientos son lentos y costosos, y la biotransformación utilizando células enteras puede además estar limitada por las reacciones colaterales o por una baja concentración o actividad de la enzima intracelular responsable de la bioconversión. Dada la complejidad de los poliquétidos bioactivos, que no son fácilmente susceptibles a la síntesis química total a gran escala. La modificación química de poliquétidos existentes ha sido ampliamente utilizada, pero muchas alteraciones deseables no son fácilmente alcanzables por este medio.
Mientras tanto, se han desarrollado procedimientos para la biosíntesis de poliquétidos alterados y de polipéptidos no ribosomalmente sintetizados mediante ingeniería de los correspondientes genes que codifican las sintetasas de poliquétidos y las sintetasas de polipéptidos, respectivamente. La biosíntesis de poliquétidos se inicia mediante un grupo de las enzimas que forman la cadena, conocidas como sintasas de poliquétidos. Dos clases de sintasa de poliquétidos (PKS) se han descrito en actinomicetos. Una clase, llamada PKSs tipo I, representada por la PKSs para los macrólidos eritromicina, oleandomicina, avermectina y rapamicina, se compone de un conjunto diferente o "módulo de extensión" de las enzimas para cada ciclo de extensión de la cadena de poliquétidos (Cortés, J. et al. Nature (1990) 348:176-178). El término "módulo de extensión" tal como se usa aquí se refiere al conjunto de dominios contiguos, de un dominio sintasa ß-cetoacil-ACP ("KS") al siguiente dominio de proteína transportadora de acilo ("ACP"), que realiza un ciclo de extensión de la cadena de poliquétidos.
La supresión en marco de ADN que codifica parte del dominio de quetoreductasa en el módulo 5 de la eritromicina que produce PKS (también conocida como sintasa de 6-deoxieritronolido B, DEBS) se ha demostrado que conducen a la formación de análogos de la eritromicina 5,6-dideoxi-3-a-micarosil-5-oxoeritronolido B, 5,6-dideoxi-5-oxoeritronolido B y 5,6-dideoxi, 6 ß-epoxi-5-B oxoeritronolido (Donadio, S. et al Science (1991) 252:675-679). Del mismo modo, la alteración de los residuos del sitio activo en el dominio de enoilreductasa del módulo 4 en DEBS, mediante ingeniería genética del correspondiente ADN que codifica PKS y su introducción en Erythraea Saccharopolyspora, condujo a la producción de 6,7-anhidroeritromicina C (Donadio, S. et al. Proc Natl. Acad. Sci. EE.UU. (1993) 90:7119-7123). El documento WO 93/13663 describe otros tipos de manipulación genética de los genes DEBS que son capaces de producir poliquétidos alterados. Sin embargo, muchos de estos intentos se han indicado que han sido improductivos (Hutchinson, C. R. y Fujii, I. Annu. Rev. Microbiol. (1995) 49:201-238, en p. 231).
El documento WO 98/01546 describe la ingeniería de genes PKS de tipo híbrido que utiliza porciones de genes PKS derivados de más de un PKS natural, en particular procedentes de diferentes organismos, y el uso de estos genes recombinantes para la producción de metabolitos de poliquétidos alterados.
La segunda clase de PKS, denominada PKSs Tipo II, está representado por las sintasas de compuestos aromáticos. PKSs Tipo II sólo contienen un único conjunto de actividades enzimáticas de la extensión de la cadena y estos son reutilizadas en ciclos sucesivos (Bibb, M. J. et al. EMBO J. (1989) 8:2727-2736; Sherman, D. H. et al. EMBO J. (1989) 8:2717-2725; Fernández-Moreno, M.A. et al. J. Biol. Chem. (1992) 267:19278-19290). Las unidades "extendedoras" de la pKSs tipo II suelen ser unidades de acetato, y la presencia de ciclasas específicas dicta la vía preferida para la ciclación de la cadena completa en un producto aromático (Hutchinson, C. R. y Fujii, I. Annu. Rev. Microbiol. (1995) 49:201-238). Poliquétidos híbridos han sido obtenidos mediante la introducción de clones de ADN que contiene genes PKS tipo II en otra cepa que contiene una agrupación de genes PKS tipo II diferente, por ejemplo mediante la introducción de ADN derivado de la agrupación de genes para actinorhodina, de un poliquétido pigmentado azul de Streptomyces coelicolor, en una cepa que produce poliquétidos de antraquinona de Streptomyces galileus (Bartel, P. L. et al. J. Bacteriol. (1990) 172:4816-4826).
El número mínimo de campos necesarios para la extensión de la cadena de poliquétido PKS Tipo II cuando se expresa en una célula huésped Streptomyces coelicolor (el "PKS mínimo") se ha definido por ejemplo, en el documento WO 95/08548 que contiene los siguientes tres polipéptidos que son productos...
Reivindicaciones:
1. Procedimiento para producir un producto glicosilado híbrido mediante la transferencia de una o varias fracciones de azúcar a una plantilla aglicona, comprendiendo el procedimiento:
a) eliminar o inactivar uno o más genes en una célula huésped de microorganismo implicada en el procesamiento de una plantilla de aglicona endógena de manera que se suprime la producción de un producto natural glicosilado mediante dicha célula huésped de microorganismo;
b) transformar dicha célula huésped de microorganismo con ácido nucleico que codifica una glicosiltransferasa (GT), y,
c) proporcionar una plantilla de aglicona exógena a la GT de manera que la GT transfiere una o más fracciones de azúcar a la plantilla de aglicona exógena para producir un producto híbrido glicosilado;
en el que una o más de la fracción o fracciones de azúcar, la plantilla de aglicona exógena, la GT o la célula huésped es heteróloga con los otros componentes.
2. Procedimiento según la reivindicación 1, en el que la plantilla de aglicona exógena y la fracción o fracciones de azúcar son heterólogas entre sí.
3. Procedimiento según la reivindicación 1, en el que la plantilla de aglicona exógena y/o la fracción o fracciones de azúcar son heterólogas con la célula huésped.
4. Procedimiento según la reivindicación 1, en el que la plantilla de aglicona exógena, la fracción o fracciones de azúcar y la GT son heterólogas con la célula huésped.
5. Procedimiento según cualquiera de las reivindicaciones 1 a 4, en el que la célula huésped se transforma con un gen o genes para producir la fracción de azúcar.
6. Procedimiento según cualquiera de las reivindicaciones anteriores, que también comprende la utilización de un enzima para modificar la fracción de azúcar y/o la plantilla de aglicona, ya sea antes o después de la unión de la fracción de azúcar a la plantilla de aglicona.
7. Procedimiento según la reivindicación 6, en el que la enzima es una metiltransferasa.
8. Procedimiento según la reivindicación 6 o reivindicación 7, en el que la célula huésped se transforma con un gen heterólogo que codifica dicha enzima.
9. Procedimiento según una cualquiera de las reivindicaciones anteriores, en el que el plantilla de aglicona exógena se selecciona del grupo que consiste en un poliquétido, un poliquétido-péptido mixto y un péptido.
10. Procedimiento según cualquiera de las reivindicaciones anteriores, que también comprende eliminar o inactivar uno o más genes en las células huésped de microorganismo que participan en la producción de la plantilla de aglicona endógena, suprimiendo o alterando así la producción de la plantilla o producto de aglicona endógena.
11. Producto glucosilado híbrido seleccionado del grupo consistente en:
(a) una o más ramnosa o azúcares de ramnosa sustituidos unidos a un tilactona;
(b) una o más micarosa o azúcares de micarosa sustituidos unidos a un eritronolido o una eritromicina;
(c) una o más micaminosa o azúcares de micaminosa sustituidos unidos a un eritronolido, una eritromicina, o una tilactona;
(d) una o más glucosa o azúcares de glucosa sustituidos unidos a una tilactona;
(e) una o más desosaminosa o azúcares de desosaminosa sustituidos unidos a una tilactona;
(f) combinaciones de (b) y (c) sobre un eritronolido o una eritromicina, y
(g) las combinaciones (a), (c), (d) y (e) en una tilactona.
12. Compuesto seleccionado entre el grupo formado por:
3-O-(2'-O-metilramnosil) eritronolido B,
3-O-(2',3'-bis-O-metilramnosil) eritronolido B,
3-O-(2',3',4'-tris-O-metilramnosil) eritronolido B,
8a-hidroxi-3-O-micarosil eritronolido B,
8,8a-epoxi-3-O-micarosil eritronolido B,
8,8a-dehidro-6-deoxieritronolido B,
8-hidroxi-6-deoxieritronolido B,
3-O-(2'-O-metilramnosil) eritromicina D,
3-O-(2',3'-bis-O-metilramnosil) eritromicina D,
3-O-(2',3'4'-tris-O-metil ramnosil) eritromicina D,
5-O-micaminosil-(4'-O-micarosil-)eritromicina A,
5-O-glucosilo-tilactona,
23-O-ramnosil 5-0-tilactona micaminosil,
5-O(2'-O)-bis-glucosilo-tilactona,
3-O-ramnosil-8,8a-dehidro-6-deoxieritronolido B,
3-O-ramnosil-8,8a-dihidroxi-B eritronolido,
3,5 di-O-micarosil eritronolido B,
3-O-ramnosil-8,8 bis dihidroxi-6-deoxieritronolido B,
8,8a-epoxi-3-O-ramnosileritronolido B,
8,8a-hi droxi -3-O-mi caro sileritronolido B,
3-O-(2'3'bis-O-metilramnosil)-6-deoxieritronolido B,
3-O-(2'-O-metilramnosil)-6-deoxieritronolido B,
5-O-micaminosileritromicina A,
23-hidroxi-5-O-micaminosil tilactona,
8,8a-epoxi-6-deoxieritronolido B, y
8,8a dihidroxi-6-deoxieritronolido B.
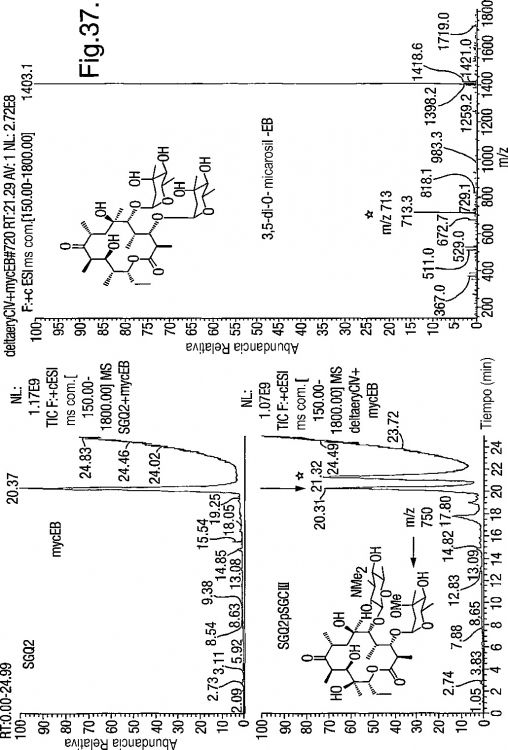
13. Compuesto según la reivindicación 12, en el que el compuesto es 3,5 di-O-eritronolido micarosil B.
14. Célula de microorganismo huésped, en la que uno o más genes implicados en el procesamiento de una plantilla de aglicona endógena se han eliminado o inactivado de tal manera que se suprime la producción de un producto endógeno glicosilado, y en la que dicha célula huésped se transforma con ácido nucleico que codifica una glucosiltransferasa (GT), en el que la GT es heteróloga de la célula huésped y transfiere una o más fracciones de azúcar en una plantilla de aglicona exógena se proporcionan a las células para producir un producto híbrido glicosilado, y en la que la célula huésped también se transforma con uno o más genes auxiliares que comprenden un gen de vía de azúcar que codifica una proteína implicada en la biosíntesis de una fracción de azúcar, permitiendo así que una célula huésped transformada con el casete de expresión produzca fracciones de azúcar para su posterior transferencia a una plantilla de aglicona exógena.
15. Célula huésped según la reivindicación 14, en la que uno o más genes implicados en la producción de una plantilla de aglicona endógena se han eliminado o inactivado de tal manera que se suprime la producción de una plantilla de aglicona endógena.
16. Célula huésped según la reivindicación 14 ó 15, en la que los genes auxiliares comprenden una enzima para modificar la fracción de azúcar y/o la plantilla de aglicona exógena, antes o después de la unión de la fracción de azúcar con la plantilla de aglicona exógena.
17. Célula huésped según la reivindicación 16, en la que la enzima es una metiltransferasa.
18. Célula huésped según cualquiera de las reivindicaciones 14 a 17, que es una cepa de actinomiceto.
19. Célula huésped según la reivindicación 18, en la que la cepa de actinomiceto se seleccionada del grupo formado por Saccharopolyspora erythraea, Streptomyces coelicolor, Streptomyces avermitilis, Streptomyces griseofuscus, Streptomyces cinnamonensis, Streptomyces fradiae; Streptomyces longisporoflavus, Streptomyces hygroscopicus, Micromonospora griseorubida, Streptomyces lasaliensis, Streptomyces venezuelae, Streptomyces antibioticus, Streptomyces lividans, Streptomyces rimosus, Streptomyces albus, Amycolatopsis mediterranei, y Streptomyces tsukubaensis.
20. Procedimiento para producir un producto híbrido glucosilado, comprendiendo el procedimiento:
cultivar la célula huésped según cualquiera de las reivindicaciones 14 a 22, en el que la célula huésped está provista de una plantilla de aglicona exógena, y
aislar el producto así producido.
21. Procedimiento para producir una librería que comprende una pluralidad de productos híbridos glicosilados, comprendiendo el procedimiento:
a) eliminar o inactivar uno o más genes en una célula huésped de microorganismo implicada en el procesamiento de una plantilla de aglicona endógena de manera que se suprime la producción de un producto natural glicosilado mediante dicha célula huésped de microorganismo;
b) transformar dicha célula huésped de microorganismo con ácido nucleico que codifica una o más glucosiltransferasas (GT); y
c) proporcionar una o más plantillas de aglicona exógena a las GTs de manera que las GTs transfieren una o más fracciones de azúcar a la plantilla de aglicona exógena para producir dicha pluralidad de productos híbridos glicosilados;
en el que uno o más de la fracción o fracciones de azúcar, la plantilla de aglicona exógena, la glicosiltransferasa o las células huésped es heteróloga con los otros componentes.
22. Procedimiento según la reivindicación 21, en el que la célula huésped también se transforma con uno o más genes auxiliares.
23. Procedimiento según la reivindicación 22, en el que dicho uno o más genes auxiliares comprenden un gen de vía de azúcar que codifica una proteína implicada en la biosíntesis de una fracción de azúcar, lo que permite que una célula huésped transformada con el casete de expresión produzca fracciones de azúcar para su posterior transferencia a la plantilla de aglicona exógena.
24. Procedimiento según las reivindicaciones 21 ó 23, en el que los genes auxiliares comprenden una enzima para modificar la fracción de azúcar y/o la plantilla de aglicona exógena, antes o después de la unión de la fracción de azúcar a la plantilla de aglicona exógena.
25. Procedimiento según la reivindicación 24, en el que la enzima es una metiltransferasa.
26. Procedimiento según una cualquiera de las reivindicaciones 21 a 25, que también comprende cribar la librería para un producto híbrido glucosilado que tiene una característica deseada.
27. Procedimiento según una cualquiera de las reivindicaciones 21 a 26, que también comprende aislar una célula huésped que produce un producto glicosilado híbrido deseado.
28. Procedimiento según la reivindicación 27, que también comprende cultivar las células huésped y aislar el producto glicosilado híbrido así producido.
29. Procedimiento según cualquiera de las reivindicaciones 21 a 28, en el que la biosíntesis endógena de poliquétidos se suprime mediante la mutación, supresión o inactivación de uno o más de los genes PKS presentes de forma natural en las células.
Patentes similares o relacionadas:
PRODUCCIÓN BIOTECNOLÓGICA DE D-DIBOA Y SUS DERIVADOS CLORADOS A PARTIR DE SUS PRECURSORES NITROFENOXIDO-ACETATO, del 7 de Julio de 2020, de UNIVERSIDAD DE CADIZ: Producción biotecnológica de D-Diboa y sus derivados clorados a partir de sus precursores nitrofenoxido-acetato. El área científica al que corresponde la invención es la […]
Agrupación de genes de biosíntesis de carrimicina, del 27 de Mayo de 2020, de Shenyang Fuyang Pharmaceutical Technology Co., Ltd: Agrupación de genes de biosíntesis de carrimicina, que consiste en 44 genes que comprende: 1) cinco genes de policétido sintasa, incluyendo los residuos […]
Fábrica de células bacterianas modificadas genéticamente para la producción de tiamina, del 22 de Abril de 2020, de Biosyntia ApS: Bacteria modificada genéticamente para la producción de tiamina no fosforilada; en la que dicha bacteria se caracteriza por tener transgenes […]
Células huéspedes modificadas y usos de las mismas, del 22 de Abril de 2020, de GLAXOSMITHKLINE BIOLOGICALS S.A.: Una célula huésped que comprende: i. un ácido nucleico que codifica una glicosiltransferasa derivada de un racimo rfb de Pseudomonas; ii. un ácido nucleico […]
 Cepas de microorganismo para la producción de 2,3-butanodiol, del 25 de Diciembre de 2019, de Alderys: Una levadura recombinante que tiene una actividad piruvato descarboxilasa reducida, en cuyo genoma se ha insertado:
- uno o más ácidos nucleicos que codifican una […]
Cepas de microorganismo para la producción de 2,3-butanodiol, del 25 de Diciembre de 2019, de Alderys: Una levadura recombinante que tiene una actividad piruvato descarboxilasa reducida, en cuyo genoma se ha insertado:
- uno o más ácidos nucleicos que codifican una […]
Producción microbiana de aminas grasas, del 20 de Noviembre de 2019, de Genomatica, Inc: Una célula bacteriana recombinante para la producción de una amina grasa, que comprende: (i) uno o más genes expresados que co 5 difican una […]
Cartucho de expresión para la trasformación de una célula eucariótica, método para transformar una célula eucariótica, organismo genéticamente modificado, y procedimiento para la producción de biocombustibles y/o compuestos bioquímicos y biocombustibles producidos de ese modo, del 13 de Noviembre de 2019, de Biocelere Agroindustrial Ltda: Un casete de expresión para transformar una célula eucariótica caracterizado porque comprende una combinación de los siguientes casetes de expresión: […]
Producción microbiana de n-butiraldehído, del 23 de Octubre de 2019, de Easel Biotechnologies, LLC: Un método de producción de n-butiraldehído, que comprende: (a) cultivar un microorganismo en un medio de cultivo con una fuente de carbono, […]