PROCEDIMIENTOS DE SINTESIS DE CONJUGADOS DE POLIPEPTIDO INSULINA-OLIGOMERO Y CONJUGADOS DE POLIPEPTIDO PROINSULINA-OLIGOMERO, Y PROCEDIMIENTOS DE SINTESIS DE LOS MISMOS.
Un procedimiento para sintetizar un monoconjugado de insulina-oligómero que comprende:
(i) poner en contacto una proinsulina con un oligómero, en el que la proinsulina comprende una insulina que tiene una cadena A y una cadena B, y un péptido C conector acoplado en un primer extremo con el terminal C de la cadena B y acoplado en un segundo extremo con el terminal N de la cadena A mediante enlaces peptídicos, y un péptido líder acoplado al terminal N de la cadena B mediante un enlace peptídico, en el que los enlaces peptídicos son capaces de ser escindidos enzimáticamente para producir el monoconjugado de insulina-oligómero, y en el que el oligómero comprende un resto hidrófilo y un resto lipófilo, y en el que la proinsulina y el oligómero son puestos en contacto en condiciones suficientes para acoplar el oligómero al residuo de lisina de la parte de insulina de la proinsulina y proporcionar un monoconjugado de proinsulina-oligómero; y
(ii) escindir enzimáticamente el péptido C y el péptido líder del monoconjugado de proinsulina-oligómero para proporcionar el monoconjugado de insulina-oligómero
Tipo: Resumen de patente/invención. Número de Solicitud: W0228428US.
Solicitante: BIOCON LIMITED.
Nacionalidad solicitante: India.
Dirección: 20TH K.M. HOSUR ROAD, ELECTRONICS CITY P.O.,BANGALORE 560 100 KARNATAKA.
Inventor/es: EKWURIBE, NNOCHIRI, N., SOLTERO,RICHARD, RADHAKRISHNAN,BALASINGHAM.
Fecha de Publicación: .
Fecha Concesión Europea: 28 de Octubre de 2009.
Clasificación Internacional de Patentes:
- A61K47/48H4P
- C07K14/62 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › Insulinas.
Clasificación PCT:
- A61K38/28 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › Insulinas.
- C07K14/62 C07K 14/00 […] › Insulinas.
Clasificación antigua:
Fragmento de la descripción:
Procedimientos de síntesis de conjugados de polipéptido insulina-oligómero y conjugados de polipéptido proinsulina-oligómero, y procedimientos de síntesis de los mismos.
Campo de la invención
La presente invención se refiere a conjugados de insulina y a procedimientos de síntesis de tales conjugados.
Antecedentes de la invención
El polipéptido insulina es la hormona principal responsable de controlar el transporte, la utilización y el almacenamiento de la glucosa en el cuerpo. Las células ß de los islotes pancreáticos segregan un precursor monocatenario de insulina conocido como proinsulina. La proteolisis de la proinsulina da como resultado la eliminación de ciertos aminoácidos básicos de la cadena de la proinsulina y del péptido C o conector, y proporciona el polipéptido insulina biológicamente activo.
La molécula de insulina se ha conservado mucho durante su evolución y consta, en general, de dos cadenas de aminoácidos unidas por enlace de tipo disulfuro. En la molécula de insulina bicatenaria humana natural (P.M.: 5.800 daltons), la cadena A está compuesta por 21 residuos de aminoácido y tiene glicina en el terminal amino; y la cadena B tiene 30 residuos de aminoácido y tiene fenilalanina en el terminal amino.
La insulina puede existir como un monómero o puede agregarse en un dímero o en un hexámero formado a partir de tres de los dímeros. La actividad biológica, i.e., la capacidad de unirse a receptores y estimular las acciones biológicas de la insulina, reside en el monómero.
La diabetes es un trastorno biológico que implica un metabolismo incorrecto de los hidratos de carbono. La diabetes resulta de una producción insuficiente de o una sensibilidad reducida a la insulina. Las personas con diabetes tienen inhibida la capacidad normal de usar la glucosa, aumentado de ese modo los niveles de azúcar en sangre (hiperglicemia). A medida que la glucosa se va acumulando en la sangre, se excretan los niveles excesivos de azúcar en la orina (glicosuria). Otros síntomas de la diabetes incluyen el aumento del volumen y de la frecuencia urinaria, sed, picor, hambre, pérdida de peso y debilidad.
Hay dos variedades de diabetes. La diabetes mellitus dependiente de la insulina de tipo I o IDDM. La IDDM antes se denominaba "diabetes de aparición juvenil". En la IDDM, la insulina no es segregada por el páncreas y debe ser proporcionada por una fuente externa. La diabetes de aparición en edad adulta o de tipo II puede ser normalmente controlada mediante la dieta, aunque en algunos casos avanzados, se necesita insulina.
Antes del aislamiento de la insulina en los años 20 del siglo XX, la mayoría de los pacientes fallecían en un breve período de tiempo tras la aparición de la enfermedad. La diabetes no tratada conduce a la cetosis, la acumulación de cetonas, productos de la descomposición de las grasas, en la sangre. A esto le sigue la acumulación de ácido en la sangre (acidosis) con náuseas y vómitos. A medida que se siguen acumulando los productos tóxicos del metabolismo incorrecto de los hidratos de carbono y de las grasas, el paciente entra en un coma diabético que le conduce a la muerte.
El uso de insulina como tratamiento de la diabetes data de 1922, cuando Banting et al. ("Pancreatic Extracts in the Treatment of Diabetes Mellitus", Can. Med. Assoc. J., 12:141-146 (1922)) demostraron que el extracto activo del páncreas tenía efectos terapéuticos en perros diabéticos. En ese mismo año, el tratamiento de un paciente diabético con extractos pancreáticos dio como resultado una mejora clínica espectacular que le salvó la vida.
Hasta hace poco tiempo, se usaba la insulina bovina y porcina casi exclusivamente para tratar la diabetes en seres humanos. Sin embargo, hoy en día, se conocen numerosas variaciones de la insulina entre las especies. Cada variación difiere de la insulina humana natural en que tiene sustitución(es) de aminoácidos en una o más posiciones de la cadena A y/o la cadena B. A pesar de estas diferencias, la mayoría de la insulina de mamífero tiene una actividad biológica comparable. El advenimiento de la tecnología recombinante permite la fabricación a una escala comercial de la insulina humana (p. ej., insulina HumulinTM, comercialmente disponible en Eli Lilly y Compañía Indianápolis, IN) o insulina diseñada genéticamente con una actividad biológica comparable a la insulina humana natural.
Comúnmente, el tratamiento de la diabetes requiere inyecciones regulares de insulina. Debido a la incomodidad de las inyecciones de insulina, se han hecho esfuerzos masivos por mejorar la administración y la bioasimilación de la insulina.
Se han hecho intentos por administrar insulina por vía oral. Los problemas asociados con la administración oral de la insulina para alcanzar la euglicemia en pacientes diabéticos están bien documentados en la bibliografía farmacéutica y médica. Las enzimas digestivas del tracto gastrointestinal degradan rápidamente la insulina, dando como resultado productos de descomposición biológicamente inactivos. En el estómago, por ejemplo, la insulina administrada oralmente sufre una proteolisis enzimática y una degradación ácida. En el intestino, se produce una descomposición proteolítica comparable de la insulina. En el lumen, la insulina es atacada por una variedad de enzimas, incluyendo las enzimas gástricas y pancreáticas, las exo- y endo-peptidasas y las peptidasas del borde en cepillo. Incluso aunque la insulina sobreviva a este ataque enzimático, las barreras biológicas que deben ser atravesadas antes de que la insulina pueda llegar a sus receptores in vivo pueden limitar su biodisponibilidad tras la administración oral de la insulina. Por ejemplo, la membrana puede ser poco permeable a la insulina, lo que limita la capacidad de la insulina para pasar desde el lumen intestinal al torrente sanguíneo.
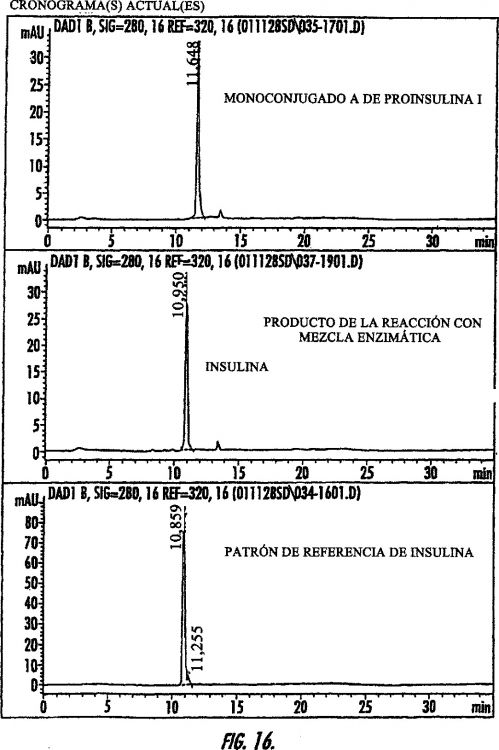
Algunos de los esfuerzos por proporcionar una forma oral de la insulina se han centrado en proporcionar conjugados de insulina-oligómero. La insulina humana y muchas insulinas estrechamente relacionadas que se usan terapéuticamente contienen tres residuos de aminoácido que portan grupos amino principales libres. Los tres grupos amino principales, concretamente, el terminal N (grupos alfa-amino) de las cadenas A y B (GlyA1 y PheB1) y el grupo épsilon-amino de LysB29, pueden ser modificados por la conjugación con oligómeros. En función de las condiciones de reacción, la N-acilación de una insulina desprotegida conduce a una mezcla compleja de mono-, di- y tri-conjugados (p. ej., insulina mono-conjugada en GlyA1, insulina mono-conjugada en PheB1, insulina mono-conjugada en LysB29, insulina di-conjugada en GlyA1 y PheB1, insulina di-conjugada en GlyA1 y LysB29, insulina di-conjugada en PheB1 y LysB29, e insulina tri-conjugada en GlyA1, PheB1 y LysB29). Cuando se desea un conjugado en concreto, por ejemplo, insulina mono-conjugada en LysB29, puede resultar oneroso y/o caro separar (o purificar) tal mezcla compleja de conjugados para obtener el conjugado deseado.
Como resultado de ello, se han realizado diversos esfuerzos por sintetizar selectivamente el conjugado de insulina deseado. Por ejemplo, Muranishi y Kiso, en la solicitud de patente japonesa 1-254.699, proponen una síntesis en cinco etapas para preparar derivados de insulina de ácidos grasos. Los grupos A1- y B1-amino de la insulina son protegidos (o bloqueados) con p-metoxibenzoxi-carbonil-azida (pMZ). Tras la acilación con un éster de ácido graso, se eliminan los grupos de protección (bloqueo) para proporcionar insulina mono-acilada en LysB29 con un ácido graso. Como otro ejemplo, la patente estadounidense n.º 5.750.497, concedida a Havelund et al., propone tratar la insulina humana con un reactivo de Boc (p. ej., di-terc-butil-dicarbonato) para formar insulina humana de (A1,B1)-diBoc, i.e., insulina humana en la que el extremo N-terminal de tanto la cadena A como de la cadena B está protegido por un grupo Boc. Tras una purificación opcional, p. ej., mediante CLAR, se introduce un grupo acilo lipófilo en el grupo e-amino de LysB29 permitiendo que el producto reaccione con un éster de N-hidroxisuccinimida de fórmula X-OSu, en la que X es el grupo acilo lipófilo que se va a introducir. En la etapa final, se usa ácido trifluoroacético para eliminar los grupos Boc y se aísla el producto, insulina humana Nvarepsilon B29-X.
Se...
Reivindicaciones:
1. Un procedimiento para sintetizar un monoconjugado de insulina-oligómero que comprende:
2. El procedimiento según la reivindicación 1, en el que la puesta en contacto de la proinsulina con el oligómero comprende:
3. El procedimiento según la reivindicación 2, en el que la puesta en contacto del oligómero con el agente de activación y la puesta en contacto del oligómero activado con la proinsulina se realiza in situ.
4. El procedimiento según la reivindicación 2, en el que la proporción molar entre el oligómero activado y la proinsulina es mayor de aproximadamente 4:1.
5. El procedimiento según la reivindicación 1, en el que el péptido C carece de residuos de lisina.
6. El procedimiento según la reivindicación 1, en el que el péptido C tiene un residuo de aminoácido terminal en el primer extremo y en el que la escisión del péptido C del monoconjugado de proinsulina-oligómero comprende:
7. El procedimiento según la reivindicación 6, en el que el residuo de aminoácido terminal es un residuo de arginina.
8. El procedimiento según la reivindicación 6, en el que la puesta en contacto del monoconjugado de proinsulina-oligómero con una primera enzima y la puesta en contacto del monoconjugado de residuo de aminoácido terminal-insulina-oligómero con una segunda enzima tienen lugar de manera sustancialmente simultánea.
9. El procedimiento según la reivindicación 8, en el que la primera enzima y la segunda enzima son proporcionadas en una mezcla que comprende la primera enzima y la segunda enzima.
10. El procedimiento según la reivindicación 6, en el que la primera enzima es tripsina y en el que la segunda enzima es carboxi-peptidasa B.
11. El procedimiento según la reivindicación 1, en el que el péptido líder carece de residuos de lisina.
12. El procedimiento según una cualquiera de las reivindicaciones 1 a 11, en el que la escisión del péptido C del monoconjugado de proinsulina-oligómero comprende poner en contacto el monoconjugado de proinsulina-oligómero con una o más enzimas que sean capaces de escindir el o los enlaces entre el péptido C y la cadena A y B de la insulina en condiciones suficientes para escindir el péptido C del monoconjugado de proinsulina-oligómero.
13. El procedimiento según la reivindicación 12, en el que la una o más enzimas se seleccionan del grupo constituido por tripsina, carboxi-peptidasa B y mezclas de las mismas.
14. El procedimiento según una cualquiera de las reivindicaciones 1 a 13, en el que el oligómero comprende la estructura de fórmula I:
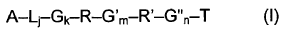
en la que:
15. El procedimiento según una cualquiera de las reivindicaciones 1 a 13, en el que el oligómero comprende la estructura de fórmula II:
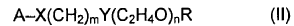
en la que:
16. El procedimiento según una cualquiera de las reivindicaciones 1 a 13, en el que el oligómero comprende la estructura de fórmula III:
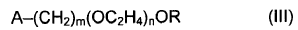
en la que:
17. El procedimiento según una cualquiera de las reivindicaciones 1 a 13, en el que el oligómero comprende la estructura de fórmula IV:
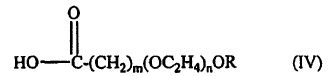
en la que:
18. El procedimiento según una cualquiera de las reivindicaciones 1 a 13, en el que el oligómero comprende la estructura de fórmula V:
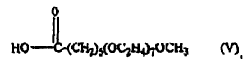
19. El procedimiento según una cualquiera de las reivindicaciones 1 a 13, en el que la insulina es insulina humana.
20. El procedimiento según la reivindicación 19, en el que el oligómero está acoplado a la lisina en la posición B29 de la insulina.
21. El procedimiento según una cualquiera de las reivindicaciones 1 a 13, en el que el monoconjugado de insulina-oligómero está anfifílicamente equilibrado.
22. El procedimiento según una cualquiera de las reivindicaciones 1 a 13, en el que el oligómero está presente como una mezcla sustancialmente monodispersada.
23. El procedimiento según una cualquiera de las reivindicaciones 1 a 13, en el que el rendimiento del monoconjugado de insulina-oligómero es mayor del 75%.
24. El procedimiento según cualquiera de las reivindicaciones anteriores, en el que la insulina se selecciona entre insulina GlyA21, humana; insulina GlyA21 GlnB3, humana; insulina AlaA21, humana; insulina AlaA21 GlnB3, humana; insulina GlnB3, humana; insulina GlnB30, humana; insulina GlyA21 GluB30, humana; insulina GlyA21 GlnB3 GluB30, humana; insulina GlnB3 GluB30, humana; insulina AspB28, humana; insulina LysB28, humana; insulina LeuB28, humana; insulina ValB28, humana; insulina AlaB28, humana; insulina AspB28 ProB29, humana; insulina LysB28 ProB29, humana; insulina LeuB28 ProB29, humana; insulina ValB28 ProB29, humana; insulina AlaB28 ProB29, humana.
25. Un monoconjugado de proinsulina-oligómero que comprende una proinsulina y un oligómero,
26. El monoconjugado según la reivindicación 25, en el que el péptido C carece de residuos de lisina.
27. El monoconjugado según una cualquiera de las reivindicaciones 25 ó 26, en el que la insulina es insulina humana.
28. El monoconjugado según una cualquiera de las reivindicaciones 25 ó 26, en el que la insulina es insulina humana y en el que el residuo de lisina está en la posición B29 de la insulina.
29. El monoconjugado según una cualquiera de las reivindicaciones 25 ó 26, en el que la insulina se selecciona entre insulina GlyA21, humana; insulina GlyA21 GlnB3, humana; insulina AlaA21, humana; insulina AlaA21 GlnB3, humana; insulina GlnB3, humana; insulina GlnB30, humana; insulina GlyA21 GluB30, humana; insulina GlyA21 GlnB3 GluB30, humana; insulina GlnB3 GluB30, humana; insulina AspB28, humana; insulina LysB28, humana; insulina LeuB28, humana; insulina ValB28, humana; insulina AlaB28, humana; insulina AspB28 ProB29, humana; insulina LysB28 ProB29, humana; insulina LeuB28 ProB29, humana; insulina ValB28 ProB29, humana; insulina AlaB28 ProB29, humana.
30. Monoconjugado de insulina-oligómero que comprende una insulina acoplada en una función amino de la posición B29 de la lisina a un resto oligomérico que tiene la siguiente estructura:

en la que:
m es entre 1 y 30;
m es entre 1 y 50; y
R es alquilo.
31. El monoconjugado según la reivindicación 30, en el que el oligómero tiene la siguiente estructura:

32. El monoconjugado según una cualquiera de las reivindicaciones 30 ó 31, en el que la insulina se selecciona entre insulina GlyA21, humana; insulina GlyA21 GlnB3, humana; insulina AlaA21, humana; insulina AlaA21 GlnB3, humana; insulina GlnB3, humana; insulina GlnB30, humana; insulina GlyA21 GluB30, humana; insulina GlyA21 GlnB3 GluB30, humana; insulina GlnB3 GluB30, humana; insulina AspB28, humana; insulina LysB28, humana; insulina LeuB28, humana; insulina ValB28, humana; insulina AlaB28, humana; insulina AspB28 ProB29, humana; insulina LysB28 ProB29, humana; insulina LeuB28 ProB29, humana; insulina ValB28 ProB29, humana; insulina AlaB28 ProB29, humana.
Patentes similares o relacionadas:
Terapia génica para la diabetes, del 8 de Julio de 2020, de UCL Business Ltd: Una molécula de ácido nucleico que comprende una secuencia de nucleótidos que codifica una proteína preproinsulina funcional en donde la secuencia de nucleótidos tiene al menos […]
Proteínas de fusión, del 12 de Febrero de 2020, de ELI LILLY AND COMPANY: Una proteína de fusión que comprende: a) un agonista del receptor de insulina que tiene la fórmula general Z1-Z2-Z3, en la que: i) Z1 es un análogo de la cadena B […]
Derivados de insulina biológicamente activos, del 22 de Enero de 2020, de Chemical & Biopharmaceutical Laboratories of Patras S.A: Un análogo de insulina de cadena sencilla que comprende: (A) la cadena A de la insulina humana o animal, o un análogo de esta, que es una variante […]
Insulinas con extensiones recombinantes polares, del 15 de Enero de 2020, de NOVO NORDISK A/S: Una insulina extendida con oligómero o análogo de insulina, cuya insulina o análogo de insulina es una molécula de insulina de dos cadenas que comprende […]
Terapia génica con insulina basada en hepatocitos para la diabetes, del 8 de Enero de 2020, de WISCONSIN ALUMNI RESEARCH FOUNDATION: Un vector para su uso en un método para controlar los niveles de glucosa en sangre en un mamífero, donde el método comprende tratar a un mamífero con el vector, donde el […]
Análogo de la insulina y uso del mismo, del 13 de Noviembre de 2019, de HANMI PHARM. CO., LTD.: Un análogo de la insulina que tiene un título de insulina reducido en comparación con la forma nativa, en el que el análogo de la insulina tiene una cadena A […]
Polipéptidos escindibles por enteroquinasa, del 7 de Agosto de 2019, de NOVO NORDISK A/S: Método para producir un polipéptido diana, dicho método que comprende las etapas: a) expresar el polipéptido de fusión escindible por Enteroquinasa que comprende el […]
Procedimiento de preparación mejorado para producción de alto rendimiento de un conjugado de polipéptido fisiológicamente activo, del 5 de Junio de 2019, de HANMI PHARM. CO., LTD.: Un procedimiento para preparar un conjugado de polipéptido fisiológicamente activo - polímero no peptidilo - región constante de inmunoglobulina, […]