METODO DE CONSERVACION DE PEPTIDOS O PROTEINAS.
Método de conservación de péptidos o proteínas.
El objeto de la presente invención es un método de conservación de péptidos o proteínas durante periodos de tiempo prolongados.
Constituye igualmente un objeto de la presente invención la utilización de dicho método de conservación para el transporte de péptidos o proteínas etiquetadas sin necesidad de refrigeración, así como el conjunto de útiles para la puesta en práctica de dicho método
Tipo: Patente de Invención. Resumen de patente/invención. Número de Solicitud: P200702475.
Solicitante: BIOMEDAL, S.L.
Nacionalidad solicitante: España.
Provincia: SEVILLA.
Inventor/es: CEBOLLA RAMIREZ,ANGEL, ALVAREZ MAQUEDA,MOISES.
Fecha de Solicitud: 11 de Septiembre de 2007.
Fecha de Publicación: .
Fecha de Concesión: 27 de Enero de 2010.
Clasificación Internacional de Patentes:
- C07K1/22 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 1/00 Procedimientos generales de preparación de péptidos. › Cromatografía de afinidad o técnicas análogas basadas en procesos de absorción selectiva.
- C07K17/04 C07K […] › C07K 17/00 Péptidos fijados sobre un soporte o inmovilizados; Su preparación. › encerrados en el interior del soporte, p. ej. en un gel, en una fibra hueca.
Clasificación PCT:
Fragmento de la descripción:
Método de conservación de péptidos o proteínas.
Sector de la técnica
El sector de la técnica en el que se encuadra la presente invención es el biotecnológico, y su ámbito de aplicación es la conservación y el transporte de péptidos o proteínas de interés sanitario, diagnóstico, farmacéutico, agronómico o industrial. También es de interés en el campo de la investigación en ciencias de la vida.
Estado de la técnica
Los péptidos o proteínas generalmente son inestables cuando son conservados a temperatura ambiente (aproximadamente entre 18 y 25°C) en medios líquidos o soluciones acuosas, así en pocas horas comienzan a aparecer fenómenos de degradación, desnaturalización y/o crecimiento de contaminantes microbianos (Jaenicke, R., (2000). J Biotechnol, 79, 193-203; Meyer, J. D., et al (2002). Pharm Biotechnol, 13, 85-107). Con objeto de evitar dichos fenómenos se utilizan diversos métodos de conservación de péptidos y proteínas, los más habituales pueden ser resumidos en: (i) conservación a temperatura refrigerada; (ii) adición de agentes estabilizantes; y, (iii) deshidratación o liofilización.
Tradicionalmente los péptidos o proteínas han sido conservados en solución acuosa a temperatura refrigerada, bien de forma líquida a 4°C ó bien de forma congelada a -20°C. De esta forma se reduce la velocidad de las reacciones de degradación. No obstante, los procesos de congelación-descongelación repetida provocan alteraciones en la estructura y/o actividad de los péptidos y proteínas (Tang, X.C., et al (2005). Pharm Res, 22, 1167-1175). Asimismo, los péptidos y proteínas conservados de esta forma no evitan la aparición de los fenómenos de degradación, desnaturalización y/o contaminación microbiana.
Los agentes estabilizantes son sustancias inertes que modifican las características físico-químicas de las soluciones acuosas empleadas para conservar péptidos o proteínas, reduciendo así el riesgo de degradación. Ejemplos de tales agentes son: glicerol, azúcares (glucosa, galactosa, sacarosa, trealosa), polietilenglicoles, amino-ácidos (metionina, histidina), detergentes (Triton X-100, Tween-20), y otras proteínas (albúmina) (Arakawa, T., (1991). Pharm Res, 8, 285-291; Crowe, J.H., et al (1987). Biochem J, 242, 1-10; Levine, R.L. (1983). J Biol Chem, 258, 11828-11833). El glicerol es un agente estabilizante tradicional que reduce el punto de congelación de la solución acuosa con los péptidos o proteínas, permitiendo conservarlos en estado líquido sin congelar a baja temperatura (-20°C) (Scharnagl, C., et al (2005). Biochim Biophys Acta, 1749, 187-213). Los agentes estabilizantes suelen utilizarse conjuntamente a otros métodos de conservación de péptidos o proteínas (Carpenter, J.F. et al (1987). Biochim Biophys Acta, 923, 109-115). Sin embargo, a menudo los agentes estabilizantes pueden interferir en la actividad o aplicación posterior del péptido o proteína de interés, y deben ser eliminados utilizando sistemas de diálisis u otros procedimientos más agresivos (precipitación salina o ácida) que alteran dicho péptido o proteína (Prive, G.G. (2007) Methods, 41, 388-397).
La liofilización es un proceso de deshidratación en el cual las moléculas de agua son eliminadas de una muestra congelada en el interior de un sistema de vacío. Este método de conservación requiere que el péptido o proteína, disuelto en un medio o solución acuosa, sea congelado preferentemente de forma rápida. Un procedimiento utilizado para congelar rápidamente la solución con el péptido o proteína consiste en su inmersión en nitrógeno líquido. Entonces se aplica a la muestra congelada un sistema de vació, que provoca la sublimación o vaporización de la fase helada a temperaturas bajo cero (deshidratación primaria). La humedad residual puede ser posteriormente eliminada permitiendo la elevación gradual de la temperatura (deshidratación secundaria). El resultado del proceso de liofilización es un polvo o sustancia seca y cristalina que contiene el péptido o proteína a conservar (Randolph, T.W., (1997). J Pharm Sci, 86, 1198-1203; Wang, W. (2000). Int J Pharm, 203, 1-60). En la liofilización, durante las fases de deshidratación primaria y secundaria los péptidos o proteínas sufren cambios físicos y químicos, como incremento de la concentración salina, agregación/precipitación, estrés físico, pH extremos, que producen alteraciones en su estructura y/o actividad. Adicionalmente, los péptidos o proteínas liofilizados usualmente son muy higroscópicos, y tienen tendencia a absorber la humedad ambiental, lo que también ocasiona fenómenos de degradación y descenso de la actividad de dichos péptidos o proteínas (Webb, S.D., et al (2003). J Pharm Sci, 92, 715-729).
Las etiquetas de afinidad (tags) se han convertido en un sistema habitual de purificar proteínas y complejos protéicos nativos por evidentes razones: permiten purificar o enriquecer de cientos a miles de veces dichos péptidos o proteínas desde extractos crudos en un solo paso, sin la necesidad de eliminar previamente ácidos nucléicos u otros materiales celulares; y, sobre todo, permiten utilizar protocolos generales de purificación con una gran diversidad proteínas, en contraste con el diseño y puesta a punto de protocolos específicos para cada material peptídico que necesita la cromatografia convencional (Waugh, D.S., (2005). Trends Biotechnol, 23, 316-320; Esposito, D. et al (2006). Curr Opin Biotechnol, 17, 353-358). Gracias a estas ventajas, la purificación usando etiquetas de afinidad ha facilitado a los investigadores la producción de multitud de proteínas recombinantes de interés en investigación y en diagnóstico, siendo el procedimiento típicamente usado en los proyectos de alto rendimiento (Braun, P., et al. (2002) PNAS; 99, 2654-2659).
Actualmente, las colaboraciones científicas o los servicios especializados cliente-proveedor requieren el intercambio o envío de péptidos o proteínas, de interés sanitario, diagnóstico, farmacéutico, agronómico, industrial o en el campo de la investigación en ciencias de la vida, entre laboratorios de centros públicos o empresas privadas localizados en el mismo país o países diferentes. Uno de los problemas del envío de estos materiales, consiste en evitar los fenómenos de degradación, desnaturalización y/o crecimiento de contaminantes microbianos referidos anteriormente. El sistema de transporte más habitual consiste en usar cajas voluminosas que contienen hielo, nieve carbónica o acumuladores de frío para garantizar que los péptidos o proteínas se conservan una temperatura refrigerada durante el tiempo establecido para el transporte (de 24 horas a 4-5 días para este tipo de envíos). Estos sistemas son engorrosos y suponen un elevado coste económico. Además, cualquier retraso en el tiempo de transporte (retención en aduanas, retrasos por la empresa de mensajería, etc) provoca que el material llegue a su destino a temperatura ambiente, motivando su devolución o la comprobación de la integridad del material enviado por parte del receptor. Por ello son necesarios nuevos métodos que permitan resolver el problema de conservación y transporte de péptidos o proteínas a temperatura ambiente. La presente invención describe un método sencillo, económico y versátil orientado a resolver este problema, así como los útiles necesarios para realizarlo.
Descripción detallada de la invención
El objeto de la invención se refiere un método para conservar péptidos o proteínas etiquetados durante varios días, e incluso meses, que evita el uso de refrigeración, y su aplicación en el almacenamiento y el transporte de péptidos o proteínas de interés para los sectores sanitario, diagnóstico, farmacéutico, agronómico o industrial. La presente invención describe un método alternativo más cómodo y seguro que los ya existentes, tales como la conservación y/o transporte de péptidos o proteínas en solución acuosa a temperatura refrigerada o la liofilización. (Tang, X.C., et al (2005). Pharm Res, 22, 1167-1175; Webb, S.D., et al (2003). J Pharm Sci, 92, 715-729). Así, el objeto de la invención comprende el uso de matrices sólidas o semi-sólidas derivatizadas con compuestos que tienen afinidad por secuencias específicas o etiquetas (tags) presentes en los péptidos o proteínas a conservar.
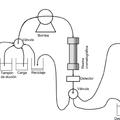
El método para conservar péptidos o proteínas objeto de la invención incluye las siguientes etapas:
Reivindicaciones:
1. Método para conservar o almacenar péptidos o proteínas etiquetados mediante su unión reversible a matrices sólidas o semi-sólidas derivatizadas que incluye las siguientes etapas:
2. Método para conservar péptidos o proteínas etiquetados según la reivindicación 1, caracterizado porque las matrices están derivatizadas con compuestos que tienen afinidad por las etiquetas (tags) presentes en dichos péptidos o proteínas.
3. Método para conservar péptidos o proteínas etiquetados según las reivindicaciones 1 y 2 caracterizado porque la matriz está compuesta por cualquier material poroso, fibroso o reticular que permita el paso de líquidos.
4. Método para conservar péptidos o proteínas etiquetados según las reivindicaciones 1 a 3, caracterizado porque la matriz está compuesta por cualquier polímero caracterizado por tener una alta relación superficie/volumen y que suelen ser utilizados como soportes de purificación sólidos o semi-sólidos en cromatografia de afinidad para purificación de péptidos o proteínas.
5. Método para conservar péptidos o proteínas etiquetados según las reivindicaciones 1 a 4, caracterizado porque la matriz está compuesta por alguno de los siguientes materiales o sus derivados: celulosas, agarosas, poliacrilatos, polimetacrilatos, polivinilos, chitosanos, poliestirenos y cualquier polímero natural o de síntesis derivatizable con estructura porosa o fibrosa.
6. Método para conservar péptidos o proteínas etiquetados según las reivindicaciones 1 a 4, caracterizado porque la matriz está compuesta por celulosa o cualquiera de sus derivados.
7. Método para conservar péptidos o proteínas etiquetados según las reivindicaciones de 1 a 3, caracterizado porque la matriz está derivatizada con alguno de los siguientes compuestos: ácido iminodiacético (IDA) o ácido nitrilotriacético (NTA) unidos a metales dicatiónicos como el níquel (Ni), el cobalto (Co) o el cobre (Cu); aminas terciarias o cuaternarias como el dietilaminoetanol (DEAE) o el trimetilamonio (QAE); glutation; amilosa; avidina o estreptavidina; calmodulina; proteína A; proteína G; o cualquier otro compuesto que permita la purificación por cromatografia de afinidad de péptidos o proteínas conocidos por los expertos en dicha materia.
8. Método para conservar péptidos o proteínas etiquetados según las reivindicaciones de 1 a 3, caracterizado porque la matriz está derivatizada con ácido iminodiacético (IDA) o ácido nitrilotriacético (NTA) unidos a metales dicatiónicos como el níquel (Ni), el cobalto (Co) o el cobre (Cu).
9. Método para conservar péptidos o proteínas etiquetados según las reivindicaciones de 1 a 3, caracterizado porque la matriz está derivatizada con aminas terciarias o cuaternarias como el dietilaminoetanol (DEAE) o el trimetilamonio (QAE).
10. Utilización del método para conservar péptidos o proteínas etiquetados de cualquiera de las reivindicaciones 1 a 9, para conservar péptidos o proteínas con alguna de las siguientes etiquetas o tags: colas de histidinas (Histag), dominios de unión a colina (Lytag), glutation S-transferasa (GST-tag), maltose binding protein (MBP-tag), biotina o Streptag, calmodulin binding domain (CBD-tag) o calmodulin binding protein (CBP-tag) o calmodulin regulated proteins, secuencias totales o parciales de cadenas pesadas de inmunoglobulinas, o cualquier otro tipo de etiqueta que permita la purificación por
11. Utilización del método para conservar péptidos o proteínas etiquetados de cualquiera de las reivindicaciones 1 a 9, para conservar péptidos o proteínas etiquetados con colas de histidinas (Histag).
12. Utilización del método para conservar péptidos o proteínas etiquetados de cualquiera de las reivindicaciones 1 a 9, para conservar péptidos o proteínas etiquetadas con dominios de unión a colina (Lytag).
13. Conjunto de útiles (kit) para realizar el método según cualquiera de las reivindicaciones 1 a 12, caracterizado porque comprende al menos tres de los siguientes componentes:
Patentes similares o relacionadas:
 Purificación de proteínas, del 29 de Julio de 2020, de UCB Biopharma SRL: Un proceso para la purificación de una proteína de interés a partir de una mezcla que comprende las etapas de
a) en un ciclo de cromatografía operativo, […]
Purificación de proteínas, del 29 de Julio de 2020, de UCB Biopharma SRL: Un proceso para la purificación de una proteína de interés a partir de una mezcla que comprende las etapas de
a) en un ciclo de cromatografía operativo, […]
Membranas para cromatografía formadas por reacciones de polimerización clic de tiol-eno o tiol-ino, del 10 de Junio de 2020, de Merck Millipore Ltd: Un material compuesto, que comprende: un miembro de soporte, que comprende una pluralidad de poros que se extienden a través del miembro de […]
Un procedimiento de cromatografía de reparto débil, del 6 de Mayo de 2020, de WYETH LLC: Un procedimiento de recuperación de un producto purificado de un fluido de carga que incluye una o más impurezas, que comprende las etapas de: hacer pasar el fluido […]
Procedimiento de purificación de polipéptidos, del 22 de Abril de 2020, de CSL LIMITED: Procedimiento de purificación de un polipéptido de interés por cromatografía de intercambio catiónico en el que un compuesto químico se añade en una concentración de al menos […]
Etiqueta de epítopo y método de detección, captura y/o purificación de polipéptidos etiquetados, del 15 de Abril de 2020, de ChromoTek GmbH: Péptido epítopo aislado que tiene de 12 a 25 aminoácidos, en donde la secuencia de aminoácidos comprende una secuencia según se define en SEQ ID NO: 32 (X1X2RX4X5AX7SX9WX11X12), […]
Matriz de cromografía de afinidad, del 25 de Marzo de 2020, de LABORATOIRE FRANCAIS DU FRACTIONNEMENT ET DES BIOTECHNOLOGIES SOCIETE ANONYME: Matriz de cromatografía de afinidad, en forma de gel, que comprende unas partículas de polímero sobre las cuales se injerta al menos un oligosacárido […]
Sistema de tampón para purificación de proteína, del 26 de Febrero de 2020, de GLAXOSMITHKLINE LLC: Un sistema de cromatografía que comprende: (i) un sistema de tampón de múltiples componentes libre de cloruro de sodio para la purificación de una […]
Proteína mutante, del 19 de Febrero de 2020, de Cytiva BioProcess R&D AB: Una proteína de unión a inmunoglobulina que se une a regiones de una molécula de inmunoglobulina distintas de las regiones determinantes de […]