LIOFILIZACION DE VIROSOMAS.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2005/013829.
Solicitante: PEVION BIOTECH LTD.
Nacionalidad solicitante: Suiza.
Dirección: REHHAGSTRASSE 79,3018 BERN.
Inventor/es: ZURBRIGGEN,RINALDO, AMACKER,MARIO, RASI,SILVIA.
Fecha de Publicación: .
Fecha Concesión Europea: 17 de Marzo de 2010.
Clasificación Internacional de Patentes:
- A61K39/015 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Antígenos de Hemosporidia, p. ej. antígenos de Plasmodium.
- A61K39/145 A61K 39/00 […] › Orthomyxoviridae, p. ej. virus de la influenza.
- A61K9/127B2
- A61K9/19 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › liofilizados.
Clasificación PCT:
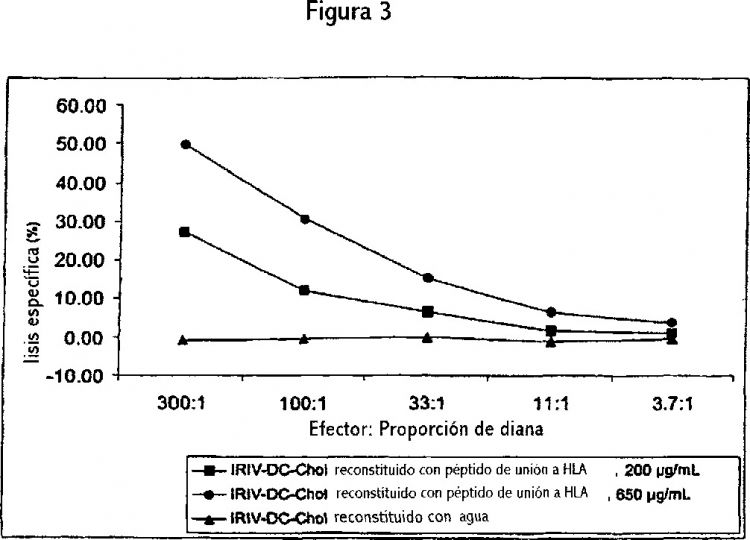
Fragmento de la descripción:
Liofilización de virosomas.
Sector de la invención
La presente invención se refiere a composiciones y procedimientos para la liofilización y reconstitución eficaces de virosomas.
Antecedentes de la invención
La liofilización o "secado por congelación" es un proceso técnico para eliminar agua. En éste, la solución acuosa se enfría por debajo de su punto eutéctico, hasta su congelación completa. A continuación, se reduce la presión barométrica hasta hacer vacío, de manera que el agua se sublima y se elimina de la solución. El agente solubilizado permanece como un sólido poroso, que puede redisolverse en agua nuevamente. La liofilización genera sólidos con un área superficial muy grande, que provoca una alta solubilidad en agua.
La liofilización es ampliamente utilizada en aplicaciones farmacéuticas, ya que la mayoría de los productos farmacéuticos tienen un tiempo de vida de almacenamiento en solución limitada. Su tiempo de vida en anaquel puede aumentarse significativamente mediante la producción de liofilizados, que se disuelven, poco antes de su utilización, en un disolvente adecuado. Aunque la liofilización ha demostrado ser una técnica de conservación superior comúnmente utilizada en la actualidad, tiene desventajas inherentes. Estas están mayormente relacionadas con los procesos de congelación y reconstitución, que a menudo pueden ser perjudiciales para los agentes o composiciones bioactivas. Para preservar la funcionalidad y la actividad, se han desarrollado diferentes técnicas, especialmente el uso de crioprotectores que incluyen, por ejemplo, azúcares como la sacarosa o trealosa.
Los liposomas y virosomas tienen propiedades superiores como vehículos de administración de medicamentos. Mientras que los liposomas son vesículas de lípidos esféricas, los virosomas son envolturas de virus que no contienen el material genético infectivo del virus original. La diferencia entre liposomas y virosomas es que los virosomas contienen proteínas adicionales en su superficie que los hace partículas de fusión activas, mientras que los liposomas son portadores inactivos.
En consecuencia, los virosomas son sistemas portadores/adyuvantes muy eficaces en la vacunación moderna, que poseen propiedades superiores como vehículos de administración de antígenos y un potencial inmunogénico fuerte, mientras que a la minimizan el riesgo de efectos secundarios.
Hasta la fecha, los virosomas se han utilizado de forma eficaz en una variedad de vacunas. Por ejemplo, vacunas disponibles comercialmente contra la hepatitis A y la influenza utilizan virosomas como adyuvantes y vehículos de administración de antígeno seguros. Los anticuerpos desarrollados por la inoculación con antígenos reconstituidos en virosomas han mostrado una elevada afinidad por los antígenos contra los que se han dirigido. Virosomas unilaminares que contienen 30% molar de Dodac y complejados con plásmido se conocen de P. Schoen y otros. Gene Therapy (1999) 6, 823-832.
La liofilización de liposomas puede impedir la hidrólisis de los fosfolípidos y la degradación física de las vesículas durante el almacenamiento. Además, puede ayudar a estabilizar la sustancia que se incorpora en los liposomas. La liofilización de una formulación de liposomas da como resultado una torta seca, que puede reconstituirse en segundos para obtener la dispersión original, es decir, si se utilizan los excipientes adecuados y se aplican condiciones de liofilización adecuadas. Por otra parte, el proceso de liofilización por sí mismo puede inducir cambios físicos de los liposomas, tales como pérdida del agente encapsulado y alteraciones en el tamaño de la vesícula. La ocurrencia de dicho daños no es sorprendente, porque la interacción entre los grupos principales de fosfolípidos hidrofílicos y las moléculas de agua juega un papel fundamental en la formación de bicapas de liposomas. En consecuencia, eliminar el agua de los liposomas mediante liofilización representa un reto excitante. Además, la liofilización es un proceso que consume energía y tiempo, que desde luego requiere algunos conocimientos a efectos de evitar sus dificultades específicas. Afortunadamente, se han identificado excipientes, tales como disacáridos, que protegen los liposomas durante los procesos de congelación (lioprotectores) y la técnica de liofilización se ha descrito de manera extensiva en la literatura (Pikal y otros, 1990, Int. J. Pharm. Sci. 60, 203; Pikal, 1990, Biopharm 10, 18; Essig y otros, 1993, Liofilización ("Lyophilization"), Wissenschaftliche Verlagsgesellschaft, Stuttgart; Jenning, 1999, Liofilización: Introducción y principios básicos ("Lyophilization: Introduction and Basic principles"), Interpharm Press, Englewood, CO).
Los lioprotectores protegen los liposomas mediante (1) evitando la fusión de los liposomas, (2) evitando la ruptura de las bicapas por los cristales de hielo y (3) manteniendo la integridad de las bicapas en ausencia de agua. Para hacer esto, los lioprotectores deben formar una matriz cristalina amorfa dentro y alrededor de los liposomas. La interacción entre los lioprotectores y los grupos principales de fosfolípidos se considera especialmente importante para evitar la fuga durante la rehidratación de los liposomas que tienen una bicapa cristalina líquida en el estado hidratado a temperaturas ambiente.
Es posible distinguir diferentes tipos de formulaciones de liposomas con respecto a la liofilización: (1) liposomas vacíos, que se reconstituyen con una solución del compuesto a ser encapsulado, (2) liposomas cargados con un compuesto que esta fuertemente asociado con la bicapa y (3) liposomas que contienen un compuesto soluble en agua que no interactúa con la bicapa. El tercero representa el mayor reto, ya que se requiere evitar la fuga de solutos encapsulados y la conservación del tamaño de los liposomas. La composición de la bicapa es un factor altamente significativo cuando se determina la resistencia de los liposomas a la tensión de liofilización, pero hasta la fecha ha sido difícil extraer reglas generales de la literatura ya que están involucrados muchos otros parámetros, incluyendo las condiciones de los procesos de liofilización, la selección del lioprotector y el tamaño de la vesícula.
Tal como se ha descrito anteriormente, la liofilización de liposomas ha probado ser la más demandada, pero la liofilización de virosomas está enfrentando problemas aún mayores. Es decir, en comparación con los liposomas, debido a las proteínas adicionales en la envoltura, responsables de la actividad de fusión del virosoma. Tal como las proteínas, éstos son muy susceptibles a la tensión inducida por la liofilización, provocando pérdidas significativas de actividad.
En consecuencia, existe una necesidad de composiciones y procedimientos que superen los problemas asociados a la liofilización y reconstitución eficaces de moléculas de fusión activas, denominadas virosomas.
Características de la invención
La presente invención da a conocer composiciones biológicamente activas y procedimientos para preparar liofilizados de virosomas hidratables, con alta resistencia a la tensión de liofilización y procedimientos para su reconstitución. Según la presente invención, composiciones biológicamente activas se refiere a composiciones inmunogénicas o composiciones farmacéuticas que comprenden virosomas y un lípido catiónico para la liofilización y reconstitución eficaces del virosoma y, en particular, a una composición inmunogénica o una composición farmacéutica en la que un lípido catiónico está presente en la membrana del virosoma para la liofilización y reconstitución eficaces del virosoma. Utilizando la enseñanza de la presente invención, se pueden obtener virosomas que tienen propiedades de liofilización y reconstitución superiores y que son particularmente útiles para administrar antígenos, medicamentos y otras sustancias farmacéuticas activas, incluyendo ADN, ARN, o ARNsi en las células. Después de la liofilización, aún son capaces de administrar dichas sustancias a distintas células a través de un sistema de diana, que reconoce los marcadores de superficie de tipos de células específicas y, de esta manera, son específicamente superiores a otros vehículos de administración conocidos.
Los lípidos catiónicos utilizados son derivados de colesterol catiónicos.
En otra realización de la presente invención dichos derivados de colesterol se representan mediante la siguiente fórmula:
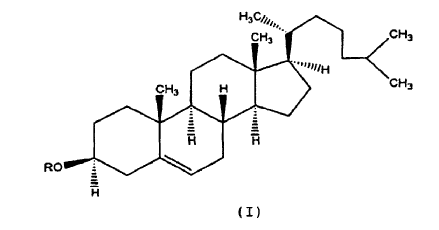
Reivindicaciones:
1. Composición biológicamente activa que comprende, como mínimo, virosoma de influenza reconstituido inmunopotenciador (IRIV) y un derivado de colesterol catiónico para la liofilización y reconstitución eficaz del virosoma, en la que dicho derivado de colesterol catiónico para la liofilización y reconstitución eficaz del virosoma está presente en la membrana del virosoma.
2. Composición, según la reivindicación 1, en la que dicho derivado de colesterol tiene un sustituyente cargado positivamente en la posición 3 del colesterol y se representa mediante la fórmula:
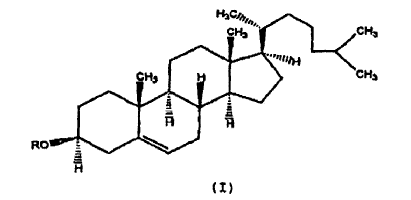
3. Composición, según la reivindicación 2, en la que dicho derivado de colesterol se representa mediante la fórmula siguiente:

4. Composición, según la reivindicación 3, en la que R1 y R2 son metilo y R3 es hidrógeno.
5. Composición, según la reivindicación 3, en la que R1, R2 y R3 son metilo.
6. Composición, según cualquiera de las reivindicaciones 1-5, en la que el contenido de lípido catiónico está entre 1,9 y 37% molar del contenido total de lípidos de la membrana.
7. Composición, según la reivindicación 6, en la que el contenido de lípido catiónico está entre 1,9 y 16% molar del contenido total de lípidos de la membrana.
8. Composición, según la reivindicación 6 ó 7, en la que el contenido de lípido residual de la membrana virosomal consiste en fosfolípidos.
9. Composición, según la reivindicación 8, en la que los fosfolípidos son fosfatidilcolina y fosfatidiletanolamina.
10. Composición, según cualquiera de las reivindicaciones anteriores, que adicionalmente comprende un lioprotector.
11. Composición, según la reivindicación 10, en la que el lioprotector se selecciona del grupo que comprende sacarosa, trealosa, dextrosa, lactosa, manosa, xilosa y manitol.
12. Composición, según la reivindicación 11, en la que el lioprotector está presente en una proporción de 0,1 a 5% (p/v) en la solución antes de la liofilización.
13. Composición, según las reivindicaciones 10 a 12, que comprende adicionalmente un adyuvante o un sistema adyuvante.
14. Composición, según las reivindicaciones 1 a 9 ó 10 a 13, que comprende adicionalmente una sustancia biológicamente activa seleccionada entre un agente farmacéutico o una molécula antigénica.
15. Composición, según la reivindicación 14, en la que dicha sustancia biológicamente activa está unida a la superficie del virosoma y/o en el interior del virosoma.
16. Procedimiento para la liofilización de virosomas que utiliza las composiciones según cualquiera de las reivindicaciones 10 a 13, que comprende las etapas de:
17. Procedimiento para la liofilización de virosomas que utiliza las composiciones según cualquiera de las reivindicaciones 14 ó 15, que comprende las etapas de:
18. Liofilizado de virosomas obtenible mediante el procedimiento de la reivindicación 16.
19. Liofilizado de virosomas obtenible mediante el procedimiento de la reivindicación 17.
20. Procedimiento para la reconstitución de un liofilizado de virosomas según la reivindicación 18, que comprende la etapa de solubilizar el liofilizado de virosomas en un disolvente de reconstitución.
21. Procedimiento, según la reivindicación 20, en el que el disolvente de reconstitución comprende dicha sustancia biológicamente activa seleccionada entre un agente farmacéutico y una molécula antigénica.
22. Procedimiento para la reconstitución de un liofilizado de virosomas según la reivindicación 19, que comprende la etapa de solubilizar el liofilizado de virosomas en un disolvente de reconstitución.
23. Uso de cualquiera de las composiciones según las reivindicaciones 1 a 15 para la fabricación de un producto farmacéutico para inocular con ella a un sujeto.
24. Uso, según la reivindicación 23, en el que el sujeto es un humano.
25. Kit que comprende un recipiente que contiene el liofilizado de la reivindicación 18.
26. Kit, según la reivindicación 25, que comprende además un segundo recipiente que contiene un disolvente de reconstitución y dicha sustancia biológicamente activa seleccionada entre un agente farmacéutico y una molécula antigénica.
27. Kit que comprende un recipiente que contiene el liofilizado de la reivindicación 19.
28. Kit, según la reivindicación 27, que comprende además un segundo recipiente que contiene un disolvente de reconstitución.
29. Uso de un derivado de colesterol catiónico para mejorar la reconstitución de un virosoma después de la liofilización, comprendiendo dicho virosoma, en su estado reconstituido, una sustancia biológicamente activa seleccionada entre un agente farmacéutico y una molécula antigénica, en el que dicho virosoma es un virosoma de influenza reconstituido inmunopotenciador (IRIV).
30. Uso, según la reivindicación 29, en el que dicho derivado de colesterol catiónico tiene un sustituyente cargado positivamente en la posición 3 del colesterol y se representa mediante la fórmula siguiente:
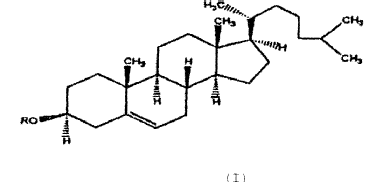
31. Uso, según la reivindicación 30, en el que dicho derivado de colesterol se representa mediante la fórmula:

32. Uso, según la reivindicación 31, en el que R1 y R2 son metilo y R3 es hidrógeno.
33. Uso, según la reivindicación 31, en el que R1, R2 y R3 son metilo.
34. Uso, según cualquiera de las reivindicaciones 29 a 33, en el que el contenido de lípido catiónico en la membrana virosomal está entre 1,9 y 37% molar del contenido total de lípidos de la membrana.
35. Uso, según la reivindicación 34, en el que el contenido de lípido catiónico en la membrana virosomal está entre 1,9 y 16% molar del contenido total de lípidos de la membrana.
36. Uso, según la reivindicación 34 ó 35, en el que el contenido de lípido residual de la membrana virosomal consiste en fosfolípidos.
37. Uso, según la reivindicación 36, en el que los fosfolípidos son fosfatidilcolina y fosfatidiletanolamina.
38. Uso, según cualquiera de las reivindicaciones 30 a 37, que adicionalmente comprende un adyuvante o un sistema adyuvante.
Patentes similares o relacionadas:
Métodos mejorados para la preparación de escualeno, del 15 de Julio de 2020, de NOVARTIS AG: Un procedimiento para la preparación de escualeno a partir de una composición que comprende escualeno a partir de una fuente animal, dicho procedimiento comprendiendo […]
PARTÍCULAS TIPO-VIRUS (VLP) DEL VIRUS DE LA ANEMIA INFECCIOSA DEL SALMÓN (ISAV) COMPRENDIENDO LA PROTEÍNA DE MATRIZ Y UNA O MÁS PROTEÍNAS ANTIGÉNICAS SE DICHO VIRUS; MÉTODO DE OBTENCIÓN, COMPOSICIÓN, VACUNA Y ALIMENTO PARA PECES BACULOVIRUS RECOMBINANTE; Y KIT DE VACUNACIÓN, del 2 de Julio de 2020, de UNIVERSIDAD DE SANTIAGO DE CHILE: El presente invento se refiere al campo de la medicina veterinaria, particularmente, con vacunas y sanidad animal en el ámbito de la acuicultura. […]
Señal para el empaquetamiento de vectores del virus de la gripe, del 24 de Junio de 2020, de WISCONSIN ALUMNI RESEARCH FOUNDATION: Un vector del virus de la gripe para la expresión y empaquetamiento de ARNv recombinante, en el que el vector comprende: secuencias correspondientes […]
Producción de partículas similares al virus de la gripe en plantas, del 6 de Mayo de 2020, de MEDICAGO INC.: Un ácido nucleico que comprende una región reguladora activa en una planta y un potenciador de la expresión activo en una planta, la región […]
Nuevas proteínas de hemaglutinina 5 (H5) para tratamiento y prevención de infecciones gripales, del 15 de Abril de 2020, de BOEHRINGER INGELHEIM VETMEDICA GMBH: Una vacuna que comprende a) proteína H5 del virus gripal, en el que la proteína H5 consiste en o comprende una cualquiera de las secuencias expresadas […]
Vacunas contra la gripe que contienen hemaglutinina y proteínas de la matriz, del 1 de Abril de 2020, de Seqirus UK Limited: Un método para preparar una composición inmunogénica que comprende los pasos de: (i) cultivar el virus de la gripe en cultivo celular en donde se añade tripsina […]
Secuencias y composiciones de péptidos, del 25 de Marzo de 2020, de PEPTCELL LIMITED: Una composición de vacuna contra la gripe, que comprende uno o más polipéptidos que tienen no más de 100 aminoácidos y opcionalmente un excipiente […]
Vacunas adyuvantadas con antígenos de no virión preparadas a partir de virus de la gripe cultivados en cultivo celular, del 4 de Marzo de 2020, de Seqirus UK Limited: Una composición inmunogénica para su uso en un método para generar una respuesta de anticuerpos protectora contra la gripe en un humano, la composición comprendiendo: […]