PROCEDIMIENTO PARA LA MEJORA DE LA ACTIVIDAD DE CONCENTRADOS DE XANTOFILAS DE ORIGEN NATURAL.
Procedimiento para la mejora de la actividad de concentrados de xantofilas de origen natural.
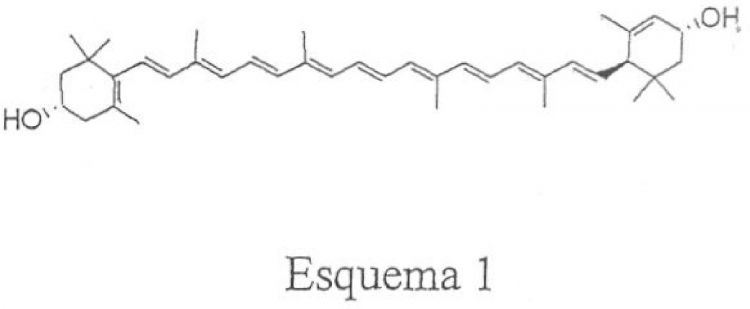
Procedimiento para la mejora de la actividad de concentrados de xantofilas de origen vegetal, ricos en Luteína (Esquema 1), tales como los de marigold (Tagetes erecta) de Alfalfa y otros similares, que consiste en someter el producto obtenido en la saponificación total o parcial del concentrado del extracto vegetal, previamente purificado o no, a un proceso de reducción del tamaño de partícula de las xantofilas y, como consecuencia, a un incremento de su absorción y concentración en sangre y tejidos, tanto humanos como animales.
Los concentrados obtenidos tienen aplicación como aditivos en la alimentación tanto humana como animal
Tipo: Patente de Invención. Resumen de patente/invención. Número de Solicitud: P200701268.
Solicitante: INVESTIGACIONES QUIMICAS Y FARMACEUTICAS, S.A..
Nacionalidad solicitante: España.
Provincia: TARRAGONA.
Inventor/es: FERNANDEZ MARTIN,JUAN ANTONIO, FERRATER MARTORELL,JOAN CARLES, RIBERA RUIZ,DAVID, VISO ACOSTA,ANTONIO.
Fecha de Solicitud: 7 de Abril de 2007.
Fecha de Publicación: .
Fecha de Concesión: 24 de Mayo de 2010.
Clasificación Internacional de Patentes:
- C07C175/00B
- C07C403/24 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07C COMPUESTOS ACICLICOS O CARBOCICLICOS (compuestos macromoleculares C08; producción de compuestos orgánicos por electrolisiso electroforesis C25B 3/00, C25B 7/00). › C07C 403/00 Derivados del ciclohexano o de un ciclohexeno, que contienen una cadena lateral con una parte insaturada de al menos cuatro átomos de carbono en línea, cuya parte está directamente unida a ciclos de ciclohexano o ciclohexeno, p. ej. vitamina A, beta-caroteno, beta-ionona. › que tienen cadenas laterales sustituidas por ciclos no aromáticos de seis miembros, p. ej. beta-caroteno.
Clasificación PCT:
- C07C403/24 C07C 403/00 […] › que tienen cadenas laterales sustituidas por ciclos no aromáticos de seis miembros, p. ej. beta-caroteno.
Fragmento de la descripción:
Procedimiento para la mejora de la actividad de concentrados de xantofilas de origen natural.
En la presente memoria se describe un procedimiento para la mejora de la actividad de concentrados de xantofilas de origen vegetal ricos en Luteína (Esquema 1), tales como la oleorresina de marigold (Tagetes erecta), la de Alfalfa y otros similares, útiles como aditivos en la alimentación, tanto humana como animal.
Esquema 1

La luteína forma parte de un grupo muy amplio de productos de origen natural denominado Carotenoides. Se trata de compuestos químicos caracterizados, estructuralmente, por una elevada cantidad de dobles enlaces conjugados, lo que les confiere una de sus más representativas propiedades, el intenso color.
Dentro de la familia de los carotenoides se pueden distinguir dos grandes grupos. Aquellos cuya estructura está basada en carbono e hidrógeno, exclusivamente, que se denominan habitualmente Carotenos. Y, por otra parte, aquellos que contienen oxígeno, p.e. funciones hidroxilo, cetona o carboxilo, y que se denominan Xantofilas. La Luteína está incluida en este último grupo.
Las xantofilas tienen gran aplicación como aditivos colorantes en la alimentación animal. Es destacable su utilización en la pigmentación de yemas y piel de pollo, así como, en salmónidos y crustáceos.
En cuanto a su actividad en el hombre, se ha descrito su utilidad como protector frente a la oxidación fotoinducida, lo que podría prevenir muchas enfermedades, incluyendo el cáncer. En la bibliografía son frecuentes las referencias a la prevención química en estados precancerosos ó la profilaxis de enfermedades cardiovasculares. Igualmente, se han comprobado efectos beneficiosos en el tratamiento de la degeneración macular asociada a la edad.
La biosíntesis de los carotenoides es debida al metabolismo secundario de plantas verdes, algas, algunos microorganismos y zooplancton. Sin embargo, aunque los animales no tienen la capacidad de sintetizarlos, sí los absorben de los alimentos de su dieta.
La Luteína es una de las xantofilas más ampliamente distribuidas en la naturaleza. Este carotenoide es el principal constituyente de la resina de marigold (Tagetes erecta L.), producto extractivo que constituye una de las fuentes naturales más importantes de xantofilas. La resina de marigold contiene junto con la Luteína pequeñas cantidades de otras xantofilas, principalmente la Zeaxantina.
En esta resina las xantofilas se encuentran esterificadas, es decir, presentan enlaces químicos tipo éster entre grupos hidroxílicos propios de las xantofilas y ácidos grasos.
Es sabido que la absorción intestinal de las xantofilas es menor cuando éstas se encuentran esterificadas. Es por ello que el procesado industrial de los concentrados naturales de carotenoides incluye una reacción química de saponificación, que libera las xantofilas de los enlaces ésteres mejorando así su biodisponibilidad.
El objeto de la presente invención es un procedimiento para la mejora de la actividad de concentrados de extractos vegetales con un contenido elevado en Luteína (Esquema 1), tales como la oleorresina de marigold, respecto de los productos de similar composición descritos en la bibliografía o actualmente comercializados. Esta mejora implica un importante aumento en su poder pigmentante como aditivo en alimentación animal y una elevada mejora en su eficacia para los tratamientos en la salud de animales y humanos.
Estado de la técnica
Aunque se han realizado intentos para la preparación de la Luteína por vía sintética, los rendimientos obtenidos, así como el elevado número de fases que caracteriza a todos ellos, han hecho económicamente inviable su producción según estos esquemas.
Quizás el aspecto más determinante a la hora de optar por la preparación de luteína a partir de extractos vegetales ha sido la elevada concentración de esta xantofila presente en algunas variedades vegetales, en particular, las flores de marigold.
Se han descrito multitud de aproximaciones para la preparación de concentrados de luteína a partir de las fuentes vegetales.
Uno de los primeros ensayos de preparación de xantofilas libres a partir de marigold es el descrito y reivindicado en el año 1970, en US 3523138. En 61 se somete el extracto de marigold a una saponificación con KOH o NaOH en medio alcohólico. La neutralización con ácido fosfórico y el posterior lavado con un disolvente inerte permiten recuperar un concentrado con elevada pureza en xantofilas totales.
En la patente americana US3535426 perteneciente a Eastman Kodak Company se describe un proceso de estabilización de xantofilas provenientes de extractos naturales vegetales que comprende saponificación de la harina de marigold usando elevadas cantidades de hidróxido potásico, etanol y agua. El proceso de saponificación se realizaba bajo atmósfera de nitrógeno y duraba dos horas. Una vez finalizada la saponificación se neutralizaba, se le añadía una grasa saturada y finalmente se secaba para obtener un polvo seco.
En la patente americana US3997679 perteneciente a CPC Internacional, se describe un proceso de preparación de un concentrado estable de xantofilas que consiste en la saponificación parcial de oleorresinas de tagetes erecta mediante una solución metanólica de KOH en condiciones de atmósfera de nitrógeno y durante dos horas. Posterior a la saponificación se añade al crudo de reacción ácido esteárico y cloruro de metileno.
Posteriormente se absorbe sobre un silicato cálcico y se seca al vacío para obtener un producto en forma de polvo fluido.
Un ejemplo posterior es el descrito por Tyczkowski y Hamilton en Poultry Sci., 70 (3), 651-4 (1991). Según su procedimiento se preparan concentrados de luteína con purezas elevadas. El método consiste en la saponificación del extracto de marigold por acción de la KOH alcohólica y su extracción con una mezcla de disolventes (HEAT). Según los autores, tras la separación de fase orgánica y su evaporación parcial se obtiene una luteína cristal, cuya recristalización en hexano:acetona permite aislar cristales con más del 99% de pureza de luteína.
Especial interés presenta el procedimiento general reivindicado por IQF en el año 1995 en ES2099683. Según este método se obtienen concentrados de alta pureza mediante la saponificación de los extractos grasos de marigold ó de páprika por acción de una disolución alcohólica de NaOH o KOH, en presencia, opcionalmente de propilenglicol. La acidificación, separación de la grasa y lavado con disolventes no polares, tales como éter de petróleo, hexano, o bien polares, como glicoles, y posterior extracción permite aislar concentrados en forma de polvo amarillo con más de 60% de concentración en carotenoides totales.
Similar procedimiento es el descrito y reivindicado en US5382714. En este antecedente, tras una saponificación con KOH, se utiliza un sistema agua-alcohol para precipitar y lavar los cristales obtenidos. La recristalización a temperaturas de -10ºC a -20ºC con un disolvente binario del tipo cloruro de metileno:hexano permite, tras un secado a vacío durante 3 días, aislar unos cristales con más del 99% de luteína.
Una variante sobre este esquema general es el descrito en US5648564, según el cual, se obtienen cristales de gran tamaño por adición durante la saponificación de una importante cantidad de propilenglicol. La dilución con agua permite obtener cristales con un 93% de pureza en trans-luteína.
Se han ensayado variantes en el proceso de saponificación. Merece especial mención el descrito en US6262284. Según este procedimiento la saponificación se lleva a cabo fácilmente por acción de KOH a pH 12 en un medio THF: alcohol. La recristalización en THF y agua y, opcionalmente, la cromatografía en columna, permite separar la mezcla de luteína y zeaxantina con una concentración del 70% y 93% de luteína.
En la bibliografía se encuentran algunos otros ejemplos de preparación de concentrados con ligeras diferencias respecto de lo descrito. Así, en US6504067 se describe un procedimiento para preparar xantofilas purificadas a partir de extractos de marigold, de páprika, de Bixa orellana, de Crocus sativa o de Hematococcus pluviales. El proceso de refinado, la saponificación con KOH y agua, el acidulado a pH...
Reivindicaciones:
1. Un procedimiento para la mejora de la actividad de concentrados de xantofilas de origen vegetal ricos en Luteína (Esquema 1), tales como los de marigold (Tagetes erecta), de Alfalfa y otros similares, útiles como aditivos en la alimentación tanto humana como animal, que consiste en someter el producto obtenido en la saponificación total o parcial del concentrado del extracto vegetal, previamente purificado o no, a un proceso de reducción del tamaño de partícula de las xantofilas y, como consecuencia, a un incremento de su absorción y concentración en sangre y en tejidos, tanto humanos como animales.
Esquema 1

2. Un procedimiento de acuerdo con la reivindicación 1 en el que el proceso de reducción del tamaño de partícula se lleva a cabo sobre un concentrado de marigold total o parcialmente saponificado.
3. Un procedimiento de acuerdo con la reivindicación 1 en el que el proceso de reducción del tamaño de partícula se lleva a cabo sobre un concentrado, purificado ó no, de Alfalfa total o parcialmente saponificado.
4. Un procedimiento de acuerdo con la reivindicación 1 en el que el proceso de reducción del tamaño de partícula se lleva a cabo sobre un concentrado de oleorresina de marigold saponificado y purificado con un contenido en Luteína + Zeaxantina superior al 85% sobre el contenido total de carotenoides y una riqueza superior al 50% en carotenoides totales.
5. Un procedimiento para la preparación de un producto descrito en la reivindicación 1 en el que el proceso de reducción del tamaño de partícula se lleva a cabo según las siguientes fases:
6. Un procedimiento de acuerdo con la reivindicación 5 donde la oleorresina está constituida por un extracto graso de Tagetes erecta.
7. Un procedimiento según las reivindicaciones 5 y 6, donde la temperatura de reacción se mantiene entre 100ºC y 220ºC, preferentemente entre 150ºC y 190ºC.
8. Un procedimiento según las reivindicaciones 5 a 7 donde el tiempo de reacción está entre 0.1 y 500 segundos, preferiblemente entre 1 y 60 segundos.
9. Un procedimiento según las reivindicaciones 5 a 8 donde la reacción se verifica en ausencia de oxígeno.
10. Un procedimiento según las reivindicaciones 5 a 9 donde el enfriamiento se produce mediante esprayado en una torre de atomización.
11. Un procedimiento según la reivindicación 10 donde se añade a la corriente de aire utilizado en el esprayado partículas en suspensión de óxido de silicio coloidal, estearato cálcico, estearato magnésico, almidón hidrófobo o una mezcla de todos o de algunos de ellos.
12. Un procedimiento según las reivindicaciones 5 a 9 donde el enfriamiento se produce mediante mezclado con agua para obtener una emulsión líquida de carotenoides.
13. Un procedimiento para la preparación de un producto descrito en la reivindicación 1 en el que el proceso de reducción del tamaño de partícula se lleva a cabo según las siguientes fases:
14. Un procedimiento de saponificación de acuerdo con la reivindicación 13 donde la oleorresina está constituida por un extracto graso de Tagetes erecta.
15. Un procedimiento según las reivindicaciones 13 y 14, donde la temperatura de reacción se mantiene entre 100ºC y 220ºC, preferentemente entre 150ºC y 190ºC.
16. Un procedimiento según las reivindicaciones 13 a 15 donde el tiempo de reacción está entre 0.1 y 500 segundos, preferiblemente entre 1 y 60 segundos.
17. Un procedimiento según las reivindicaciones 13 a 16 donde la reacción se verifica en ausencia de oxígeno.
18. Un procedimiento según las reivindicaciones 13 a 17 donde el enfriamiento se produce mediante esprayado en una torre de atomización.
19. Un procedimiento según la reivindicación 18 donde se añade a la corriente de aire utilizado en el esprayado partículas en suspensión de óxido de silicio coloidal, estearato cálcico, estearato magnésico, almidón hidrófobo o una mezcla de todos o de algunos de ellos.
20. Un procedimiento según las reivindicaciones 13 a 17 donde el enfriamiento se produce mediante mezclado en agua para obtener una emulsión líquida de carotenoides.
21. Un procedimiento de acuerdo con la reivindicación 1 en el que el proceso de reducción del tamaño de partícula se realiza por dispersión de los cristales de Luteína, cruda o purificada, procedente del saponificado de la oleorresina, en un medio de naturaleza lipídica seleccionado entre un aceite vegetal, un mono o diglicérido, sus derivados y/o una mezcla de ellos.
22. Un procedimiento según la reivindicación 1 en el que el 100% de las partículas de xantofilas en el producto obtenido está por debajo de 5 micras.
23. Un procedimiento según la reivindicación 22 en el que el 95% de las partículas de xantofilas en el producto obtenido está por debajo de 1 micra.
24. Una preparación obtenida de acuerdo con la reivindicación 11 utilizable en la pigmentación de tejidos animales, preferentemente en aves, huevos y peces.
25. Una preparación líquida obtenida de acuerdo con la reivindicación 12 utilizable en la pigmentación de tejidos animales, preferentemente en aves, huevos y peces.
26. Una preparación obtenida de acuerdo con la reivindicación 19 utilizable para mejorar de la salud de perros y gatos.
27. Una preparación para la alimentación humana obtenida de acuerdo con la reivindicación 19, utilizable para el tratamiento de determinadas afecciones como la degeneración macular.
28. Una preparación para la alimentación humana obtenida de acuerdo con la reivindicación 19, utilizable como aditivo para la alimentación como colorante y/o antioxidante.
29. Una preparación para la alimentación humana obtenida de acuerdo con la reivindicación 19, utilizable como ingrediente alimentario funcional por su aportación de vitamina.
30. Una preparación líquida obtenida de acuerdo con la reivindicación 20 utilizable para mejorar de la salud de perros y gatos.
31. Una preparación líquida para la alimentación humana obtenida de acuerdo con la reivindicación 20, utilizable para el tratamiento de determinadas afecciones como la degeneración macular.
32. Una preparación líquida para la alimentación humana obtenida de acuerdo con la reivindicación 20, utilizable como aditivo para la alimentación como colorante y/o antioxidante.
33. Una preparación líquida para la alimentación humana obtenida de acuerdo con la reivindicación 20, utilizable como ingrediente alimentario funcional por su aportación de vitamina.
Patentes similares o relacionadas:
Procedimiento para la purificación de astaxantina, del 25 de Diciembre de 2019, de DSM IP ASSETS B.V.: Un procedimiento para la fabricación de astaxantina sintética de calidad alimentaria, que comprende las siguientes etapas: a) proporcionar cristales de astaxantina […]
Procedimiento para la purificación de astaxantina, del 25 de Diciembre de 2019, de DSM IP ASSETS B.V.: Un procedimiento para la fabricación de astaxantina sintética de calidad alimentaria con un contenido de diclorometano ≤ 250 ppm, que comprende las siguientes […]
Procedimiento para la purificación de astaxantina, del 25 de Diciembre de 2019, de DSM IP ASSETS B.V.: Un procedimiento para la fabricación de astaxantina sintética de calidad alimentaria con un contenido de diclorometano ≤ 250 ppm, que comprende […]
Procedimiento para la purificación de astaxantina, del 2 de Octubre de 2019, de DSM IP ASSETS B.V.: Un procedimiento para la fabricación de astaxantina sintética de calidad alimentaria, que comprende las siguientes etapas: a) proporcionar cristales de […]
Composiciones de astaxantina (IV), del 22 de Mayo de 2019, de BASF SE: Uso de composiciones de astaxantina en alimentos, suplementos alimenticios o alimentos para animales, en el que la composición de astaxantina contiene al menos el 90 % en […]
Procedimiento para la preparación de astaxantina a partir de astacina, del 17 de Abril de 2019, de BASF SE: Procedimiento para la preparación de astaxantina de la fórmula **Fórmula** en la que el centro de asimetría en posición 3 y 3' es racémico o en cada caso tiene la […]
Un procedimiento para el aislamiento de cristales de luteína y zeaxantina a partir de fuentes vegetales, del 3 de Abril de 2019, de Katra Phytochem (India) Private Limited: Un procedimiento para el aislamiento de cristales de carotenoides, que comprende: secar una parte de la planta para obtener una harina; […]
Procedimiento para aislar un carotenoide a partir de un bioorganismo productor de carotenoides, del 7 de Septiembre de 2018, de DSM IP ASSETS B.V.: Un procedimiento para el aislamiento de un carotenoide a partir de un bioorganismo productor de carotenoides que comprende las siguientes etapas: […]