FORMULACION LIOFILIZADA ESTABILIZADA, PARA DERIVADOS DE CEFALOSPORINA.
Formulación liofilizada para derivados de la cefalosporina, la cual es farmacéuticamente aceptable,
la cual comprende por lo menos un derivado de cefalosporina como ingrediente activo, en donde el derivado de cefalosporina es un compuesto de fórmula general I siguiente:
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/CH2005/000665.
Solicitante: BASILEA PHARMACEUTICA AG.
Nacionalidad solicitante: Suiza.
Dirección: GRENZACHERSTRASSE 487,4005 BASEL.
Inventor/es: HEUBES,MARKUS, SCIGALLA,WILHELM.
Fecha de Publicación: .
Fecha Concesión Europea: 26 de Mayo de 2010.
Clasificación Internacional de Patentes:
- A61K9/00M5
- A61K9/19 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › liofilizados.
Clasificación PCT:
- A61K31/546 A61K […] › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › conteniendo otros heterociclos, p. ej. cefalotina.
- A61K47/26 A61K […] › A61K 47/00 Preparaciones medicinales caracterizadas por los ingredientes no activos utilizados, p. ej. portadores o aditivos inertes; Agentes de direccionamiento o agentes modificadores enlazados químicamente al ingrediente activo. › Hidratos de carbono, p. ej. alcoholes de azúcares, amino azúcares, ácidos nucleicos, mono-, di- u oligo-sacáridos; Sus derivados, p. ej. polisorbatos, ésteres de ácidos grasos sorbitano o glicirricina.
- A61K47/32 A61K 47/00 […] › Compuestos macromoleculares obtenidos por reacciones en las que intervienen solamente enlaces insaturados carbono-carbono, p. ej. carbómeros (resinas de carbopol).
- A61K9/19 A61K 9/00 […] › liofilizados.
Fragmento de la descripción:
Formulación liofilizada estabilizada, para derivados de cefalosporina.
La presente inversión se refiere a una formulación liofilizada para derivados de cefalosporina, los cuales tienen una elevada estabilidad, una solución para su obtención, y un método para la preparación de dicha formulación, así como también el empleo de ciertos compuestos para la estabilización de los derivados de cefalosporina en formulaciones liofilizadas.
La patente WO 03/04543 A describe formulaciones obtenidas por liofilización, que comprende una cefalosporina y un agente de carga, como por ejemplo, azúcares, polialcoholes (por ejemplo manitol), aminoácidos, polímeros (por ejemplo polivinilpirrolidona), o polisacáridos.
La patente EP 0 325 112 A describe que las cefalosporinas se liofilizan con lactosa, glucosa, sacarosa, galactosa, manitol, fructosa, o sorbitol.
La revista Chem. Abs. 140:65205 (resumen de WO 2004/000 323), describe que una cefalosporina se liofiliza con un aditivo como por ejemplo, la glucosa.
Además Oguchi T et al., (1992) Chem. Pharm. Bull. 40: 1061-1063, EP 0 253 329 A y EP 0 421 227 A, describen la liofilización de las cefalosporinas en presencia de azúcares.
Es sabido que la liofilización puede tener un efecto considerable sobre la degradación de los ingredientes farmacéuticamente activos de una formulación, así como también un fuerte impacto sobre su estabilidad en forma liofilizada. Las variables que afectan estos parámetros son principalmente el pH, la cantidad presente de sales, el tipo y cantidad de excipientes de la formulación, así como también las temperaturas, la presión y el tiempo seleccionados para las operaciones de congelación, sublimación y secado.
Para la estabilización de los productos liofilizados, se emplean a menudo aminoácidos y polioles; pero la literatura que es altamente abundante sobre el tema, no da ninguna información sobre la solución al problema general de la obtención de una formulación farmacéutica estable.
Más particularmente, la literatura describe que la presencia de un aminoácido, de un poliol, por ejemplo manitol, de una fase cristalina o de una fase amorfa, puede tener, junto a ciertas ventajas, desventajas que conducen, en el caso de los productos liofilizados que contienen ingredientes activos particularmente sensibles como por ejemplo los derivados de cefalosporina, a vidas útiles relativamente cortas y/o bajas temperaturas de almacenamiento para estos productos liofilizados.
El papel de los polioles y de los aminoácidos ha sido separadamente estudiado en el caso de la hormona de crecimiento humano (hGH), pero su efecto sinérgico está todavía pobremente aclarado (Pikal M.J., Dellermann K. M., Roy M. L., Riggin M. N., The effects of formulation variables on the stability of freeze-dried Human Growth Hormone ("Efectos de las variables de formulación sobre la estabilidad de la hormona de crecimiento humana liofilizada"), Pharm. Research., 1991, 8, No. 4, 427-436).
Las ventajas y desventajas ligadas a la presencia de aminoácidos y de manitol se relacionan a continuación.
Ventajas ligadas a la presencia de aminoácidos
Se ha demostrado que la presencia de glicina en un producto liofilizado induce la cristalización de las moléculas presentes en la solución durante el paso de congelación del liofilizado (Korey D. J., Schwartz J. B., Effects of excipients on the crystallization of pharmaceutical compounds during lyophilization ("Efectos de los excipientes sobre la cristalización de compuestos farmacéuticos durante la liofilización"), J. Parenteral Sci. Tech., 1989, 43 (2): 80-83). Esta cristalización del ingrediente activo hace posible potenciar su estabilidad.
La alanina, en forma cristalizada, tiene la ventaja de prevenir el colapso del producto liofilizado durante la sublimación y secaje, y/o permitiendo la producción de un producto liofilizado con un área de superficie específica mayor y por lo tanto permite un secado más rápido (Pikal M. J., Freeze-drying of proteins, Biopharm., 26-30 Octubre 1990).
Desventajas ligadas a la presencia de aminoácidos
La adición de un aminoácido a un azúcar o a un poliol en una solución que debe liofilizarse, tiene generalmente el efecto de disminuir la temperatura de transición vítrea del azúcar (te Booy M. P. W. M., de Ruiter R. A., de Meere A. L. J., Evaluation of the physical stability of freeze-dried sucrose containing formulations by differential scanning calorimetry ("Evaluación de la estabilidad física de formulaciones conteniendo sucrosa liofilizada mediante calorimetría diferencial de barrido"), Pharm. Research., 1992, 9, 109-114). En este caso, una disminución de la temperatura de transición vítrea, es generalmente sinónimo de una baja estabilidad de un producto liofilizado (Franks F., Freeze-drying; from empiricism to predictability ("Liofilizado; del empirismo a la previsibilidad"), Cryo-letters, 1990, 11, 93-110).
Ventajas ligadas a la presencia de manitol
La presencia de manitol en la composición de un producto proteínico liofilizado, se justifica generalmente como un agente de carga, es decir, que hace posible el mantener tanto la estructura sólida como rígida del volumen del producto liofilizado correspondiente al volumen de la solución que hay que liofilizar, pero su presencia hace también posible ajustar la isotonicidad de la solución reconstituida para ser inyectada. Cuando el manitol es el excipiente predominante en la composición de un producto proteínico liofilizado está más a menudo en forma cristalina ("Lyophilized formulations recombinant tumor necrosis factor" ("Formulaciones liofilizadas del factor de necrosis tumoral recombinante"), Hora M. S., Rana R. K., Smith F. W., Pharm. Res., 1992, 9 (1), 33-36).
Desventajas ligadas a la presencia de manitol
Se ha informado que el grado de hidrólisis del succinato de metilprednisolona de sodio, en forma liofilizada, fue mayor en presencia de manitol que en presencia de lactosa, y que este nivel aumentó con la cantidad de manitol presente en el producto liofilizado. Esto se ha explicado por el hecho de que la cristalización del manitol durante la liofilización cambia la distribución del agua en la matriz del producto liofilizado. El aumento de la cantidad de agua presente en el microambiente del ingrediente activo resultante del mismo, potencia la hidrólisis del ingrediente activo y reduce su estabilidad ("The effect of bulking agent on the solid state stability of freeze dried methylprednisolone sodium succinate") ("Efecto del agente de carga sobre la estabilidad del estado sólido del succinato de metil prednisolona de sodio liofilizado"), Herman B. D., Sibclair B. D., Milton N., Nail S. L., Pharma. Res., 1994, 11 (10), 1467-1473).
La cinética de la degradación para varios derivados de la cefalosporina en soluciones acuosas para diversos hidratos de carbono, alcoholes polihídricos, se demostró que aumentaba al aumentar la concentración de un compuesto de hidroxilo ("The influence of carbohydrates and polyhydric alcohols on the stability of cephalosporins in aqueous solutions" ("Influencia de los hidratos de carbono y alcoholes polihídricos sobre la estabilidad de las cefalosporinas en soluciones acuosas"), Hans Bundgaard, Claus Larsen, Intl. Journal of Pharmaceutics, octubre de 1983, 16, 3, 319-325).
Además, el manitol en la liofilización se emplea corrientemente como agente de carga o como agente de constitución, dando como resultado una torta estable, homogénea, con buen aspecto, no conocido como estabilizador para compuestos no proteínicos, en particular derivados de la cefalosporina (ver por ejemplo Handbook of Pharmaceutical Excipients ("Manual de excipientes farmacéuticos"), Rowe, R.C., Sheskey, P. J, Weller, P. J. cuarta edición, PhP, Londres, 373-377).
En definitiva, la literatura científica sobre el tema del efecto de los excipientes sobre la estabilización de ingredientes activos farmacéuticos da una información contradictoria sobre sus propiedades y además no es posible obtener ninguna información sobre el tema de las relaciones entre la estructura de un producto liofilizado y su estabilidad. De manera similar, el papel de los polioles y de los aminoácidos, solos o en combinación, no está descrito como un conjunto de propiedades generalizables, sino que ha sido observado con resultados contradictorios de acuerdo con los principios activos estudiados y las cantidades de excipientes empleados.
En base al estado descrito más arriba de la ciencia anterior, es objeto de la presente invención el proporcionar...
Reivindicaciones:
1. Formulación liofilizada para derivados de la cefalosporina, la cual es farmacéuticamente aceptable, la cual comprende por lo menos un derivado de cefalosporina como ingrediente activo, en donde el derivado de cefalosporina es un compuesto de fórmula general I siguiente:
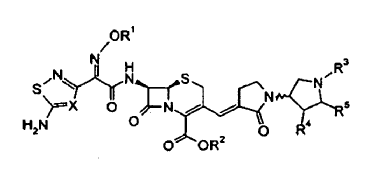
en donde
R1 es hidrógeno, alquilo de 1 a 6 átomos de carbono, opcionalmente substituido por fluor, o cicloalquilo de 3 a 6 átomos de carbono;
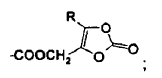
R2 es hidrógeno o un grupo seleccionado de -CH2C(=CHR)-COOR, -CH2OCOR, -CH(R)OCOR, -CH(R)OCOOR, -CH(OCOR)OCOR, -CH2COCH2OCOR, y
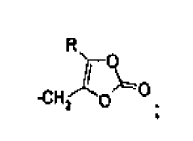
R3 es hidrógeno o un grupo seleccionado de -CH2C(=CH2)-COOR, -COOCH2C(=CHR)-COOR, -COOCH2OCOR, -COOCH(R)OCOR, -COOCH(R)OCOOR, -COOCH(OCOR)OCOR, -COOCH2COCH2OCOR, y
con la condición de que uno de R2 y R3 es hidrógeno y el otro de R2 y R3 es diferente de hidrógeno,
así como también sales farmacéuticamente aceptables y polimorfos de dichos compuestos e hidratos de los compuestos de fórmula I y de sus sales,
y manitol como estabilizador.
2. Formulación liofilizada de acuerdo con la reivindicación 1, en donde el derivado de cefalosporina es el ácido (6R,7R)-7-[(Z)-2-(amino-[1,2,4]tiadiazol-3-il)-2-hidroxiimino-acetilamino]-3-[(E)-(3'R,5'R)-5'-hidroximetil-1'-(5- metil-2-oxo-[1,3]-dioxol-4-ilmetiloxicarbonil-2-oxo-[1,3']bipirrolidinil-3-ilidenometil]-8-oxo-5-tia-1-aza-biciclo [4.2.0]oct-2-eno-2-carboxílico.
3. Formulación liofilizada, de acuerdo con la reivindicación 1 ó 2, que contiene además uno o más compuestos seleccionados entre tampones, aminoácidos, ácidos o bases para el ajuste del pH, surfactantes, sales, conservantes, antioxidantes y agentes quelantes.
4. Formulación liofilizada, de acuerdo con una cualquiera de las reivindicaciones 1 a 3, para la reconstitución de una solución para su administración mediante ruta parenteral, ruta intramuscular, ruta oral o por via de inhalación; o para administración directa por vía de ruta oral o por vía de inhalación.
5. Formulación de acuerdo con una cualquiera de las reivindicaciones 1 a 4, obtenida después de la liofilización de una solución que comprende por lo menos una cefalosporina como ingrediente activo, en donde la cefalosporina es un compuesto de fórmula I como se ha definido en la reivindicación 1, manitol y una solución acuosa.
6. Formulación de acuerdo con la reivindicación 5, en donde la solución acuosa es una solución tampón.
7. Formulación de acuerdo con la reivindicación 6, en donde la solución de tampón es un tampón de citrato acuoso.
8. Formulación de acuerdo con una cualquiera de las reivindicaciones 5 a 7, en donde la concentración de manitol en la solución está en el margen de 2 - 40% en peso.
9. Formulación de acuerdo con una cualquiera de las reivindicaciones 5 a 8, en donde el pH de la solución está en el margen de 2,0 - 6,5, en particular en el margen de 4,0 - 5,0.
10. Solución para la obtención de una formulación liofilizada, la cual comprende por lo menos un derivado de cefalosporina como ingrediente activo, en donde el derivado de cefalosporina es un compuesto de fórmula I como se ha definido en la reivindicación 1, y un estabilizador el cual es el manitol en una solución acuosa.
11. Método para la preparación de una formulación farmacéuticamente aceptable liofilizada estabilizada, para derivados de cefalosporina, en donde el derivado de cefalosporina es un compuesto de fórmula I como se ha definido en la reivindicación 1, el cual método comprende los pasos de
(a) adición del estabilizador manitol a una solución acuosa de un derivado de cefalosporina; y
(b) liofilización de la solución anterior.
12. Empleo del manitol para la estabilización de derivados de cefalosporina, en donde el derivado de cefalosporina es un compuesto de fórmula I como se ha definido en la reivindicación 1, en formulaciones liofilizadas.
Patentes similares o relacionadas:
Formulaciones liofilizadas para antídoto del factor Xa, del 1 de Julio de 2020, de PORTOLA PHARMACEUTICALS, INC.: Una formulación acuosa, que comprende de 10 mM a 55 mM de arginina, de 1% a 3% de sacarosa (p/v), de 2% a 8% de manitol (p/v), y al menos 5 mg/ml de un polipéptido […]
Formulaciones de nanopartículas y usos de las mismas, del 24 de Junio de 2020, de ABRAXIS BIOSCIENCE, LLC: Una composición que comprende nanopartículas, en donde las nanopartículas comprenden un derivado de taxano hidrófobo recubierto con albúmina, en donde al menos […]
Método de producción de compuestos de inclusión de flavonoide, del 3 de Junio de 2020, de TAIYO KAGAKU CO., LTD.: Un método de producción de un compuesto de inclusión de flavonoide, que comprende una etapa de escisión que comprende tratar un flavonoide escasamente […]
Composición de principios activos liofilizada, del 27 de Mayo de 2020, de MedSkin Solutions Dr. Suwelack AG: Cuerpo moldeado liofilizado, caracterizado porque contiene ≥ 75% en peso de ácido ascórbico, dado el caso principios activos adicionales y < […]
Preparación liofilizada de toxina botulínica, del 20 de Mayo de 2020, de Medy-Tox, INC. (100.0%): Preparación liofilizada farmacéutica que comprende: toxina botulínica, polisorbato y metionina; y uno o más componentes seleccionados del grupo que consiste en azúcar, […]
Formulación de Mesna y su uso, del 29 de Abril de 2020, de AuXin Surgery SA: Un dispositivo para administrar una formulación de Mesna a tejidos y/u órganos, que comprende una primera cámara que comprende el Mesna en forma sólida, una segunda cámara […]
Composición farmacéutica estable de la proteína de fusión TNFR:Fc etanercept, del 29 de Abril de 2020, de Lupin Atlantis Holdings, SA: Composición farmacéutica estable que comprende etanercept, tampón fosfato-citrato y L-glicina como agente antiagregante.
Formulación parenteral de esmolol, del 15 de Abril de 2020, de AOP ORPHAN PHARMACEUTICALS AG: Formulación parenteral de clorhidrato de esmolol para su uso en el tratamiento de un paciente que padece taquicardia que comprende un polvo liofilizado que consiste en clorhidrato […]