FORMAS CRISTALINAS DE 1-CLORO-4-(BETA-D-GLUCOPIRANOS-1-IL)-2-(4-((R)-TETRAHIDROFURANO-3-ILOXI)-BENCIL)-BENCENO, METODO PARA SU FABRICACION Y UTILIZACION DE LAS MISMAS PARA LA PREPARACION DE MEDICAMENTOS.
Forma cristalina I de 1-cloro-4-(ß-D-glucopiranos-1-il)-2-[4-((R)-tetrahidrofurano-3-iloxi)-bencil]-benceno que tiene un modelo de difracción en material en polvo por rayos X que comprende picos en 17,
86, 18,01 y 19,24 grados * en el que dicho modelo de difracción de material en polvo por rayos X se consigue utilizando radiación CuKa 1
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2006/061957.
Solicitante: BOEHRINGER INGELHEIM INTERNATIONAL GMBH
BOEHRINGER INGELHEIM PHARMA GMBH & CO.KG.
Nacionalidad solicitante: Alemania.
Dirección: BINGER STRASSE 173,55216 INGELHEIM AM RHEIN.
Inventor/es: ECKHARDT, MATTHIAS, HIMMELSBACH, FRANK, SICK,SANDRA, SCHUEHLE,MARTIN, MARTIN,HANS-JURGEN BOEHRINGER INGELHEIM CD PATENTS GMBH.
Fecha de Publicación: .
Fecha Concesión Europea: 3 de Marzo de 2010.
Clasificación Internacional de Patentes:
- C07D309/10 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 309/00 Compuestos heterocíclicos que contienen ciclos de seis miembros que tienen un átomo de oxígeno como único heteroátomo del ciclo, no condensados con otros ciclos. › Atomos de oxígeno.
- C07D407/12 C07D […] › C07D 407/00 Compuestos heterocíclicos que contienen dos o más heterociclos, teniendo al menos un ciclo átomos de oxígeno como únicos heteroátomos del ciclo, no previstos por el C07D 405/00. › unidos por una cadena que contiene heteroátomos como enlaces de cadena.
Clasificación PCT:
- A61K31/351 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › no condensados con otro ciclo.
- C07D309/10 C07D 309/00 […] › Atomos de oxígeno.
Fragmento de la descripción:
Formas cristalinas de 1-cloro-4-(ß-D-glucopiranos-1-il)-2-[4-((R)-tetrahidrofurano-3-iloxi)-bencil]-benceno, método para su fabricación y utilización de las mismas para la preparación de medicamentos.
La presente invención se refiere a formas cristalinas de 1-cloro-4-(ß-D-glucopiranos-1-il)-2-[4-((R)-tetrahidrofurano-3-iloxi)-bencil]-benceno, a un método para su fabricación, así como a la utilización de las mismas para la preparación de medicamentos.
Antecedentes de la invención
Los fenil-C-glucósidos de fórmula general

y su fabricación, así como su posible actividad como inhibidores de SGLT2 y su posible utilización en el tratamiento de diabetes son conocidos a partir de la solicitud internacional WO 02/083066 que corresponde a EP 1 385 856.
El compuesto 1-cloro-4-(ß-D-glucopiranos-1-il)-2-[4-((R)-tetrahidrofurano-3-iloxi)-bencil]-benceno (que se designará a continuación como "compuesto A") se describe en la solicitud de patente internacional WO 2005/092877 y tiene la estructura química de acuerdo con la fórmula A

Los compuestos que se describen tienen un valioso efecto inhibidor del cotransportador SGLT de glucosa dependiente de sodio, particularmente SGLT2. El método de fabricación del compuesto A, que se describe en aquella publicación, no proporciona una forma cristalina.
Una cierta actividad farmacéutica es, desde luego, el prerrequisito básico a cumplir por un agente farmacéuticamente activo antes de que el mismo sea aprobado como medicamento en el mercado. No obstante, existe una serie de exigencias adicionales que debe cumplir un agente farmacéuticamente activo. Estas exigencias se basan en diferentes parámetros que están relacionados con la naturaleza de la propia sustancia activa. Sin que ello sea limitativo, son ejemplos de dichos parámetros la estabilidad del agente activo en varias condiciones ambientales, su estabilidad durante la fabricación de la formulación farmacéutica y la estabilidad del agente activo en las composiciones finales del medicamento. La sustancia farmacéuticamente activa utilizada para preparar los compuestos farmacéuticos debe ser lo más pura posible y su estabilidad para un largo periodo de almacenamiento debe estar garantizada en diferentes condiciones ambientales. Esto es esencial para prevenir la utilización de compuestos farmacéuticos que contienen, además de la sustancia activa real, por ejemplo, productos de fraccionamiento de la misma. En estos casos, el contenido de sustancia activa en el medicamento podría ser menor que el especificado.
La distribución uniforme del medicamento en la formulación es un factor crítico, particularmente cuando el medicamento tiene que ser administrado en dosis reducidas. Para asegurar una distribución uniforme, el tamaño de las partículas de una sustancia activa puede ser reducida a un nivel adecuado, por ejemplo, por molturación. Dado que el fraccionamiento de la sustancia farmacéuticamente activa como efecto secundario de la molturación (o micronización) tiene que ser evitado en la mayor medida posible, a pesar de las exigentes condiciones requeridas durante el proceso, es esencial que la sustancia activa deba ser altamente estable a lo largo de todo el proceso de molturación. Solamente si la sustancia activa es suficientemente estable durante el proceso de molturación, resulta posible fabricar una formulación farmacéutica homogénea que contiene siempre la cantidad especificada de sustancia activa de manera reproducible.
Otro problema que se presenta en el procedimiento de molturación para preparar la formulación farmacéutica deseada es la introducción de energía provocada por este procedimiento y los esfuerzos sobre la superficie de los cristales. Eso puede conducir en algunas circunstancias a cambios polimorfos, a la amorfización o al cambio de la retícula cristalina. Dado que la calidad farmacéutica de una formulación farmacéutica requiere que la sustancia activa deba tener siempre la misma morfología cristalina, también desde este punto de vista la estabilidad y características de la sustancia cristalina activa están sometidas a estrictas exigencias.
La estabilidad de una sustancia farmacéuticamente activa es también importante en los compuestos farmacéuticos para determinar la vida de almacenamiento del medicamento específico; la vida de almacenamiento es el periodo de tiempo durante el cual el medicamento puede ser administrado sin riesgo alguno. Por lo tanto, una elevada estabilidad del medicamento en los compuestos farmacéuticos antes mencionados en diferentes condiciones de almacenamiento es una ventaja adicional tanto para el paciente como para el fabricante.
La absorción de humedad reduce el contenido de sustancia farmacéuticamente activa como resultado del aumento de peso provocado por la absorción de agua. Los compuestos farmacéuticos con tendencia a absorber humedad tienen que ser protegidos contra la humedad durante el almacenamiento, por ejemplo, por añadidura de agentes secantes adecuados o por almacenamiento del medicamento en un medio ambiente en el que está protegido contra la humedad. Por lo tanto, de modo preferente, una sustancia farmacéuticamente activa debe ser solamente ligeramente higroscópica.
Además, la disponibilidad de una forma cristalina bien definida permite la purificación de la sustancia medicamentosa por recristalización.
Aparte de las exigencias que se han indicado, se debe tener en cuenta de manera general que cualquier cambio en el estado sólido de un compuesto farmacéutico que es capaz de mejorar su estabilidad física y química proporciona una ventaja significativa con respecto a formas menos estables del mismo medicamento.
El objetivo de la invención es, por lo tanto, dar a conocer una forma cristalina estable del compuesto A que cumple importantes exigencias impuestas en las sustancias farmacéuticamente activas tal como se ha indicado en lo anterior.
Objeto de la invención
En un primer aspecto, la presente invención se refiere a una forma cristalina del compuesto A.
En un segundo aspecto la presente invención se refiere a la forma cristalina I del compuesto A que tiene un modelo de difracción de material en polvo por rayos X que comprende picos en 17,86, 18,01 y 19,24 grados 2
En un tercer aspecto la presente invención se refiere al compuesto A en el como mínimo 50% de dicha sustancia se encuentra presente en forma cristalina I, tal como se ha definido en lo anterior y a continuación.
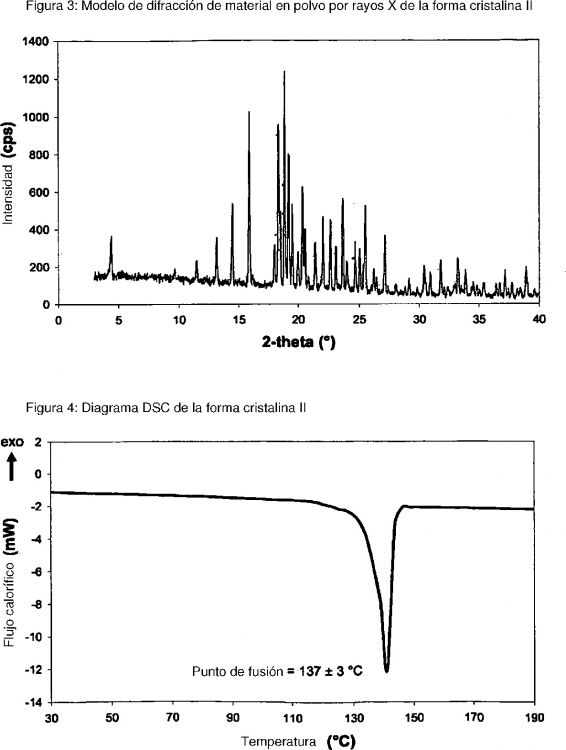
En un cuarto aspecto la presente invención se refiere a la forma cristalina II del compuesto A que tiene un modelo de difracción de material en polvo por rayos X que comprende picos en 15,88, 18,36, 18,87 y 19,20 grados 2
En un quinto aspecto la presente invención se refiere al compuesto A en el que, como mínimo, 50% de dicha sustancia se encuentra presente en forma cristalina II tal como se ha definido en lo anterior y más adelante.
Teniendo en cuenta la eficacia farmacéutica del compuesto A, un sexto aspecto de la presente invención se refiere a un compuesto farmacéutico o medicamento que comprende una forma cristalina tal como se ha definido en lo anterior y a continuación.
En un séptimo aspecto la presente invención se refiere a la utilización de una forma cristalina, tal como se ha definido en lo anterior o a continuación, para preparar un compuesto farmacéutico que es adecuado para el tratamiento o prevención de enfermedades o de estados sobre los que se puede influir inhibiendo al cotransportador SGLT de glucosa dependiente de sodio, preferentemente SGLT2.
En un octavo aspecto la presente invención se refiere a la utilización de una forma cristalina, tal como se ha definido en lo anterior o a continuación, para preparar un compuesto farmacéutico adecuado para el tratamiento o prevención de desórdenes metabólicos.
En un noveno aspecto, la presente invención se refiere a la utilización de una forma cristalina tal como se ha definido en...
Reivindicaciones:
1. Forma cristalina I de 1-cloro-4-(ß-D-glucopiranos-1-il)-2-[4-((R)-tetrahidrofurano-3-iloxi)-bencil]-benceno que tiene un modelo de difracción en material en polvo por rayos X que comprende picos en 17,86, 18,01 y 19,24 grados 2
2. Forma cristalina I, según la reivindicación 1, en la que el modelo de difracción de material en polvo por rayos X comprende además picos en 24,05 y 24,51 grados 2
3. 1-cloro-4-(ß-D-glucopiranos-1-il)-2-[4-((R)-tetrahidrofurano-3-iloxi)-bencil]-benceno en el que, como mínimo, el 50% de dicha sustancia se encuentra presente en forma cristalina I, de acuerdo con la reivindicación 1 ó 2.
4. Forma cristalina II de 1-cloro-4-(ß-D-glucopiranos-1-il)-2-[4-((R)-tetrahidrofurano-3-iloxi)-bencil]-benceno que tiene un modelo de difracción material en polvo por rayos X que comprende picos en 15,88, 18,36, 18,87 y 19,20 grados 2
5. Forma cristalina II, según la reivindicación 4, en la que el modelo de difracción de material en polvo por rayos X comprende además picos en 20,36 y 23,64 grados 2
6. 1-cloro-4-(ß-D-glucopiranos-1-il)-2-[4-((R)-tetrahidrofurano-3-iloxi)-bencil]-benceno en el que, como mínimo, el 50% de dicha sustancia se encuentra presente en forma cristalina II, de acuerdo con las reivindicaciones 4 ó 5.
7. Compuesto farmacéutico que comprende una forma cristalina, de acuerdo con la reivindicación 1 ó 2.
8. Compuesto farmacéutico que comprende una forma cristalina, de acuerdo con la reivindicación 4 ó 5.
9. Utilización de una forma cristalina, según las reivindicaciones 1, 2, 4 ó 5, para la preparación de una composición farmacéutica que es adecuada para el tratamiento o prevención de enfermedades o estados que pueden ser influidos por inhibición del cotransportador SGLT de glucosa dependiente del sodio.
10. Utilización de una forma cristalina, según las reivindicaciones 1, 2, 4 ó 5, para la preparación de una composición farmacéutica que es adecuada para el tratamiento o la prevención de enfermedades de desórdenes metabólicos, en particular un desorden metabólico seleccionado entre el grupo que comprende diabetes mellitus tipos 1 y 2, complicaciones de diabetes, acidosis o cetosis metabólica, hipoglicemia reactiva, hiperinsulinemia, desórdenes metabólicos de la glucosa, resistencia a la insulina, síndrome metabólico, dislipidemias de diferentes orígenes, aterosclerosis y enfermedades relacionadas, obesidad, alta presión sanguínea, fallo cardíaco crónico, edema e hiperuricemia.
11. Utilización de la forma cristalina, según las reivindicaciones 1, 2, 4 ó 5, para la preparación de una composición farmacéutica para el tratamiento de diabetes, particularmente diabetes mellitus tipo 1 y 2 y/o complicaciones diabéticas.
12. Utilización de la forma cristalina, según las reivindicaciones 1, 2, 4 ó 5, para la preparación de una composición farmacéutica para inhibir el cotransportador SGLT2 de glucosa dependiente de sodio.
13. Utilización de la forma cristalina, según las reivindicaciones 1, 2, 4 ó 5, para la preparación de una composición farmacéutica para la prevención de la degeneración de células beta pancreáticas y/o para la mejora y/o restablecimiento de la funcionalidad de células beta pancreáticas.
14. Utilización de la forma cristalina, según las reivindicaciones 1, 2, 4 ó 5, para la preparación de una composición farmacéutica para la prevención o tratamiento de sobrepeso, obesidad, obesidad visceral y/o obesidad abdominal.
15. Método para la fabricación de la forma cristalina I, según la reivindicación 1 ó 2, cuyo método comprende las siguientes etapas:
(a) disolver el compuesto 1-cloro-4-(ß-D-glucopiranos-1-il)-2-[4-((R)-tetrahidrofurano-3-iloxi)-bencil]-benceno en un disolvente o mezcla de disolventes para formar una solución saturada o casi saturada con la condición de que dicho compuesto y/o dicho disolvente o mezcla de disolventes contiene una cantidad de H2O que es, como mínimo, la cantidad requerida para formar un monohidrato de 1-cloro-4-(ß-D-glucopiranos-1-il)-2-[4-((R)-tetrahidrofurano-3-iloxi)-bencil]-benceno;
(b) almacenar la solución para precipitar la forma cristalina I, según la reivindicación 1 ó 2, de dicha solución y conseguir, por lo tanto, una suspensión;
(c) aislar el precipitado de la suspensión; y
(d) secar el precipitado hasta que sea eliminado cualquier exceso de dicho disolvente o mezcla de disolventes.
16. Método para la fabricación de la forma cristalina II, según la reivindicación 4 ó 5, cuyo método comprende la siguiente etapa:
(a) secar la forma cristalina I, según la reivindicación 1 ó 2, a una temperatura comprendida en un rango entre 80°C o superior y menor que el punto de fusión más bajo de dichas formas cristalinas I y II o a una temperatura más baja a presión reducida.
Patentes similares o relacionadas:
Compuestos utilizados como inhibidores de la quinasa reordenada durante la transfección (RET), del 1 de Julio de 2020, de GlaxoSmithKline Intellectual Property Development Limited: Un compuesto de acuerdo con la Fórmula (I), o una sal farmacéuticamente aceptable del mismo: **(Ver fórmula)** en donde: X es N o CR5; Y es un enlace; […]
Antagonistas del cisteinil leucotrieno, del 25 de Marzo de 2020, de Sun Pharma Advanced Research Company Ltd: Un compuesto de la fórmula (Ia), o la sal farmacéuticamente aceptable de este, **(Ver fórmula)** en donde, R1 y R2 se seleccionan de hidrógeno y halógeno; […]
Derivados de pirimidina inhibidores del VIH, del 25 de Marzo de 2020, de JANSSEN PHARMACEUTICA NV: Un compuesto de fórmula **(Ver fórmula)** un N-óxido, una sal por adición farmacéuticamente aceptable, una amina cuaternaria y una forma estereoquímicamente […]
Compuesto intermedio de moduladores de transportadores de casete de unión a ATP, del 18 de Marzo de 2020, de VERTEX PHARMACEUTICALS INCORPORATED: Un compuesto de la fórmula: **(Ver fórmula)** ácido 1-(2,2-difluoro-benzo[1,3]dioxol-5-il)-ciclopropanocarboxílico o una sal farmacéuticamente aceptable del […]
Derivados de naftofurano para uso como agentes antineoplásicos, del 18 de Marzo de 2020, de KYOTO PHARMACEUTICAL INDUSTRIES, LTD.: Un compuesto representado por la fórmula (IA): **(Ver fórmula)** en donde R1 en el número de n son cada uno en forma independiente […]
Agentes antivirales y usos de estos, del 5 de Febrero de 2020, de Griffith University: Un compuesto de formula (I), o una sal farmaceuticamente aceptable de este: **(Ver fórmula)** en donde, R1 se selecciona del grupo […]
Pirrolidinonas como herbicidas, del 5 de Febrero de 2020, de FMC CORPORATION: Compuesto seleccionado de la Fórmula 1, N-óxidos y sales del mismo: **(Ver fórmula)** donde Q1 es un sistema de anillos de naftalenilo o anillo de fenilo, estando […]
Sulfonilureas y compuestos relacionados y uso de los mismos, del 15 de Enero de 2020, de THE UNIVERSITY OF QUEENSLAND: Un compuesto de fórmula (II), o una sal o solvato farmacéuticamente aceptable del mismo: **(Ver fórmula)** donde A, B, D y E se seleccionan independientemente de C, […]