PROCEDIMIENTO PARA EL TRATAMIENTO DE ENFERMEDADES OFTALMOLOGICAS.
Uso de una cápsula en la fabricación de un dispositivo médico para administrar una molécula biológicamente activa en el ojo,
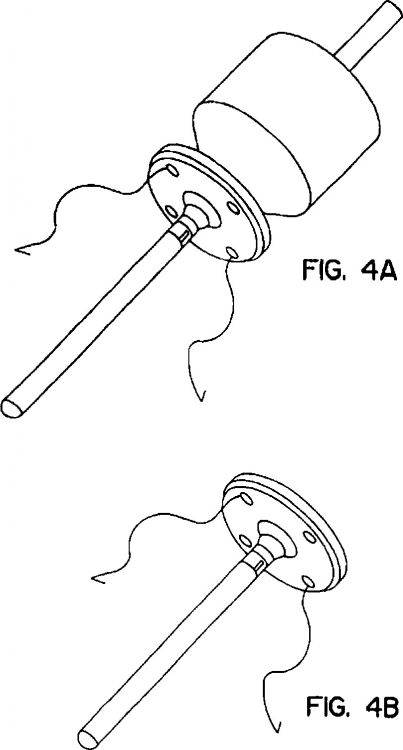
en el que la cápsula está adaptada para ser implantada intraocularmente, y en el que la cápsula comprende un núcleo que contiene una fuente celular de moléculas biológicamente activas y una camisa biocompatible que lo rodea, permitiendo la camisa la difusión de las moléculas biológicamente activas al interior del ojo, y una atadura adaptada para asegurar la cápsula en su lugar en el interior del ojo, atadura que tiene una forma similar a un ojete de tal manera que se puede usar la sutura para asegurar la atadura a la esclerótica u otra estructura ocular adecuada, o atadura que comprende un disco de sutura, de tal manera que la dosificación de las moléculas biológicamente activas está entre 50 pg y 500 ng por ojo por paciente por día
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E05010733.
Solicitante: NEUROTECH S.A.
Nacionalidad solicitante: Francia.
Dirección: CHNO DES QUINZE-VINGTS RESIDENCE SAINT LOUIS 28, RUE DE CHARENTON,75571 PARIS CEDEX 12.
Fecha de Publicación: .
Fecha Solicitud PCT: 24 de Marzo de 1997.
Fecha Concesión Europea: 3 de Marzo de 2010.
Clasificación Internacional de Patentes:
- A61F9/00B2
- A61K9/00M16B
Clasificación PCT:
- A61F9/00 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61F FILTROS IMPLANTABLES EN LOS VASOS SANGUINEOS; PROTESIS; DISPOSITIVOS QUE MANTIENEN LA LUZ O QUE EVITAN EL COLAPSO DE ESTRUCTURAS TUBULARES, p. ej. STENTS; DISPOSITIVOS DE ORTOPEDIA, CURA O PARA LA CONTRACEPCION; FOMENTACION; TRATAMIENTO O PROTECCION DE OJOS Y OIDOS; VENDAJES, APOSITOS O COMPRESAS ABSORBENTES; BOTIQUINES DE PRIMEROS AUXILIOS (prótesis dentales A61C). › Métodos o dispositivos para el tratamiento de los ojos; Dispositivos para colocar las lentes de contacto; Dispositivos para corregir el estrabismo; Aparatos para guiar a los ciegos; Dispositivos protectores de los ojos que se llevan sobre el cuerpo o en la mano (gorras con medios para la protección de los ojos A42B 1/0181; viseras para cascos A42B 3/22; baños para los ojos A61H 35/02; gafas de sol o de protección con las mismas características que las gafas normales G02C).
- A61K9/00 A61 […] › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › Preparaciones medicinales caracterizadas por un aspecto particular.
Clasificación antigua:
- A61F9/00 A61F […] › Métodos o dispositivos para el tratamiento de los ojos; Dispositivos para colocar las lentes de contacto; Dispositivos para corregir el estrabismo; Aparatos para guiar a los ciegos; Dispositivos protectores de los ojos que se llevan sobre el cuerpo o en la mano (gorras con medios para la protección de los ojos A42B 1/0181; viseras para cascos A42B 3/22; baños para los ojos A61H 35/02; gafas de sol o de protección con las mismas características que las gafas normales G02C).
- A61K9/00 A61K […] › Preparaciones medicinales caracterizadas por un aspecto particular.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Finlandia.
Fragmento de la descripción:
Procedimiento para el tratamiento de enfermedades oftalmológicas.
Campo técnico de la invención
Esta invención se refiere a dispositivos y procedimientos para el tratamiento de enfermedades y trastornos oftálmicos que usan células encapsuladas para la administración intraocular y periocular de moléculas biológicamente activas.
Antecedentes de la invención
Existen numerosos trastornos que amenazan la visión del ojo para los cuales no existen actualmente buenas terapias. Un problema principal en el tratamiento de dichas enfermedades es la incapacidad de administrar agentes terapéuticos en el interior del ojo y mantenerlos allí a concentraciones terapéuticamente eficaces.
La ingestión oral de un fármaco o la inyección de un fármaco en un lugar diferente al del ojo puede proporcionar un fármaco sistémicamente. Sin embargo, dicha administración sistémica no proporciona niveles eficaces del fármaco específicamente en el ojo. En muchos trastornos oftálmicos que implican la retina, el tracto posterior, y el nervio óptico, no se pueden alcanzar o mantener niveles adecuados del fármaco mediante las rutas de administración oral o parenteral. Además, puede ser necesaria la administración repetida del fármaco para alcanzar estas concentraciones. Sin embargo, esto puede producir toxicidad sistémica indeseada. Por ejemplo, el interferón alfa administrado subcutánea o intramuscularmente en adultos puede dar como resultado complicaciones tales como síntomas de tipo gripe con fatiga, anorexia, náuseas, trombocitopenia con vómitos, y leucopenia.
Se han tratado también las dolencias oftálmicas usando fármacos aplicados directamente al ojo en forma tanto líquida como de pomada. Esta ruta de administración sin embargo sólo es eficaz en el tratamiento de problemas que implican la zona superficial del ojo y las enfermedades que afectan la córnea y el segmento anterior del ojo. La administración tópica de fármacos es ineficaz en conseguir concentraciones adecuadas de fármaco en el segmento de la esclerótica, humor vítreo, o posterior del ojo. Además, las gotas tópicas en el ojo pueden drenar desde el ojo a través del conducto nasolacrimal y al interior de la circulación sistémica, diluyendo además la medicación y arriesgando efectos secundarios sistémicos no deseados. Además, el fármaco se administra indiscriminadamente a todos los compartimentos de tejido del ojo, incluyendo aquellos que no necesitan la medicación y pueden de hecho sufrir efectos secundarios no deseados debido al fármaco.
La administración de fármacos en forma de gotas tópicas en el ojo es también de poca utilidad cuando el fármaco es una proteína o péptido que carece de la capacidad de cruzar la córnea y estar disponible en el humor vítreo, retina, u otras estructuras subretinales tales como el epitelio pigmentario de la retina ("EPR") o la vasculatura coroidal. Además, muchas proteínas o péptidos son muy inestables y por tanto no se formulan fácilmente para la administración tópica.
Se ha intentado también la administración directa de fármacos al interior del ojo mediante inserción tópica. Sin embargo, este procedimiento no es deseable. Las inserciones tópicas requieren la autoadministración del paciente y por tanto una formación acerca de la inserción y la retirada. Esto demanda un cierto grado de destreza manual, que puede ser problemático en pacientes geriátricos. Estos dispositivos son propensos a la pérdida inadvertida debido a la relajación del párpado. Además, estos dispositivos proporcionan el fármaco únicamente a la córnea y a la cámara anterior, y no proporcionan ninguna ventaja farmacológica sobre las gotas oculares.
Otra inserción extraocular es un sistema de lente de contacto que libera la medicación durante un periodo prolongado. Véase, por ejemplo, JAMA. 260:24, p. 3556 (1988). Esta lente generalmente dura únicamente unas cuantas horas o días antes de disolverse o liberar todo el compuesto terapéutico. La liberación continua de medicación no es conveniente, requiriendo una frecuente reaplicación. De nuevo, estas lentes de contacto proporcionan el fármaco únicamente a la córnea y a la cámara anterior.
En casos raros, también se ha llevado a cabo la administración directa de los fármacos usando tubos externalizados. Esto requiere la inserción de un extremo de un tubo en la esquina del ojo del paciente. El otro extremo del tubo se sujeta con cinta a la frente del paciente y termina en un septo, a través del cual se administra la medicación. Este procedimiento no es deseable, siendo a la vez no confortable e inconveniente. Debido a que la medicación debe inyectarse a través del septo, el dispositivo es incapaz de la administración continua de la medicación. Además, dichos tubos, pueden llegar a infectarse en algunos casos amenazando de manera definitiva la visión del paciente.
Se puede llevar a cabo también la administración directa de fármacos mediante la inyección intraocular del fármaco, o de microesferas que contengan el fármaco. Sin embargo, las microesferas tienden a migrar en el interior del ojo, tanto en los lugares del interior del eje visual como en el interior del tejido adyacente.
Las inserciones intraoculares adicionales anteriores para la administración directa de fármacos en el ojo han sido insatisfactorias debido tanto a que no son adecuadas para el uso a largo plazo como a que son no confortables para el uso. Por ejemplo, el dispositivo ocular que se da a conocer en la Patente U.S. No. 3.828.777, no queda anclado en su posición, produciendo de esta manera dolor, irritación, sensación de cuerpo extraño, desprendimientos de la retina, e irrigación cuando el dispositivo se mueve. Otras inserciones oculares dadas a conocer en patentes no desvelan los tamaños o formas que permitirían la retención a largo plazo de la inserción. Véanse, por ejemplo, la Patente U.S. No. 4.343.787; Patente U.S. No. 4.730.013; Patente U.S. No. 4.164.559. Incluso en pacientes que afirman una mejora en la retención y un periodo prolongado de uso, el periodo contemplado se mide en días, tales como 7 a 14 días. Véase, por ejemplo, la Patente U.S. No. 5.395.618.
Está disponible actualmente una inserción intraocular para la administración de ganciclovir en el ojo. Conocido como Vitrasert, el dispositivo está constituido por un paquete de administración mantenida, basado en polímero, no erosionable, que contiene ganciclovir, un análogo de nucleósido no proteínico. Este dispositivo se implanta quirúrgicamente en el humor vítreo del ojo para tratar la retinitis por citomegalovirus. Véase, por ejemplo, Anand, R., y col., Arch. Ophthalmol, 111, pp. 223-227 (1993).
Se da a conocer otra inserción intraocular en la Patente U.S. No. 5.466.233. Este dispositivo con forma de chincheta se implanta quirúrgicamente de tal manera que la cabeza de la chincheta es externa al ojo, contigua a la superficie de la esclerótica. La parte de atrás de la chincheta cruza la esclerótica y se extiende en el humor vítreo, en el que proporciona la administración vítrea del fármaco.
Sin embargo, la administración de proteínas desde dichos dispositivos (u otros polímeros erosionables o no erosionables) puede ser mantenida únicamente durante cortos periodos de tiempo debido a la inestabilidad de la proteína. Dichos dispositivos no son adecuados para la administración a largo plazo de la mayor parte, sino todas, las moléculas de proteína.
El tratamiento clínico de la neovascularización retinal y coroidal incluye la destrucción de nuevos vasos usando la electrocoagulación o la crioterapia. Sin embargo, los efectos secundarios son numerosos e incluyen la insuficiencia para controlar la neovascularización, la destrucción de la mácula y la visión central, y la disminución de la visión periférica. Véase, por ejemplo, Aiello, L.P., y col., PNAS. 92, pp. 10457-10461 (1995).
Numerosos factores de crecimiento muestran resultados prometedores en el tratamiento de enfermedades oculares. Por ejemplo, BDNF y CNTF han demostrado retrasar la degeneración de las células y fotorreceptores ganglionales retinales en diversos modelos animales. Véase, por ejemplo, Genetic Technology News, vol. 13, no. 1 (Ene. 1993). El factor de crecimiento nervioso ha mostrado potenciar la supervivencia de las células ganglionares retinales tras la sección del nervio óptico y ha demostrado también estimular la recuperación de las neuronas retinales tras la isquemia. Véase, por ejemplo, Siliprandi, y col., Invest, Ophthalmol. & Vis. Sci., 34, pp. 3232-3245 (1993).
La...
Reivindicaciones:
1. Uso de una cápsula en la fabricación de un dispositivo médico para administrar una molécula biológicamente activa en el ojo, en el que la cápsula está adaptada para ser implantada intraocularmente, y en el que la cápsula comprende un núcleo que contiene una fuente celular de moléculas biológicamente activas y una camisa biocompatible que lo rodea, permitiendo la camisa la difusión de las moléculas biológicamente activas al interior del ojo, y una atadura adaptada para asegurar la cápsula en su lugar en el interior del ojo, atadura que tiene una forma similar a un ojete de tal manera que se puede usar la sutura para asegurar la atadura a la esclerótica u otra estructura ocular adecuada, o atadura que comprende un disco de sutura, de tal manera que la dosificación de las moléculas biológicamente activas está entre 50 pg y 500 ng por ojo por paciente por día.
2. Uso según la reivindicación 1 en el que la camisa comprende una membrana inmunoaislante permeoselectiva o una membrana microporosa.
3. Uso según la reivindicación 1 o la reivindicación 2 en el que la cápsula se configura como una fibra hueca o una lámina plana.
4. Uso según cualquiera de las reivindicaciones 1-3 en el que la molécula biológicamente activa se selecciona entre el grupo constituido por factores antiangiogénicos; factores antiinflamatorios; factores neurotróficos; combinaciones de factores antiangiogénicos, factores antiinflamatorios y factores neurotróficos; factores de crecimiento; anticuerpos y fragmentos de anticuerpos; neurotransmisores; hormonas; enzimas; citocinas; y linfocinas.
5. Uso según cualquier reivindicación anterior en el que la molécula biológicamente activa comprende un factor antiangiogénico seleccionado entre el grupo constituido por vasculoestatina; angioestatina, endoestatina, anti-integrinas, inhibidores del factor de crecimiento endotelial vascular (inhibidores de VEGF), factor plaquetario 4, heparinasa, moléculas que se unen a bFGF, el receptor Flt de VEGF, y el receptor Flk de VEGF.
6. Uso de una cápsula biocompatible en la fabricación de un dispositivo médico para uso en el tratamiento de trastornos oftálmicos en un paciente que padece de los mismos, en el que dicha cápsula biocompatible se adapta para implantarse en un ojo del paciente, y en el que la cápsula comprende un núcleo que comprende una fuente celular de una molécula biológicamente activa, y una camisa que rodea dicho núcleo, comprendiendo la camisa un material biocompatible que permite la difusión de la molécula biológicamente activa en el ojo en una cantidad terapéuticamente eficaz, y una atadura adaptada para asegurar la cápsula en su lugar en el interior del ojo, atadura que tiene forma similar a un ojete de tal manera que se puede usar la sutura para asegurar la atadura a la esclerótica u otra estructura ocular adecuada, o atadura que comprende un disco de sutura, de tal manera que la dosificación.
7. Uso según la reivindicación 6 en el que la molécula biológicamente activa se selecciona entre el grupo constituido por factores antiangiogénicos; factores antiinflamatorios; factores neurotróficos; combinaciones de factores antiangiogénicos, factores antiinflamatorios y factores neurotróficos; factores de crecimiento; anticuerpos y fragmentos de anticuerpos; neurotransmisores; hormonas; enzimas; citocinas; y linfocinas.
8. Uso según la reivindicación 6 o la reivindicación 7 en el que el trastorno oftálmico se selecciona entre el grupo constituido por trastornos angiogénicos, trastornos inflamatorios, trastornos degenerativos, y sus combinaciones; o en el que el trastorno oftálmico se selecciona entre el grupo constituido por uveítis, retinitis pigmentaria, degeneración macular relacionada con la edad, glaucoma, y retinopatía diabética.
9. Uso según cualquiera de las reivindicaciones 6-8 en el que la molécula biológicamente activa se selecciona entre el grupo constituido por BDNF, TGFß, GDNF, NGF, CNTF, bFGF, aFGF, IL-1ß, IL-10, IFN-ß, IFN-a y los inhibidores de VEGF; o en el que la molécula biológicamente activa es un factor antiangiogénico seleccionado entre el grupo constituido por vasculoestatina; angioestatina, endoestatina, anti-integrinas, inhibidores del factor de crecimiento endotelial vascular (inhibidores de VEGF), factor plaquetario 4, heparinasa, moléculas que se unen a bFGF, el receptor Flt de VEGF, y el receptor Flk de VEGF.
10. Uso según cualquiera de las reivindicaciones 6-9 en el que la cápsula es inmunoaislante.
11. Uso según cualquiera de las reivindicaciones 6-10, en el que la cápsula se adapta para el implante en el interior de la cámara anterior, la cámara posterior, o el humor vítreo del ojo.
12. Uso según cualquiera de las reivindicaciones 6-11, en el que la fuente celular de la molécula biológicamente activa comprende células vivas.
Patentes similares o relacionadas:
DISPENSADOR DE FÁRMACO INTRAOCULAR, del 19 de Agosto de 2011, de NULENS LTD: Dispensador de fármaco intraocular para liberación controlada en el tiempo de un fármaco intraocular en un ojo que tiene una pared del ojo y una […]
 TAMAÑO DE PÍLDORA DE MEDICAMENTO CONTROLADO POR COEFICIENTE TÉRMICO PARA INYECCIÓN OFTÁLMICA, del 24 de Mayo de 2011, de ALCON RESEARCH, LTD.: Procedimiento de preparación de un dispositivo de inyección para inyectar una mezcla en un ojo, que comprende: proporcionar la mezcla en una cámara dispensadora […]
TAMAÑO DE PÍLDORA DE MEDICAMENTO CONTROLADO POR COEFICIENTE TÉRMICO PARA INYECCIÓN OFTÁLMICA, del 24 de Mayo de 2011, de ALCON RESEARCH, LTD.: Procedimiento de preparación de un dispositivo de inyección para inyectar una mezcla en un ojo, que comprende: proporcionar la mezcla en una cámara dispensadora […]
 PROCEDIMIENTO DE PREPARACIÓN DE UN DISPOSITIVO DE INYECCIÓN PARA ADMINISTRAR EN EL OJO UNA SUSTANCIA DEPENDIENDO DE LA VELOCIDAD Y DE LA TEMPERATURA, del 18 de Mayo de 2011, de ALCON RESEARCH, LTD.: Procedimiento de preparación de un dispositivo de inyección para inyectar una mezcla en un ojo, que comprende: proporcionar la mezcla en […]
PROCEDIMIENTO DE PREPARACIÓN DE UN DISPOSITIVO DE INYECCIÓN PARA ADMINISTRAR EN EL OJO UNA SUSTANCIA DEPENDIENDO DE LA VELOCIDAD Y DE LA TEMPERATURA, del 18 de Mayo de 2011, de ALCON RESEARCH, LTD.: Procedimiento de preparación de un dispositivo de inyección para inyectar una mezcla en un ojo, que comprende: proporcionar la mezcla en […]
 CONJUNTO DE REUTILIZACIÓN LIMITADA RECARGABLE UNIVAERSAL PARA PIEZA DE MANO OFTÁLMICA, del 1 de Abril de 2011, de ALCON RESEARCH, LTD.: Conjunto de reutilización limitada universal para una pieza de mano oftálmica, que comprende: una fuente de potencia para proporcionar potencia a un segmento […]
CONJUNTO DE REUTILIZACIÓN LIMITADA RECARGABLE UNIVAERSAL PARA PIEZA DE MANO OFTÁLMICA, del 1 de Abril de 2011, de ALCON RESEARCH, LTD.: Conjunto de reutilización limitada universal para una pieza de mano oftálmica, que comprende: una fuente de potencia para proporcionar potencia a un segmento […]
 IMPLANTE OFTALMOLOGICO Y METODO PARA LA LIBERACION SOSTENIDA DE MEDICION AL OJO, del 7 de Junio de 2010, de EYELAB GROUP, LLC: Implante oftalmológico para la liberación sostenida de medicación a un ojo, teniendo el implante una parte de cuerpo dimensionada para pasar a través de un punto […]
IMPLANTE OFTALMOLOGICO Y METODO PARA LA LIBERACION SOSTENIDA DE MEDICION AL OJO, del 7 de Junio de 2010, de EYELAB GROUP, LLC: Implante oftalmológico para la liberación sostenida de medicación a un ojo, teniendo el implante una parte de cuerpo dimensionada para pasar a través de un punto […]
 DISPOSITIVO DE IONTOFORESIS OCULAR PARA LA TRANSFERENCIA DE VARIOS PRODUCTOS ACTIVOS, del 2 de Noviembre de 2009, de OPTIS FRANCE: Dispositivo de transferencia de por lo menos un producto activo en el globo ocular por iontoforesis, que comprende un depósito anular de producto […]
DISPOSITIVO DE IONTOFORESIS OCULAR PARA LA TRANSFERENCIA DE VARIOS PRODUCTOS ACTIVOS, del 2 de Noviembre de 2009, de OPTIS FRANCE: Dispositivo de transferencia de por lo menos un producto activo en el globo ocular por iontoforesis, que comprende un depósito anular de producto […]
FORMULACIÓN PARA LA LIBERACIÓN CONTROLADA DE FÁRMACOS MEDIANTE LA COMBINACIÓN DE AGENTES HIDRÓFILOS E HIDRÓFOBOS, del 23 de Noviembre de 2011, de ALLERGAN, INC.: Un implante para su uso en un método de tratamiento de afecciones oculares por inserción de dicho implante en la cámara posterior del ojo, siendo dicho implante […]
MIMÉTICOS DE LA SUPERÓXIDO DISMUTASA PARA EL TRATAMIENTO DE TRASTORNOS Y ENFERMEDADES OCULARES, del 1 de Marzo de 2011, de ALCON, INC: Utilización de una cantidad farmacéuticamente eficaz de un compuesto de fórmula I: **(Ver fórmula)**en la que: A es un anión farmacéuticamente aceptable; X1-4 se seleccionan […]