COMPOSICION DE VACUNA QUE CONTIENE EL FACTOR DE CRECIMIENTO TRANSFORMANTE ALFA.
La presente invención está relacionada con el campo de la inmunología y la medicina humana,
en particular con la inmunoterapia activa específica de tumores malignos dependientes del TGFa para su crecimiento, así como para el tratamiento de otras enfermedades que dependan del TGFa, mediante un preparado vacunal capaz de provocar una reacción de inmunocastración del TGFa autólogo.Otro objeto importante de esta invención es la obtención de un preparado vacunal que incluya una combinación del TGFa con otros ligandos del EGF-R, tales como el factor de crecimiento epidérmico (EGF), capaz de inhibir la proliferación de tumores cuya progresión dependen de estos factores de crecimiento. De esta manera se evita la resistencia que puede generar el tumor a vacunas que contenga cada uno de estas moléculas por separado
Tipo: Resumen de patente/invención. Número de Solicitud: W0100011CU.
Solicitante: CENTRO DE INMUNOLOGIA MOLECULAR.
Nacionalidad solicitante: Cuba.
Dirección: CALLE 216 ESQ. 15, ATABEY, PLAYA, PROVINCIA CIUDAD HABANA 16040, CUB,16040 PROVINCIA CIUDAD HABANA.
Inventor/es: PEREZ RODRIGUEZ, ROLANDO, GUILLEN NIETO, GERARDO, ENRIQUE, SANCHEZ RAMIREZ, BELINDA, ALVAREZ ACOSTA, ANABEL, GONZALEZ MARINELLO,GISELA,MARIA, MULET SIERRA,AILLETTE, MENENDEZ MEDINA,TAMARA.
Fecha de Publicación: .
Fecha Concesión Europea: 19 de Agosto de 2009.
Clasificación Internacional de Patentes:
- A61K39/00D
Clasificación PCT:
- A61K38/18 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › Factores de crecimiento; Reguladores de crecimiento.
- A61K39/00 A61K […] › Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53).
- A61K39/385 A61K […] › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Haptenos o antígenos, unidos a soportes.
- A61K47/48
- C07K14/495 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › Factor de crecimiento transformante (TGF).
Clasificación antigua:
- A61K39/00 A61K […] › Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53).
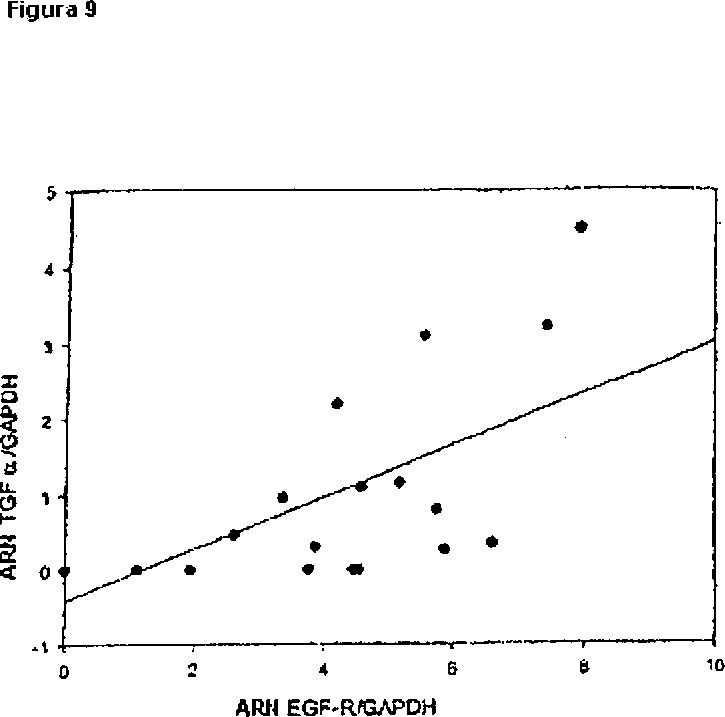
Fragmento de la descripción:
Composición de vacuna que contiene el factor de crecimiento transformante a.
Sector técnico
La presente invención se refiere al campo de la inmunología y la medicina humana, en particular a una preparación de vacuna capaz de provocar una reacción de supresión inmune frente a TGFa autólogo. Esta vacuna puede usarse para el tratamiento de determinados cánceres y otras enfermedades relacionadas con TGFa.
Técnica anterior
El Factor de Crecimiento transformante (TGFa) es un polipéptido de 50 aminoácidos aislado originalmente del medio condicionado de células transformadas con retrovirus. Al principio, se definió como una molécula capaz de competir con el Factor de Crecimiento Epidérmico (EGF) para la unión a EGF-R. Sin embargo, los anticuerpos anti-EGF no fueron capaces de reconocer TGFa (Todaro et al. (1976), Nature 264, 26-31). Por lo tanto, los dos factores de crecimiento son entidades inmunológicamente diferentes.
TGFa pertenece a la familia de EGF. Está familia está constituida por proteínas relacionadas estructural y funcionalmente. Los demás miembros de esta familia son EGF, anfirregulina (AR), criptol (CR1), EGF que se une a heparina, betacelulina, epirregulina. Por otra parte, la familia de poxvirus incluye proteínas relacionadas con EGF. De ellas, la mejor caracterizada es el factor de crecimiento del virus vaccinia (VGF).
Todas estas moléculas se unen a y activan EGF-R, por esta razón se conocen como ligandos de este receptor. Este sistema juega un papel en el crecimiento de las células normales y neoplásicas.
EGF-R es una glicoproteína de 170 kD cuyo gen ha sido clonado y secuenciado. El dominio intracelular de este receptor está asociado con la actividad de proteínas tirosina quinasa. Estas proteínas muestran una homología estructural con el producto del oncogén v-erb-B, lo que es una evidencia de una relación con el proceso de transformación neoplásica (Heldin C.H. (1984), Cell 37, 9-20).
TGFa se sintetiza como una forma precursora transmembrana (pro-TGFa) de 160 aminoácidos. El TGFa maduro, una forma soluble de 50 aminoácidos, se libera por escisión proteolítica. El TGFa humano (hTGFa) muestra una identidad de secuencia de aminoácidos del 43% con el EGF humano (hEGF) y del 93% con el TGFa de ratón o de rata. Además, sus efectos biológicos no son específicos de especie.
El trabajo de muchos laboratorios ha documentado la capacidad de TGFa para regular la proliferación, migración y diferenciación de células en cultivo (Carpenter y Wahl. (1990), Springer-Verlag, Berlín, p. 69-171).
TGFa es el ligando más extendido de EGF-R. Se expresa en los tejidos normales durante la embriogénesis y en los tejidos normales y tumorales en los adultos. Sin embargo, no se observan defectos patológicos importantes en ratones que carecen del gen de TGFa y estos ratones son viables y fértiles (Bruce Mann et al. (1993), Cell, 73, 249-261).
En el proceso de tumorigénesis, la desregulación de los procesos paracrinos y autocrinos de la activación de EGF-R se debe a la regulación al alza de la expresión del factor de crecimiento o a la síntesis elevada o mutación de su receptor.
En los tumores epiteliales, se han detectado altos niveles de EGF-R. En muchos casos, la sobreexpresión de este receptor constituye un indicador de un mal pronóstico.
La inducción de TGFa es un evento frecuente en la transformación neoplásica. De hecho, existen numerosos estudios que muestran la sobreexpresión de esta molécula en tumores epiteliales de diferentes localizaciones que incluyen, mama, pulmón, cerebro, hígado, próstata, vejiga, tracto gastrointestinal, colon, tejidos reproductores (ovario) y endocrinos, entre otros.
Aunque el mecanismo por el que TGFa induce tumorigenicidad sigue sin conocerse, existen algunas publicaciones que correlacionan la sobreexpresión de este factor de crecimiento con el grado tumoral, supervivencia del paciente y otros marcadores tumorales. Además, algunos investigadores han demostrado su relación con otros oncogenes como c-myc en hepatocarcinomas. TGFa también constituye una diana del gen supresor tumoral de von Hippel-Lindau (VHL) (resumido en Lee et al. (1996), Growth Factors and Cytokines in Health and Disease, Volumen 1B, 277-318).
Aunque TGFa y EGF se unen al mismo receptor con afinidades comparables, TGFa es generalmente más potente que EGF y, en algunos contextos, se ha descrito que sus efectos son más potentes y/o más prolongados (Barandon y Green (1987), Cell 50, 1131-1137). Se ha publicado que en el caso de un complejo TGFa/EGF-R internalizado, TGFa y EGF-R se reciclaron preferentemente de nuevo a la superficie celular mientras que cuando se internalizó un complejo EGF/EGF-R en el mismo tipo de célula, ambos componentes se degradaron eficazmente (Ebner y Derynck (1991), Cell Regul. 2, 599-612). Estos resultados sugieren que las diferencias en la actividad biológica de cada factor de crecimiento puede deberse a diferencias en los mecanismos de tráfico intracelular.
Por otra parte, TGFa es un factor angiogénico más potente que EGF (Schreiber et al. (1986), Science 232, 1250-1253).
Respecto a la expresión en tumores, existen evidencias de la presencia del precursor de EGF en las membranas de algunos tumores epiteliales pero TGFa se expresa mayoritariamente en los tumores epiteliales y su acción, al contrario que EGF, es por un bucle autocrino con el EGF-R. Por otra parte, los resultados de nuestro centro indican que en algunas biopsias de tumores epiteliales existe una expresión de TGFa y no de EGF (carcinoma ductal de mama, carcinoma de laringe), mientras que otros tumores presentan más EGF que TGFa (cáncer de pulmón de células no pequeñas (NSCLC)). Estos resultados sugieren que los factores de crecimiento pueden tener diferentes impactos en la biología del tumor de diferentes células neoplásicas.
Todas las evidencias acumuladas en estos años acerca de la relación entre el sistema EGF-R/ligandos de EGF-R y cáncer, hacen de este sistema una diana muy atractiva para la inmunoterapia del cáncer.
Los resultados previos de nuestro grupo han demostrado la posibilidad de desarrollar una inmunoterapia activa del cáncer con una vacuna basada en EGF. De hecho, se han obtenido evidencias preclínicas y clínicas acerca de la inmunogenicidad y baja toxicidad causadas por la vacunación con hEGF acoplado a una proteína vehicular (González et al. (1996), Vaccine Research 5(4), 233-243).
Los estudios preclínicos han mostrado que la inmunización de ratones con hEGF en adyuvante incrementa la supervivencia de los ratones transplantados con tumor ascítico de Ehrlich (EAT) (González et al. (1996), Vaccine Research 5(4), 233-243).
Se produjo una proteína de fusión entre hEGF y P64k. Esta proteína contiene la secuencia de hEGF insertada entre los aminoácidos 45/46 de P64k. Esta proteína de fusión se usó para inmunizar ratones, causando una respuesta inmune humoral específica frente a hEGF. La respuesta inmune generada provocó un incremento de la vida de los ratones que presentaban EAT (González et al. (1997), Vaccine Research 6(2), 91-100).
En dos ensayos clínicos piloto con pacientes con NSCLC, se observó una tendencia de incremento de la supervivencia en pacientes vacunados comparada con un control histórico. En pacientes con una alta respuesta de anticuerpos frente a hEGF se observó un marcado incremento de la supervivencia (González et al. (1998), Annals of oncology, 9, 1-5).
En general, la vacunación con EGF no genera una respuesta de anticuerpos específica frente a TGFa. Sin embargo, se han obtenido evidencias de que la vacunación con una preparación inmunogénica que contiene TGFa en un modelo murino genera bajos niveles de anticuerpos anti-EGF sólo en algunos ratones. Esta respuesta de anticuerpos es capaz de bloquear en algunos casos la unión de EGF a su receptor in vitro. Sin embargo, los niveles de anticuerpos anti-EGF obtenidos no son suficientes para generar una respuesta de supresión de EGF inmune eficaz con impacto en la acción anti-tumoral.
Debido a que la acción de cada uno de estos factores de crecimiento es diferente en cada tumor y/o entre el tumor primario y sus metástasis, una vacuna que combina los dos ligandos principales de EGF-R, TGFa y EGF, tiene un efecto anti-tumoral mejor en los tumores epiteliales, en un sentido general.
Hasta el momento de la presente invención, no se ha desarrollado ninguna terapia que proponga...
Reivindicaciones:
1. Una composición de vacuna para incitar una respuesta inmune frente a TGFa autólogo, que comprende como principio activo una proteína de fusión entre una proteína vehicular y TGFa humano o cualquier derivado peptídico del mismo y que comprende adicionalmente un adyuvante, en la que dicha proteína de fusión es capaz de incitar dicha respuesta inmune frente a TGFa.
2. La composición de vacuna según la reivindicación 1 en la que la proteína vehicular es la proteína P64K del complejo proteico de la membrana exterior de Neisseria meningitidis.
3. La composición de vacuna según la reivindicación 2 en la que la proteína vehicular comprende una cola de seis histidinas en el extremo N-terminal.
4. La composición de vacuna según la reivindicación 2 en la que la composición de vacuna comprende además EGF.
5. La composición de vacuna según una cualquiera de las reivindicaciones 1 a 4, en la que el adyuvante es Adyuvante Incompleto de Freund.
6. La composición de vacuna según una cualquiera de las reivindicaciones 1 a 4, en la que el adyuvante es Al(OH)3.
7. Uso de una composición de vacuna según una cualquiera de las reivindicaciones 1 a 6 en la preparación de un agente para el tratamiento de enfermedad maligna en tumores de origen epitelial que expresan TGFa o EGF.
8. El uso de la reivindicación 7 en el que el tumor es un carcinoma epidermoide de pulmón, mama, próstata, gástrico o de ovario.
Patentes similares o relacionadas:
VACUNA DE ADN CONTRA LAS CÉLULAS ENDOTELIALES PROLIFERATIVAS Y MÉTODOS DE UTILIZACIÓN DE LA MISMA, del 10 de Enero de 2012, de THE SCRIPPS RESEARCH INSTITUTE: Vacuna de ADN eficaz para provocar una respuesta inmunitaria contra las células endoteliales proliferativas, que comprende un constructo de ADN que codifica de manera […]
USO DE VEGF MUTADO PARA LA TERAPIA ANTIANGIOGENICA, del 29 de Septiembre de 2011, de CENTRO DE INGENIERIA GENETICA Y BIOTECNOLOGIA (CIGB): Aplicacion de secuencias oligonucleotídicas y polipeptídicas de moléculas pertenecientes a la familia del factor de permeabilidad vascular (VPF), sus receptores […]
PEPTIDOS Y ANTICUERPOS UTILES PARA LA ELABORACION DE MEDICAMENTOS PARA EL TRATAMIENTO O PREVENCION DE ENFERMEDADES HUMANAS NEURODEGENERATIVAS. MEDICAMENTOS ASI OBTENIDOS Y SUS APLICACIONES, del 18 de Julio de 2011, de CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS (CSIC): Péptidos y anticuerpos útiles para la elaboración de medicamentos para el tratamiento o prevención de enfermedades humanas neurodegenerativas, medicamentos así obtenidos […]
Neuregulina para tratar la insuficiencia cardíaca, del 29 de Julio de 2020, de Zensun (Shanghai) Science & Technology, Co., Ltd: Neuregulina para usar en un método para tratar la insuficiencia cardíaca crónica en un paciente, donde el paciente tiene un nivel plasmático de NT-proBNP […]
Dispositivo médico que tiene un revestimiento que comprende ACCS, del 15 de Julio de 2020, de Noveome Biotherapeutics, Inc: Un dispositivo médico implantable que tiene un revestimiento en su superficie, útil para la implantación quirúrgica en el cuerpo de un sujeto, […]
Composiciones que comprenden cócteles de fagos antibacterianos y usos de las mismas para el tratamiento de infecciones bacterianas, del 24 de Junio de 2020, de Tecnifar-Indústria Técnica Farmacêutica, S.A: Una composicion que comprende: una primera y una segunda cepa purificada de bacteriofago, cada una de dichas cepas que tiene un genoma que comprende […]
Combinacion de peptidos tolerogenos con TFG-â para inducir y mantener la tolerancia oral en mamiferos jovenes, del 3 de Junio de 2020, de SOCIETE DES PRODUITS NESTLE S.A.: Una composición nutricional - que contiene al menos un péptido de cinco hasta doce aminoácidos de longitud e incluye una secuencia elegida entre […]
Formulaciones con oxidación reducida, del 3 de Junio de 2020, de F. HOFFMANN-LA ROCHE AG: Una formulación líquida que comprende un anticuerpo y un compuesto que previene la oxidación del anticuerpo en la formulación líquida, en la que el compuesto es […]