Reactivos de marcado que llevan funciones diazo y nitro, procedimientos de síntesis de tales reactivos y procedimientos de detección de moléculas biológicas.
Reactivo de marcado de fórmula (A):**Förmula**
en la cual:
- R1 representa un marcador detectable o al menos dos marcadores detectables unidos entre sí mediante al menos una estructura multimérica;
- R2 y R3 representan, de manera independiente uno del otro: H, NO2, Cl, Br, F, I, R4-(L)n-Y-X, OR, SR, NR2, R, NHCOR, CONHR o COOR, con R ≥ grupo alquilo o arilo y R4 representa un marcador detectable o al menos dos marcadores detectables unidos entre sí mediante al menos una estructura multimérica;
- L es un brazo de enlace que tiene un encadenamiento lineal de al menos dos enlaces covalentes y - n es un número entero igual a 1;
- A es un brazo de enlace que tiene al menos un doble enlace covalente que permite la conjugación de la función diazo con el ciclo aromático;
- u es un número entero comprendido entre 0 y 2 y
- -Y-X- representa -CONH-, -NHCO-, CH2O-, -CH2S-.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/FR2008/051026.
Solicitante: BIOMERIEUX.
Nacionalidad solicitante: Francia.
Dirección: CHEMIN DE L'ORME 69280 MARCY-L'ETOILE FRANCIA.
Inventor/es: KOTERA, MITSUHARU, LAAYOUN, ALI, LAURENT, ALAIN.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07C245/14 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07C COMPUESTOS ACICLICOS O CARBOCICLICOS (compuestos macromoleculares C08; producción de compuestos orgánicos por electrolisiso electroforesis C25B 3/00, C25B 7/00). › C07C 245/00 Compuestos que contienen cadenas de al menos dos átomos de nitrógeno con al menos un enlace múltiple nitrógeno-nitrógeno (compuestos azoxi C07C 291/08). › con grupos diazo unidos a átomos de carbono acíclicos de una estructura carbonada.
- C07D233/32 C07 […] › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 233/00 Compuestos heterocíclicos que contienen ciclos de diazol-1,3 o diazol-1,3 hidrogenado, no condensados con otros ciclos. › Un átomo de oxígeno.
- C07D333/24 C07D […] › C07D 333/00 Compuestos heterocíclicos que contienen ciclos de cinco miembros que tienen un átomo de azufre como único heteroátomo del ciclo. › Radicales sustituidos por átomos de carbono que tienen tres enlaces a heteroátomos, con a lo más un enlace a halógeno, p. ej. radicales éster o nitrilo.
- C07D495/04 C07D […] › C07D 495/00 Compuestos heterocíclicos que contienen en el sistema condensado al menos un heterociclo que tiene átomos de azufre como únicos heteroátomos del ciclo. › Sistemas orto-condensados.
- C12Q1/68 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12Q PROCESOS DE MEDIDA, INVESTIGACION O ANALISIS EN LOS QUE INTERVIENEN ENZIMAS, ÁCIDOS NUCLEICOS O MICROORGANISMOS (ensayos inmunológicos G01N 33/53 ); COMPOSICIONES O PAPELES REACTIVOS PARA ESTE FIN; PROCESOS PARA PREPARAR ESTAS COMPOSICIONES; PROCESOS DE CONTROL SENSIBLES A LAS CONDICIONES DEL MEDIO EN LOS PROCESOS MICROBIOLOGICOS O ENZIMOLOGICOS. › C12Q 1/00 Procesos de medida, investigación o análisis en los que intervienen enzimas, ácidos nucleicos o microorganismos (aparatos de medida, investigación o análisis con medios de medida o detección de las condiciones del medio, p. ej. contadores de colonias, C12M 1/34 ); Composiciones para este fin; Procesos para preparar estas composiciones. › en los que intervienen ácidos nucleicos.
- G01N33/58 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › en los que intervienen sustancias marcadas (G01N 33/53 tiene prioridad).
PDF original: ES-2512615_T3.pdf




Fragmento de la descripción:
Reactivos de marcado que llevan funciones diazo y nitro, procedimientos de síntesis de tales reactivos y procedimientos de detección de moléculas biológicas
La presente invención se refiere a nuevos reactivos de marcado de moléculas biológicas, a un procedimiento de síntesis de dichos marcadores así como a aplicaciones para el marcado de moléculas biológicas, en particular en el campo del diagnóstico, utilizando el análisis de ácidos nucleicos.
El estado de la técnica muestra que existen numerosos métodos para marcar nucleótidos, oligonucleótidos o ácidos
nucleicos.
Un primer método consiste en fijar el marcador sobre la base, ya sea ésta natural o modificada. Un segundo método propone fijar el marcador sobre el azúcar, también en este caso, tanto si es natural como si es modificado. Un tercer método tiene por objeto la fijación del marcador sobre el grupo fosfato.
El marcado sobre la base se ha utilizado en especial en el enfoque de marcado de los ácidos nucleicos por incorporación de nucleótidos marcados directamente.
El marcado sobre el azúcar se utiliza a menudo en el caso de sondas nucleicas preparadas por síntesis química.
El marcado sobre el grupo fosfato se ha utilizado también para introducir brazos funcionalizados y marcadores durante la síntesis química de los oligonucleótidos.
De hecho, la persona conocedora del oficio que debe efectuar un marcado de un nucleótido o de un análogo de nucleótido o de un ácido nucleico, es proclive a efectuar esta fijación sobre la base o sobre el azúcar, que le ofrecen más comodidad y alternativas. Esto es, por cierto, lo que se deduce del estudio de numerosos documentos, tales como los documentos de las patentes EP-A-.329.198, EP-A-.32.175, EP-A-.97.373, EP-A-.63.879, US-A- 5.449.767, US-A-5.328.824, WO-A-93/1694, DE-A-3.91.151 y EP-A-.567.841 para la base o EP-A-.286.898 para el azúcar.
La fijación del marcador sobre el fosfato es una técnica más compleja que la técnica que consiste en funcionalizar la base o el azúcar y ha sido mucho menos utilizada, en especial debido a la débil reactividad del fosfato (véase por ejemplo Jencks W.P. et al., J. Amer. Chem. Soc., 82, 1778-1785, 196). De la misma forma, en la revisión de ODonnel y McLaughlin (Repórter groups for the analysis of nucleic acid structure, p. 216-243, en Bioorganic Chemistry: Nucleic Acids, editor Hecht S.M., Oxford University Press, 1996) que trata sobre los métodos de introducción de sondas en los fragmentos de oligonucleótidos, se considera imposible la alquilación eficaz del fosfodiéster internucleotídico.
El documento de la solicitud de patente WO-A-99/65926 describe un procedimiento de marcado de un ácido ribonucleico (ARN), de síntesis o natural, que consiste en fragmentar el ARN y en marcar en el grupo fosfato terminal. Este documento describe un cierto número de funciones que se puede utilizar para el marcado en relación con la fragmentación, como las funciones hidroxilo, amina, hidracina, alcoxiamina, halogenuro de alquilo, halogenuro de alquilo de tipo bencílico y en particular el derivado 5-(bromomet¡l)-fluoresceína. Estas funciones permiten marcar los ácidos nucleicos, pero es preciso asociar una etapa de fragmentación para tener un marcado eficaz ya que este marcado se produce sobre el fosfato liberado con ocasión de la fragmentación. Además, es necesario añadir un exceso importante de reactivo de marcado, respecto de la cantidad de ARN, para obtener un marcado eficaz, lo cual induce problemas de ruido de fondo generados por el marcador en exceso. Por último, este método no funciona de manera eficaz sobre la doble hélice de ADN.
Por tanto, hay necesidad de nuevos reactivos que sean eficaces desde el punto de vista del rendimiento de marcado, que sean específicos en cuanto a la posición de marcado y, en particular, que no afecten a las propiedades de hibridación de las bases implicadas en la formación de la doble hélice, por medio de enlaces de hidrógeno, que sean utilizables a la vez por el ADN y el ARN y, por último, que permitan marcar indiferentemente nucleótidos, oligonucleótidos, ácidos nucleicos naturales o preparados por transcripción, por transcripción inversa o por amplificación enzimática.
La solicitante ha propuesto ya tales nuevos marcadores que responden a las condiciones precitadas y que utilizan la función diazometilo como función reactiva para el marcado. Este es el caso, por ejemplo, en los documentos de las solicitudes de las patentes WO-A-2/9319, WO-A-2/9584 y WO-A-25/9291.
Así, la función diazometilo (de fórmula -C(N2)-) ya ha sido utilizada para la alquilación de grupos fosfato, pero se presenta un cierto número de problemas. Por una parte, los reactivos que incorporan al menos una función diazo en general son inestables per se, lo que plantea problemas para la utilización de estos reactivos en un kit de marcado, lo cual es un defecto insalvable si el producto marcado tiene por función poner en evidencia la presencia de una molécula blanco biológica en una muestra cualquiera.
Por último, los reactivos que llevan la función diazometllo y asociados a ciertos marcadores, tales como la biotina, son poco solubles en agua, lo que conduce a utilizar disolventes orgánicos miscibles en agua para el acoplamiento con moléculas biológicas, que no son solubles más que en agua o en tampones acuosos. Pero estos disolventes, si se utilizan en una concentración demasiado importante en la reacción de marcado, implican el riesgo de provocar la precipitación de las biomoléculas. En consecuencia, conviene poder disponer de reactivos de marcado suficientemente solubles en los medios acuosos.
Los reactivos de marcado preconizados en los documentos de las patentes WO-A-2/9319, WO-A-2/9584 (moléculas de primera generación) y WO-A-25/9291 (moléculas de segunda generación) mencionados previamente en el texto resuelven también estos problemas técnicos. Se invita al lector a referirse a estos documentos para cualquier explicación complementaria que faltase, por omisión involuntaria, en el texto que expone la presente invención.
La presente invención es una mejora consecuente de las moléculas existentes. En efecto, las moléculas de primera y de segunda generación tienen el inconveniente de ser inestables químicamente, incluso si este punto se ha mejorado respecto a lo que ya existía antes. Así, el marcado continúa teniendo un buen rendimiento puesto que los resultados obtenidos son muy buenos durante más de un año. Además su síntesis continúa siendo relativamente compleja. Las moléculas de tercera generación son mucho más estables y más fáciles de sintetizar, lo que presenta ventajas considerables en términos de la fecha de caducidad de los kits que contienen estas moléculas y de la industrialización de las síntesis.
Las moléculas de primera y de segunda generación son estables funcionalmente durante un año si se conservan a baja temperatura en un disolvente orgánico anhidro. Las moléculas de tercera generación son mucho más estables funcionalmente y químicamente ya sea en medio líquido o en medio seco. Por lo tanto, se pueden manipular en medio acuoso después de haber sido conservadas en seco, por ejemplo por secado o liofilización, durante un período de tiempo mucho más largo (entre 1 y 1 veces más), lo que no es el caso de las moléculas de primera o de segunda generación, que no resisten la liofilización.
Esta valorización industrial de las moléculas de tercera generación es especialmente importante en los dispositivos integrados o en los microsistemas, donde la química implicada debe ser robusta y de alto rendimiento, sin que se deba incriminar en caso de problemas la estabilidad de ciertos reactivos.
Sin embargo, incluso si estas moléculas y estos procedimientos de marcado son particularmente eficaces, la solicitante ha logrado encontrar nuevas moléculas y nuevos procedimientos que mejoran aún la eficacia del marcado. La presente invención aporta una solución con el fin de responder al problema de la estabilidad de las moléculas de la primera y de la segunda generaciones. Así, dos nuevas funcionalidades moleculares se han asociado para crear estos nuevos reactivos. Se definen de la siguiente manera:
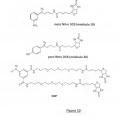
la función diazometilo posee en alfa un grupo aromático, el mismo sustituido una o varias veces por un grupo nitro (NO2) en posición meta, para u orto;
la función diazo posee en alfa el grupo que permite la detección. Este grupo puede ser la biotina o cualquier otro grupo que permita la detección.
Este segundo punto es una característica totalmente original respecto de las moléculas de la primera y de la segunda generaciones puesto que antes el grupo que permitía... [Seguir leyendo]
Reivindicaciones:
1. Reactivo de marcado de fórmula (A):
-( L )Ri
en la cual:
Ri representa un marcador detectable o al menos dos marcadores detectables unidos entre sí mediante al menos una estructura multimérica;
R2 y R3 representan, de manera independiente uno del otro: H, NO2, Cl, Br, F, I, R4-(L)n-Y-X, OR, SR, NR2, R, NHCOR, CONHR o COOR, con R = grupo alquilo o arilo y R4 representa un marcador detectable o al menos dos marcadores detectables unidos entre sí mediante al menos una estructura multimérica;
L es un brazo de enlace que tiene un encadenamiento lineal de al menos dos enlaces covalentes y
n es un número entero igual a 1;
A es un brazo de enlace que tiene al menos un doble enlace covalente que permite la conjugación de la función diazo con el ciclo aromático;
u es un número entero comprendido entre y 2 y
-Y-X- representa -CONH-, -NHCO-, CH2-, -CH2S-,
2. Reactivo de marcado, según la reivindicación 1, de fórmula (C):
R1 representa un marcador detectable o al menos dos marcadores detectables unidos entre sí mediante al menos una estructura multimérica;
R2 y R3 representan, de manera independiente uno del otro: H, NO2, Cl, Br, F, I, R4-(L)n-Y-X, OR, SR, NR2, R, NHCOR, CONHR o COOR, con R = grupo alquilo o arilo y R4 representa un marcador detectable o al menos dos marcadores detectables unidos entre sí mediante al menos una estructura multimérica;
L es un brazo de enlace que tiene un encadenamiento lineal de al menos dos enlaces covalentes y
n es un número entero igual a 1 y
-Y-X- representa -CONH-, -NHCO-, CH2-, -CH2S-,
3. Reactivo de marcado, según una cualquiera de las reivindicaciones 1 o 2, de fórmula (E):
k L )~R1
en la cual:
4. Reactivo, según una cualquiera de las reivindicaciones 1 a 3, caracterizado porque el grupo nitro está en posición meta o para.
5. Reactivo, según una cualquiera de las reivindicaciones 1 a 4, caracterizado porque Ri está constituido por un resto de D-biotina de fórmula (F):
o
HN NH
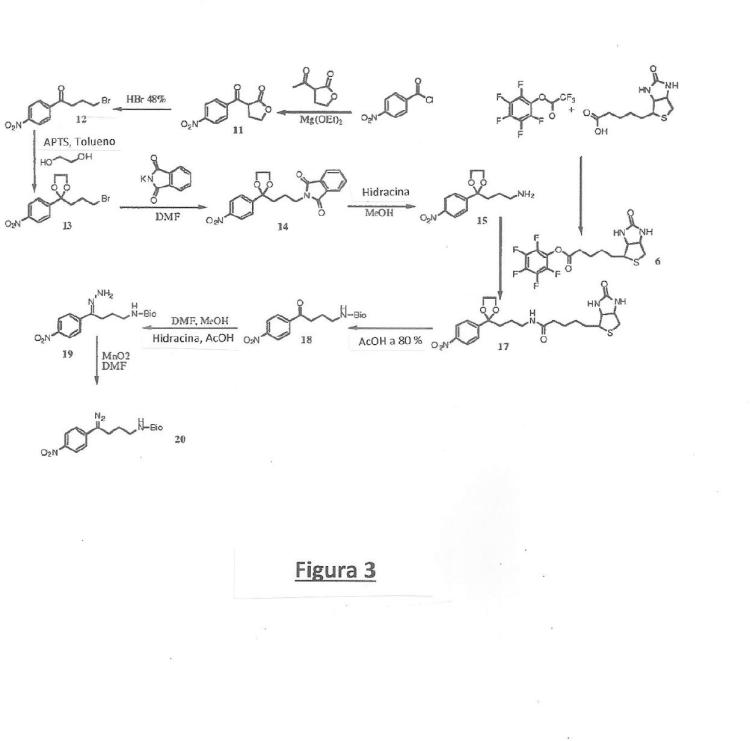
6. Procedimiento de síntesis de un reactivo de marcado, según una cualquiera de las reivindicaciones 1 a 5, que comprende las etapas siguientes:
a) se hace reaccionar un derivado de ácido carboxílico con el enolato de una lactona (reacción de tipo Claisen) para formar un precursor cíclico;
b) a continuación dicho precursor cíclico se abre con un ácido halogenado para formar una cetona aromática halogenada;
c) la función carbonilo de la cetona aromática halogenada se protege con un grupo protector para formar un precursor protegido;
d) dicho precursor protegido se somete a una reacción de aminación (de tipo Gabriel) para formar un precursor aminado;
e) dicho precursor aminado se desprotege para liberar la función amina; dicha función amina se hace reaccionar con un marcador detectable cuya función carboxílica se activa para formar un precursor que tiene un marcador detectable;
f) el precursor marcado se somete a una reacción de desprotección de la función carbonilo, para formar un precursor marcado y carbonilado y, por último,
g) el precursor marcado y carbonilado se transforma en un reactivo de marcado, según una cualquiera de las reivindicaciones 1 a 5, mediante una transformación de la función carbonilo en una función diazo (del tipo Banworth Stevens).
7. Procedimiento para el marcado de una molécula biológica, que comprende poner en contacto en disolución homogénea, en un tampón sensiblemente acuoso, una molécula biológica y un reactivo, según una cualquiera de las reivindicaciones 1 a 5.
8. Molécula biológica marcada por el procedimiento según la reivindicación 7.
9. Procedimiento de marcado y de fragmentación de un ácido nucleico de una o de doble hélice que comprende las etapas siguientes:
fragmentar el ácido nucleico;
unir un marcador sobre al menos uno de los fragmentos por intermedio de un reactivo de marcado escogido entre los reactivos según una cualquiera de las reivindicaciones 1 a 5,
acoplándose dicho reactivo de manera covalente y mayoritaria sobre al menos un fosfato de dicho fragmento.
1. Procedimiento, según la reivindicación 9, caracterizado porque la fragmentación y el marcado se efectúan 5 en dos etapas.
11. Procedimiento, según la reivindicación 9, caracterizado porque la fragmentación y el marcado se efectúan en una etapa.
12. Procedimiento, según una cualquiera de las reivindicaciones 9 a 11, caracterizado porque el marcado se efectúa en disolución homogénea sensiblemente acuosa.
13. Procedimiento, según una cualquiera de las reivindicaciones 9 a 11, caracterizado porque la fragmentación
se efectúa por vía enzimática, física o química.
14. Ácido nucleico marcado mediante el procedimiento, según una cualquiera de las reivindicaciones 9 a 13.
15. Kit de detección de un ácido nucleico objetivo que comprende un ácido nucleico marcado, según la reivindicación 14.
16. Soporte sólido sobre el cual se fija un reactivo, según una cualquiera de las reivindicaciones 1 a 5.
17. Procedimiento de captura de ácidos nucleicos que comprende las etapas siguientes:
se dispone de un soporte sólido sobre el cual se fija directa o indirectamente al menos una molécula biológica, según la reivindicación 8 o un ácido nucleico, según la reivindicación 14; la molécula biológica o el ácido nucleico comprenden una función diazometilo;
se pone en contacto una muestra biológica susceptible de contener ácidos nucleicos libres y
se lava el soporte sólido donde la o las moléculas se fijan de manera covalente al menos a un ácido nucleico.
Patentes similares o relacionadas:
Inmunoensayos de canalización de oxígeno luminiscentes heterogéneos, del 15 de Julio de 2020, de SIEMENS HEALTHCARE DIAGNOSTICS INC.: Un kit que contiene un sistema de deteccion quimioluminiscente, comprendiendo el kit: (a) una composicion que comprende un compuesto quimioluminiscente activable […]
Kit de reactivos utilizado para detectar gastrina-17 y método de preparación y aplicación para el kit de reactivos, del 15 de Julio de 2020, de Shenzhen New Industries Biomedical Engineering Co., Ltd: Un kit para detectar gastrina-17, caracterizado porque comprende un componente A y un componente B, en donde el componente A es un primer […]
Determinación de enriquecimientos de trazadores de glucosa mediante espectrometría de masas, del 13 de Mayo de 2020, de Medizinische Universität Graz: Procedimiento para determinar, en una muestra, los enriquecimientos de un primer y, por lo menos, un segundo trazador marcado de una forma […]
Compuestos de tienopirrol y usos de los mismos como inhibidores de luciferasas procedentes de Oplophorus, del 6 de Mayo de 2020, de PROMEGA CORPORATION: Un compuesto de fórmula (I), o una sal del mismo: **(Ver fórmula)** en la que: la línea discontinua representa la presencia o ausencia de un enlace; X es […]
Etiqueta de epítopo y método de detección, captura y/o purificación de polipéptidos etiquetados, del 15 de Abril de 2020, de ChromoTek GmbH: Péptido epítopo aislado que tiene de 12 a 25 aminoácidos, en donde la secuencia de aminoácidos comprende una secuencia según se define en SEQ ID NO: 32 (X1X2RX4X5AX7SX9WX11X12), […]
Nanomateriales multicomponentes de Au y métodos de síntesis, del 15 de Abril de 2020, de THE CURATORS OF THE UNIVERSITY OF MISSOURI: Una nanoconstrucción de AuNP(DTDTPA)(biomolécula) que comprende una nanopartícula (NP) de Au, DTDTPA y una biomolécula, en donde DTDTPA es ácido dietilentriaminopentaacético […]
Tira para monitorizar concentraciones de analito, del 8 de Abril de 2020, de Biostrip ApS: Un procedimiento para medir la concentración de al menos un analito C en una muestra líquida, consistiendo dicho procedimiento en: i) aplicar una muestra […]
Ensayo para capturar y detectar células de mieloma múltiple circulantes de la sangre, del 25 de Marzo de 2020, de Menarini Silicon Biosystems S.p.A: Un método para capturar, aislar y analizar células de mieloma múltiple circulantes en una muestra de sangre obtenida de un sujeto de prueba que comprende (a) […]