Proteínas de tipo interferón humano recombinantes.
Un polinucleótido aislado que codifica para una proteína que tiene actividades biológicas de tipo interferón humano,
seleccionándose dicho polinucleótido del grupo que consiste en polinucleótidos que comprenden cada uno una secuencia nucleotídica al menos un 95 % idéntica a la SEC ID Nº: 1, y en el que la proteína tiene una actividad anti-proliferativa al menos 10 veces mayor que el interferón humano alfa 2b (HuIFN-a2b).
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/CA2007/001123.
Solicitante: Novagen Holding Corporation.
Inventor/es: LIU, LONGBIN, ZHANG,RUI, WANG,Ling, XU,Jing, WANG,HAITAO, MAO,CHUNSHENG, LI,JIZHI, DU,YONG.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K38/21 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › Interferones.
- A61P31/12 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 31/00 Antiinfecciosos, es decir antibióticos, antisépticos, quimioterápicos. › Antivirales.
- A61P35/00 A61P […] › Agentes antineoplásicos.
- A61P37/02 A61P […] › A61P 37/00 Medicamentos para el tratamiento de problemas inmunológicos o alérgicos. › Inmunomoduladores.
- C07K14/555 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › Interferones (IFN).
- C07K19/00 C07K […] › Péptidos híbridos (Inmoglobulinas híbridas compuestas solamente de inmoglobulinas C07K 16/46).
- C12N15/20 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Interferones.
PDF original: ES-2524251_T3.pdf





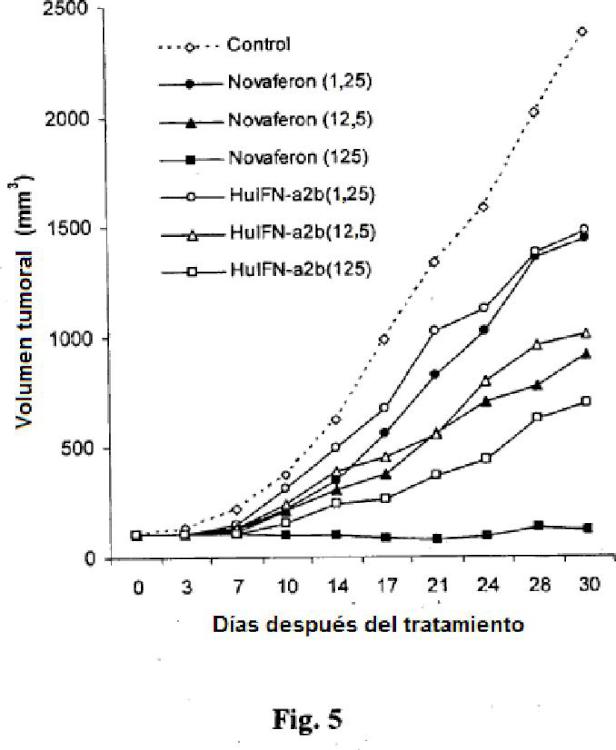
Fragmento de la descripción:
Proteínas de tipo interferón humano recombinantes Campo de la invención
Esta solicitud se refiere a proteínas recombinantes que tienen actividades biológicas de tipo interferón humano. Antecedentes
En esta solicitud se ha adoptado la nomenclatura de interferón (IFN) publicada en Nature (1).
Los interferones humanos (HulFN) que descubrieron Isaacs y Lindenmann en 1957 (2), son una familia bien conocida de citocinas secretadas por una gran variedad de células eucariotas tras la exposición a varios estímulos, tales como infección viral o exposición a mitógeno. Los IFN pueden provocar muchos cambios en el comportamiento celular, incluyendo efectos sobre el crecimiento celular y la diferenciación y modulación del sistema inmunitario (3-7). Los HulFN se han clasificado en seis subgrupos, en concreto IFN-a, IFN-jf, IFN-y, IFN-to, IFN-e e IFN-k, HulFN-a (interferón derivado de leucocitos) se produce en células leucocitarias humanas y, junto con cantidades minoritarias de HulFN-p (interferón derivado de fibroblastos), en células linfoblastoides. Los HulFN se han clasificado adicionalmente por sus características químicas y biológicas en dos categorías generales, en concreto tipo I y tipo II. El tipo I consiste en los subgrupos IFN-ae INF-p, así como los subgrupos recientemente descubiertos IFN-to, IFN-e e IFN-k. El tipo II tiene solo un miembro: IFN-y (interferón inmune).
Los diferentes subgrupos de interferón tienen diferentes características estructurales y biológicas. HulFN-p es una glicoproteína unida a N (8, 9) que se ha purificado hasta homogeneidad y se ha caracterizado. Es heterogénea con respecto al tamaño, presumiblemente debido a su resto de carbohidrato. Sin embargo, existe solo un gen de IFN-p humano, que codifica para una proteína de 166 aminoácidos. IFN-p tiene una baja homología con IFN-a, compartiendo aproximadamente un 3-4 % de identidad.
Al contrario de la exclusividad del gen de IFN-p, HulFN-a es un subgrupo que consiste en una familia de múltiples genes de 14 genes esencialmente. Variantes minoritarias preparadas a partir de diferencias de uno o dos aminoácidos representan los múltiples alelos (1). Excluyendo el pseudogén IFNAP22, existen 13 genes que codifican para 13 proteínas. Cada proteína comprende 165-166 aminoácidos. La proteína codificada por el gen IFNA 13 es idéntica a la proteína IFNA 1. Por tanto, existen 12 proteínas de interferón alfa individuales: IFNA 1, IFNA2, IFNA4, IFNA5, IFNA6, IFNA7, IFNA8, IFNA1, IFNA14, IFNA6, IFNA17 e IFNA21. La identidad de secuencia de aminoácido entre subtipos de IFN-a tiene generalmente un 8-85 % de homología (11).
El IFN-co maduro muestra un 6 % de homología de secuencia nucleotídica con la familia de especies de IFN-a pero es más largo en 6 aminoácidos en su extremo C terminal. IFN-to está relacionado de manera más distanciada con el interferón-P (comparte alrededor de un 3 % de homología de secuencia). El IFN-to humano no está clasificado en el grupo de IFN-a porque es antigénicamente distinto del IFN-a y difiere en su interacción con el receptor de IFN-a de tipo I (12). IFN-to se secreta por leucocitos infectados con virus como un componente mayoritario de interferones de leucocitos humanos.
La proteína madura de IFN-e contiene 185 aminoácidos, compartiendo aproximadamente un 33% y un 37% de homología de secuencia con IFN-a2 e IFN-P respectivamente (13, 14). La función y las propiedades biológicas de IFN-e no se han caracterizado significativamente en detalle; sin embargo, funciona como los interferones de Tipo I. IFN-e puede desempeñar también un papel en la función reproductora (15).
IFN-k, una citocina humana de 18 aminoácidos es un IFN de Tipo I identificado recientemente. La secuencia codificante de IFN-k es -3% idéntica a los otros interferones de Tipo I encontrados en seres humanos. Una característica distintiva de IFN-k es la expresión constitutiva detectable de su transcripto en células no inducidas, particularmente queratinocitos. IFN-k puede desempeñar un papel en la regulación de funciones inmunológicas sistémicas o locales a través de su efecto sobre células del sistema inmunitario innato (16). Sin embargo, IFN-k muestra una baja actividad anti-viral (17).
El interferón de Tipo I humano parece unirse a dos subunidades de receptor, IFNAR-1 y -2, que están ampliamente distribuidas en la superficie celular de diversos tipos de células. La implicación de ligandos lleva a la inducción de la fosforilación de tirosina quinasas TYK2 y JAK-1 que se acoplan a IFNAR-1 y -2 respectivamente. Una vez fosforiladas, las proteínas STAT se liberan del receptor y forman homodímeros así como heterodímeros (18, 19). Una vez liberados, los dímeros de STATA se asocian con el Factor 9 Sensible a interferón (IRF-9), una proteína de unión a ADN, que forma un complejo denominado factor-3 de genes estimulados por IFN (ISGF-3) que migra al interior del núcleo. A continuación, el complejo ISGF-3 se une a un elemento de ADN que existe en el sentido 5 de todos los genes inducibles por IFN. Ésta es la denominada ruta de transducción de señales clásica.
Nuevos modos de acción y rutas bioquímicas reguladas por IFN de Tipo I se están descubriendo continuamente. Por ejemplo, en el sentido 3 de P13K en la ruta de transducción de señales, el factor nuclear kappa-B (NF-kB) y PKC-d, se asocian con efectos anti-apoptóticos observados en neutrófilos incubados con IFN-p (2).
Más de 3 genes, denominados genes inducidos por interferón, son sensibles al tratamiento con IFN. Las proteínas de IFN más estudiadas son aquellas con propiedades anti-virales. Por ejemplo, la enzima de la familia de 2,5 oligosintetasa (OAS-1 y -2) cataliza la síntesis oligoadenilatos cortos, que se unen a y activan la ARNasaL, una enzima que escinde ARN viral y celular, inhibiendo así la síntesis de proteínas. La proteína quinasa activada por ARNbc (PKR) fosforila el factor de iniciación de la traducción elF2a, dando como resultado así la inhibición de síntesis de proteínas celulares y virales. Más recientemente, se descubrió también que PKR se requería para la activación del factror de transcripción NF-kB, un actor central en la inducción de citocinas inflamatorias, modulación inmunitaria, y apoptosis. Las proteínas Mx (de resistencia a mixovirus) inhiben la replicación de los virus de ARN mediante o bien evitando el transporte de partículas virales al interior de las células, o bien mediante la transcripción de ARN viral. La adenosina desaminasa específica de ARN (ADAR) convierte adensina en inosina, provocando así una hipermutación de genomas de ARN virales (21).
Los HulFN presentan un amplio espectro de actividades biológicas incluyendo funciones anti-virus, antitumorales, y de inmunorregulación. Los potenciales clínicos de los interferones humanos se han explorado ampliamente y se resumen a continuación.
Con respecto a las aplicaciones antitumorales, los HulFN pueden mediar efectos antitumorales o bien indirectamente mediante regulación de respuestas inmunomoduladoras y anti-angiogénicas o directamente afectando a la proliferación o diferenciación celular de células tumorales (22). La terapia con interferón se ha usado en el tratamiento de diversas leucemias (23), por ejemplo leucemia de células pilosas (24), leucemia mieloide aguda y crónica (25-27), osteosarcoma (28), carcinoma de células básales (29), glioma (3), carcinoma de células renales (31), mieloma múltiple (32), melanoma (33), sarcoma de Kaposi (23) y enfermedad de Hodgkin (34). La terapia de combinación de IFN-a con citarabina (ara-C), 5-FU, hidroxiura e IL-2 se han estudiado adecuadamente, principalmente mostrando resultados significativamente mejores que el HulFN-a solo (3). También se ha notificado el tratamiento sinérgico de cáncer avanzado con una combinación de HulFN y temozolomida (35).
Con respecto a las aplicaciones anti-virus, los HulFN se han usado clínicamente para terapia anti-viral, por ejemplo, en el tratamiento del SIDA (36), hepatitis viral incluyendo hepatitis B crónica, hepatitis C (37, 38), infección por el virus del papiloma (39), infección por virus del herpes (4), encefalitis viral (41), y en la profilaxis de rinitis e
infecciones respiratorias (4).
Los HulFN se han usado también clínicamente para terapia antibacteriana (42), por ejemplo, HulFN-y aerosolizado (43) y HulFN-a se han usado en pacientes con tuberculosis pulmonar resistente a múltiples fármacos (44). Los HulFN-y se han usado en el tratamiento de tuberculosos resistente a múltiples fármacos del cerebro (45).
Los HulFN se han usado también clínicamente para terapia de inmunomodulación por ejemplo, para prevenir el rechazo de injerto contra el huésped, o para cercenar la progresión... [Seguir leyendo]
Reivindicaciones:
1. Un polinucleótido aislado que codifica para una proteína que tiene actividades biológicas de tipo interferón humano, seleccionándose dicho polinucleótido del grupo que consiste en polinucleótidos que comprenden cada uno una secuencia nucleotídica al menos un 95 % idéntica a la SEC ID N2: 1, y en el que la proteína tiene una actividad anti-proliferativa al menos 1 veces mayor que el interferón humano alfa 2b (HulFN-a2b).
2. Una proteína que muestra actividades biológicas de tipo interferón humano, seleccionándose dicha proteína del grupo que consiste en proteínas que comprenden cada una una secuencia de aminoácidos al menos un 9 % idéntica a la SEC ID N2: 2, teniendo la proteína una actividad anti-proliferativa al menos 1 veces mayor que el interferón humano alfa 2b (HulFIM-a2b).
3. La proteína tal como se define en la reivindicación 2, en donde dicha secuencia es al menos un 95 % idéntica a la SEC ID N2: 2.
4. La proteína tal como se define en la reivindicación 3, en donde dicha proteína tiene actividades anti-virales y anti- proliferativas.
5. El polinucleótido tal como se define en la reivindicación 1, en el que dicha secuencia es al menos un 98 % idéntica a la SEC ID N2: 1.
6. El polinucleótido tal como se define en la reivindicación 1 o la proteína que se define en la reivindicación 2, teniendo la proteína una actividad anti-viral al menos 2 veces mayor que el interferón humano alfa 2b (HulFN-a2b).
7. La proteína tal como se define en la reivindicación 2, siendo recombinante dicha proteína.
8. Un polipéptido que comprende un fragmento de la proteína tal como se define en la reivindicación 2, en el que dicho fragmento muestra dichas actividades biológicas de tipo interferón humano.
9. Un constructo de proteína que comprende la proteína tal como se define en la reivindicación 2 acoplada con otro resto, mostrando dicho constructo dichas actividades biológicas de tipo interferón humano.
1. El constructo de proteína tal como se define en la reivindicación 9, en el que:
(1) dicha proteína está glicosilada;
(2) dicho resto es un polipéptido;
(3) dicho resto es un no-polipéptido tal como una molécula de polímero, por ejemplo, un polietilenglicol lineal o ramificado; o
(4) dicho resto es una molécula de mareaje.
11. Una composición que comprende la proteína tal como se define en la reivindicación 2 y un vehículo, diluyente o excipiente farmacéuticamente aceptables.
12. Un polinucleótido que codifica para una proteína tal como se define en la reivindicación 2 o la reivindicación 3.
13. Uso de la proteína tal como se define en la reivindicación 2 en la fabricación de un medicamento para el tratamiento del cáncer o una enfermedad viral.
14. Una proteína tal como se define en la reivindicación 2 para su uso en el tratamiento del cáncer o una enfermedad viral.
15. Una proteína que tiene la secuencia de aminoácidos de la SEC ID N2: 2 o un fragmento de la misma que muestra actividades biológicas de tipo interferón humano, teniendo la proteína o el fragmento de la misma una actividad anti-proliferativa al menos 1 veces mayor que el interferón humano alfa 2b (HulFN-<x2b).
16. Un polinucleótido que codifica para la proteína de la reivindicación 15.
Patentes similares o relacionadas:
Compuestos de alquinilbenceno heterocíclicos, y composiciones médicas y usos de los mismos, del 29 de Julio de 2020, de Guangzhou Healthquest Pharma Co., Ltd: Un compuesto de alquinilbenceno heterocíclico que tiene la fórmula (I) y una sal farmacéuticamente aceptable, o estereoisómero del mismo, **(Ver […]
 Composiciones y métodos para el tratamiento de trastornos de células plasmáticas y trastornos prolinfocíticos de células b, del 29 de Julio de 2020, de Knopp Biosciences LLC: Una composición que comprende una cantidad terapéuticamente eficaz de dexpramipexol para su uso en el tratamiento de un trastorno de células B caracterizado por niveles elevados […]
Composiciones y métodos para el tratamiento de trastornos de células plasmáticas y trastornos prolinfocíticos de células b, del 29 de Julio de 2020, de Knopp Biosciences LLC: Una composición que comprende una cantidad terapéuticamente eficaz de dexpramipexol para su uso en el tratamiento de un trastorno de células B caracterizado por niveles elevados […]
Derivados de piperidina 1,4 sustituidos, del 29 de Julio de 2020, de 89Bio Ltd: Un compuesto de acuerdo con la Fórmula I: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en donde: A se selecciona de […]
Profármacos de gemcitabina, del 29 de Julio de 2020, de NuCana plc: Una formulación farmacéutica que comprende gemcitabina-[fenil-benzoxi-L-alaninil)]-(S)-fosfato 3: **(Ver fórmula)** o una sal o solvato […]
Formas cristalinas de 6-((6,7-dimetoxiquinazolin-4-il)oxi)-N,2-dimetilbenzofuran-3-carboxamida, del 29 de Julio de 2020, de Hutchison Medipharma Limited: Forma I de 6-((6,7-dimetoxiquinazolin-4-il)oxi)-N,2-dimetilbenzofuran-3-carboxamida, en donde el difractograma de rayos X de polvo de la Forma […]
Compuestos y procedimientos de uso, del 29 de Julio de 2020, de Medivation Technologies LLC: Un compuesto de fórmula (Aa-1): **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en la que: A representa H, halógeno, amino, […]
Complejos de agentes terapéuticos de base vírica y poli(beta-amino-ésteres) modificados, del 29 de Julio de 2020, de Sagetis Biotech, SL: Un complejo de un agente terapéutico de base vírica con un polímero de fórmula I: **(Ver fórmula)** donde cada L1 y L2 están seleccionados […]
Conectores autoinmolativos no lineales y conjugados de los mismos, del 22 de Julio de 2020, de Byondis B.V: Compuesto conector-farmaco con la formula (I) **(Ver fórmula)** o sal, hidrato o solvato farmaceuticamente aceptables del mismo, donde […]