Procedimientos para sintetizar 3-(dihidroisoindolinona-2-il sustituida)-2,6-dioxopiperidina e intermedios de la misma.
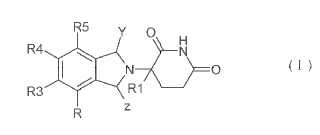
Un procedimiento para sintetizar un compuesto de Fórmula (I):
que comprende hacer reaccionar un compuesto de Fórmula (II) con un compuesto de Fórmula (III) para proporcionarun compuesto de Fórmula (IV):
en las que:
uno de R,
R3, R4 y R5 es amino o amino protegido, nitro o halógeno y los otros son todos hidrógeno;
X es halógeno;
Y es: ≥O o H;
Z es: ≥O o H;
y con la condición de que Y y Z sean ambos ≥O; o uno de Y y Z es ≥O y el otro es H;
R' es un ion metálico alcalino o hidrógeno o grupo protector imina;
A y B son cada uno independientemente hidroxilo, alcoxi C1-10, ariloxi, arilalcoxi C1-4 o NHR2 y en los que, R2 eshidrógeno o grupo protector amino;
R1 es alquilo C1-4 o hidrógeno.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/CN2010/073437.
Solicitante: Nanjing Cavendish Bio-Engineering Technology Co., Ltd.
Nacionalidad solicitante: China.
Dirección: No. 6 Maiyue Road Maigaoqiao Pioneering Park Qixia District Nanjing Jiangsu 210028 CHINA.
Inventor/es: YAN, RONG, YANG,HAO, XU,YONGXIANG.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07D209/46 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 209/00 Compuestos heterocíclicos que contienen ciclos de cinco miembros, condensados con otros ciclos, con solamente un átomo de nitrógeno como heteroátomo. › con un átomo de oxígeno en posición 1.
- C07D209/48 C07D 209/00 […] › con átomos de oxígeno en posición 1 y 3, p. ej. ftalimida.
- C07D401/04 C07D […] › C07D 401/00 Compuestos heterocíclicos que contienen dos o más heterociclos, que tienen átomos de nitrógeno como únicos heteroátomos del ciclo, siendo al menos un ciclo de seis miembros con solamente un átomo de nitrógeno. › directamente unidos por un enlace entre dos miembros cíclicos.
- C07D405/04 C07D […] › C07D 405/00 Compuestos heterocíclicos que contienen a la vez uno o más heterociclos que tienen átomos de oxígeno como únicos heteroátomos del ciclo y uno o más heterociclos que tienen átomos de nitrógeno como único heteroátomo del ciclo. › unidos directamente por un enlace entre dos miembros cíclicos.
PDF original: ES-2437751_T3.pdf
Fragmento de la descripción:
Procedimientos para sintetizar 3- (dihidroisoindolinona-2-il sustituida) -2, 6-dioxopiperidina e intermedios de la misma
Campo técnico
La presente invención está en el campo de la química farmacéutica y más específicamente se refiere a procedimientos para sintetizar 3- (dihidroisoindolinona-2-il sustituida) -2, 6-dioxopiperidina e intermedios de la misma.
Técnica anterior
Lenalidomida, un análogo de talidomida, es una clase de inmunomodulador con actividades anti-proliferación vascular y anti-tumoral; su nombre químico es 3- (4-amino-1-oxo-1, 3-dihidro-2H-isoindol-2-il) -2, 6-dioxopiperidina y su estructura química es como sigue:
Lenalidomida tiene el residuo de dioxopiperidina y el residuo de dihidroisoindolina, así como un centro asimétrico en su estructura. En la actualidad la lenalidomida aprobada en el mercado son mezclas racémicas.
Como se manifiesta en el artículo "Amino-substituted thalidomide analogs: Potent inhibitors of TNF-α production" (Bioorganic & Medicinal Chemistr y Letters, vol. 9, Tema 11, 7 de junio, 1999, páginas 1625-1630) y la Patente de China ZL97180299.8 por Muller, etc., el procedimiento de preparación de 3- (dihidroisoindolinona-2-il sustituida) -2, 6-dioxopiperidina es como sigue: se hace reaccionar clorhidrato de α-aminoglutarimida con 2-bromometil-3-nitrobenzoato, después se hidrogenó sobre Pd/C para proporcionar lenalidomida.
en la que, (a) en luz ultravioleta (lámpara de mercurio) , NBS, CCl4, someter a reflujo; (b) Et3N, DMF, 80 °C; (c) H2, Pd/C
al 10 %, MeOH. 7a X = 4-NO2, 8a X = 4-NH2. En lo que, la síntesis de clorhidrato de α-aminoglutarimida comienza con N-benciloxi-carbonil-L-glutamina que reacciona con N, N'-carbonildiimidazolo (CDI) sometiéndose a reflujo en THF proporcionando N-benciloxicarbonil-aminoglutarimida; el material clave de la reacción es: 2-bromometil-3-nitrobenzoato de metilo, que se convierte a partir de 2-metil-3-nitrobenzoato por brominación catalítica en la condición de tetracloruro de carbono en luz ultravioleta. La reacción catalítica y de reflujo necesita un periodo de tiempo largo y su rendimiento es lento. Adicionalmente, la producción en masa no es fácil de realizar debido a la dificultad de la protección en el trabajo de los trabajadores contra radiación ultravioleta producida por lámpara de mercurio como fuente de luz catalítica.
En la la Solicitud de Patente de los EE.UU. US2006/0052609 Al, Muller etc. divulgan otro procedimiento de síntesis de 3- (dihidroisoindolinona-2-il sustituida) -2, 6-dioxopiperidina:
En la solicitud de Patente de los EE.UU. US2006052609A1 y en la solicitud de Patente de China CN97180299.8, el producto de reacción se purificó por cromatografía en columna al menos dos veces o más, lo que hace la operación industrial complicada y la hace difícil para aumentar la escala de producción industrial.
En la solicitud de Patente de los EE.UU. US2006052609A1 y en la solicitud de Patente de China CN97180299.8, la hidrogenación presurizada se usó dos veces en ambas lo que fue de mucho más riesgo en operación industrial.
Además, cuando N-benciloxicarbonil-L-glutamina, como material inicial, reaccionó con N, N'-carbonildiimidazol en THF sometiéndose a reflujo durante 24 horas para proporcionar N-benciloxicarbonil-aminoglutarimida, la pureza baja del rendimiento debido a tiempo de reacción largo para someter a reflujo y temperatura alta hicieron difícil la extracción.
Por otro lado, el rendimiento total fue más bajo del 20 % y del 18 % comunicados respectivamente en la solicitud de Patente de los EE.UU. US2006052609A1 y en la solicitud de Patente de China. Además, en los dos documentos anteriores se comunicó que "tetracloruro de carbono letal" era el disolvente reactivo usado para reflujo. Tetracloruro de carbono, que se prohibió usar por la UNEP, tenía destrucción grave de la capa de ozono. Debido a la alta toxicidad de tetracloruro de carbono, fue difícil eliminar esta sustancia, que es dañina para el medio ambiente.
Otro procedimiento relacionado con la presente solicitud se divulgó en el documento WO2006/015060.
Sumario de la invención La presente invención proporciona un procedimiento novedoso para sintetizar 3- (dihidroisoindolinona-2-il sustituida) -2, 6-dioxopiperidina y sus intermedios, que superó las desventajas mencionadas en la técnica anterior.
Un objetivo de la presente invención es proporcionar un procedimiento novedoso para sintetizar 20 3- (dihidroisoindolinona-2-il sustituida) -2, 6-dioxopiperidina.
Otro objetivo de la presente invención es proporcionar los intermedios usados para sintetizar 3- (dihidroisoindolinona-2-il sustituida) -2, 6-dioxopiperidina.
Descripción detallada de la invención En una realización de la presente invención se proporciona un procedimiento novedoso para sintetizar el compuesto de Fórmula (I) .
Incluir la reacción del compuesto de Fórmula (II) y el compuesto de Fórmula (III) para proporcionar el compuesto de Fórmula (IV) ; en la que:
Uno de R, R3, R4 y R5 es amino o amino protegido (carbamatos: tales como carbobenziloxi, t-butiloxicarbonilo,
fluorenilmetoxicarbonilo, etc.; acilamidas: tales como acetilo, fenilacetilo, ftalilo, etc.; azanos: tales como alilo, etc.; sulfonilos y sulfinilos: tales como fenilsulfonilo, p-toluenosulfonilo, fenilsulfinilo, O-nitrofenilsulfinilo, etc.; referidos a Greene T.W. y WuTs P.G.M. Protective Groups in Organic Synthesis: P494-; East China University Of Science And Technology Press, que se incorpora de este modo por referencia en su totalidad) , nitro o halógeno (por ejemplo F, Cl, Br o I) y los otros son todos hidrógeno, preferentemente, R3, R4 y R5 son hidrógeno;
X es halógeno tal como: F, Cl, Br o I;
Y' es =O o S;
Z es =O o H;
con la condición de que Y y Z sean ambas =O; o uno de Y y Z es =O y el otro de Y y Z es H;
R' es ion metálico alcalino o hidrógeno (tal como: H, Li+, Na+, K+ o Cs+) , o grupo protector imina (tal como etoxicarbonilo, etc.; referidos a Greene T.W. y WuTs P.G.M. Protective Groups in Organic Synthesis: P494-, East China University Of Science And Technology Press y Chemical Research and Application: 2006, 18 (11) : 1349-1352) , etc., preferentemente K+ o Cs+ y más preferentemente Cs+;
A y B son cada uno independientemente hidroxilo, alcoxi C1-10, ariloxi, arilalcoxi C1-4 o NHR2 y en el presente documento, R2 es grupo protector de hidrógeno o amino (carbamatos: tales como carbobenciloxi, t-butiloxicarbonilo, 25 fluorenilmetoxicarbonilo, etc.; acilamidas: tales como acetilo, fenilacetilo, ftalilo, etc.; azanos: tales como alilo, etc.; sulfonilos y sulfinilos: tales como fenilsulfonilo, p-toluenosulfonilo, fenilsulfinilo, O-nitrofenilsulfinilo, etc.; referidos a Protective Groups in Organic Synthesis: Greene T.W., WuTs P.G.M. East China University Of Science And Technology Press: P494-) ; preferentemente, A y B son cada uno independientemente hidroxilo, metoxilo, etoxilo, propoxi, isopropoxi, butoxi, isobutoxi, t-butoxi, pentiloxi, hexiloxi, heptiloxi, octiloxi, noniloxi, deciloxi; fenoxi o fenoxi sustituido; 30 fenilalcoxi C1-4, tal como benciloxi, feniletoxi, fenilpropoxi, etc., o fenilalcoxi C1-4 sustituido; en términos del fenoxi
sustituido o fenilalcoxi C1-4 sustituido, el número de los grupos sustituidos es uno o más; los grupos sustituidos están seleccionados del grupo que consiste en alquilo C1-4, ciano halógeno y nitro y los grupos sustituidos pueden ser el mismo o diferentes, opcionalmente, los grupos están sustituidos en posición 2, 3, 4, 5 o 6 de anillo bencénico, por ejemplo 4-nitrobenciloxilo, 2-cloro-4-nitrobenciloxi; amino, o bencilamino;
R1 es alquilo C1-4 o hidrógeno; el citado alquilo C1-4 está seleccionado de metilo, etilo, propilo, isopropilo, butilo, isobutilo, t-butilo; preferentemente, R1 es hidrógeno o metilo.
La presente invención proporciona el procedimiento de síntesis del compuesto de Fórmula (I) mencionado anteriormente, después proporcionar el compuesto de Fórmula (IV) , incluyendo adicionalmente que si A y B son ambos NHR2, el compuesto de Fórmula (IV) se calienta y se cicla en presencia o no de formamida o ácido metanosulfónico proporcionando el compuesto de Fórmula (I) ; y con la condición de que cuando R2 no sea hidrógeno, el compuesto de Fórmula (IV) sufre desprotección de grupos amino y después la ciclación mencionada anteriormente para proporcionar el compuesto de Fórmula (I) ;
cuando uno de A y B es NHR2 y el otro es hidroxilo, el compuesto de Fórmula (IV) reacciona en presencia de agente de condensación (tal como cloruro de tionilo, diciclohexilcarbodiimida (DCC) , oxicloruro de fósforo, carbonildiimidazol,... [Seguir leyendo]
Reivindicaciones:
1. Un procedimiento para sintetizar un compuesto de Fórmula (I) :
que comprende hacer reaccionar un compuesto de Fórmula (II) con un compuesto de Fórmula (III) para proporcionar un compuesto de Fórmula (IV) :
en las que:
uno de R, R3, R4 y R5 es amino o amino protegido, nitro o halógeno y los otros son todos hidrógeno;
X es halógeno; 10 Y es: =O o H;
Z es: =O o H;
y con la condición de que Y y Z sean ambos =O; o uno de Y y Z es =O y el otro es H;
R' es un ion metálico alcalino o hidrógeno o grupo protector imina;
A y B son cada uno independientemente hidroxilo, alcoxi C1-10, ariloxi, arilalcoxi C1-4 o NHR2 y en los que, R2 es hidrógeno o grupo protector amino; R1 es alquilo C1-4 o hidrógeno.
2. El procedimiento de la reivindicación 1, en el que en los compuestos de Fórmula de (I) hasta (IV) : uno de Y y Z es =O y el otro es H; X es F, Cl, Br o I;
R' es H, Li+, Na+, K+ Cs+, o etoxicarbonilo; A y B son cada uno independientemente hidroxilo, metoxi, etoxi, propoxi, isopropoxi, butoxi, isobutoxi, t-butoxi, pentiloxi, hexiloxi, heptiloxi, octiloxi, noniloxi o deciloxi; amino o bencilamino; fenoxi o fenoxi sustituido; fenilalcoxi C1-4 o fenilalcoxi C1-4 sustituido; en los que, los grupos sustituidos del fenoxi sustituido o fenilalcoxi C1-4 sustituido están seleccionados del grupo que consiste en alquilo C1-4, halógeno, ciano y nitro, que pueden ser uno o más de los grupos 25 sustituidos y pueden ser el mismo o diferente, opcionalmente en posición 2, 3, 4, 5 o 6 del anillo bencénico; R1 es hidrógeno o metilo.
3. El procedimiento de la reivindicación 1 o de la reivindicación 2, en el que, después de que se proporciona el compuesto de Fórmula (IV) , el procedimiento comprende adicionalmente:
cuando A y B son ambos NHR2, calentar y ciclar el compuesto de Fórmula (IV) en presencia o no de formamida o de ácido metanosulfónico para proporcionar un compuesto de Fórmula (I) ; y con la condición de que cuando R2 no es hidrógeno, el compuesto de Fórmula (IV) sufre desprotección de grupos amino y después la ciclación mencionada anteriormente para proporcionar el compuesto de Fórmula (I) ;
cuando uno de A y B es NHR2 y el otro es hidroxilo, hacer reaccionar el compuesto de Fórmula (IV) en presencia de agente de condensación para proporcionar el compuesto de Fórmula (I) ; y con la condición de que cuando R2 no es hidrógeno, el compuesto de Fórmula (IV) sufre desprotección de grupos amino y después sufre la ciclación mencionada anteriormente para proporcionar el compuesto de Fórmula (I) ;
cuando uno de A y B es NHR2 y el otro es alcoxi C1-10, ariloxi o arilalcoxi C1-4, ciclar el compuesto de Fórmula (IV) en condición alcalina para proporcionar el compuesto de Fórmula (I) ; y con la condición de que cuando R2 no es hidrógeno, el compuesto de Fórmula (IV) sufre desprotección de grupos amino y después sufre ciclación mencionada anteriormente para proporcionar el compuesto de Fórmula (I) ;
cuando A y B son ambos hidroxilo, ciclar el compuesto de Fórmula (IV) en presencia de urea, o en presencia de trifluoroacetamida, 1-hidroxibenzotriazol y clorhidrato de N-etil-N'- (3-dimetilaminopropil) carbodiimida, para proporcionar el compuesto de Fórmula (I) ;
cuando A y B son ambos alcoxi C1-10, ariloxi o arilalcoxi C1-4, ciclar el compuesto de Fórmula (IV) en presencia de amida de metal alcalino para proporcionar el compuesto de Fórmula (I) ;
cuando uno de A y B es hidroxilo y la otra es alcoxi C1-10, ariloxi o arilalcoxi C1-4, esterificar en primer lugar el compuesto de Fórmula (IV) y después ciclar en presencia de amida de metal alcalino para proporcionar el compuesto de Fórmula (I) ; alternativamente, en primer lugar realizar hidrólisis de éster del compuesto de Fórmula (IV) y después ciclar en presencia de urea, o en presencia de trifluoroacetamida, 1-hidroxibenzotriazol y clorhidrato de N-etil-N'- (3-dimetilaminopropil) carbodiimida, para proporcionar el compuesto de Fórmula (I) ; alternativamente, amonolizar en primer lugar el compuesto de Fórmula (IV) y después hacer reaccionar en presencia de un agente de condensación, para proporcionar el compuesto de Fórmula (I) ; alternativamente, acilar en primer lugar el compuesto de Fórmula (IV) , para convertir hidroxilo a amino y después ciclar en condición alcalina para proporcionar el compuesto de Fórmula (I) ;
en la que, cada uno de los otros grupos sustituidos en la Fórmula (IV) o (I) es según se define en la reivindicación 1 o 2.
4. El procedimiento de la reivindicación 3, en el que, el agente de condensación se selecciona del grupo que consiste en cloruro de tionilo, diciclohexilcarbodiimida, oxicloruro de fósforo y carbonildiimidazol.
5. El procedimiento de la reivindicación 3, en el que, dicha condición alcalina es la presencia de base inorgánica o de base orgánica.
6. El procedimiento de la reivindicación 5, en el que, dicha base inorgánica es carbonato de potasio o carbonato de sodio y la base orgánica es terc-butóxido de potasio o metóxido de sodio.
7. El procedimiento de la reivindicación 3, en el que, dicha amida de metal alcalino se selecciona de amida de litio, amida de sodio o amida de potasio.
8. El procedimiento de la reivindicación 1 o de la reivindicación 2, en el que, después de que se proporciona el compuesto de Fórmula (IV) , el procedimiento comprende adicionalmente:
cuando A y B son ambos alcoxi C1-10, ariloxi, o arilalcoxi C1-4, amonolizar el compuesto de Fórmula (IV) para proporcionar un compuesto de Fórmula (IV') y después ciclar el compuesto de Fórmula (IV') en condición alcalina, para proporcionar el compuesto de Fórmula (I) ; alternativamente, continuar para amonolizar el compuesto de Fórmula (IV') para proporcionar eventualmente un compuesto de Fórmula (IV") y después calentar el compuesto de Fórmula (IV") para ciclarse en presencia o no de formamida o ácido metanosulfónico para proporcionar el compuesto de Fórmula (I) ;
en las que, cada uno de los otros grupos sustituidos en las Fórmulas (IV) , (IV') , (IV") y (I) es según se define en la reivindicación 1 o en la reivindicación 2.
9. El procedimiento de la reivindicación 1 o de la reivindicación 2, en el que, después de que se proporciona el compuesto de Fórmula (IV) , el procedimiento comprende adicionalmente:
cuando A y B son ambos alcoxi C1-10, ariloxi o arilalcoxi C1-4, hidrolizar el compuesto de Fórmula (IV) para proporcionar 10 un compuesto de Fórmula (V) ;
después de que se proporciona el compuesto de Fórmula (V) , ciclar adicionalmente el compuesto de Fórmula (V) para proporcionar un compuesto de Fórmula (VI) ;
después de que se proporciona el compuesto de Fórmula (VI) por ciclación, producir apertura de anillo adicionalmente amonolizando el compuesto de Fórmula (VI) para proporcionar un compuesto de Fórmula (VII) ; después hacer reaccionar el compuesto de Fórmula (VII) en presencia de un agente de condensación para proporcionar el compuesto de Fórmula (I) :
en el que, cada uno de los otros grupos sustituidos en la Fórmula (IV) , (V) , (VI) y (VII) es según se define en la reivindicación 1 o en la reivindicación 2.
10. Un procedimiento para sintetizar un compuesto de Fórmula (I) :
que comprende las siguientes etapas:
(1) hacer reaccionar un compuesto de Fórmula (II) con un compuesto de Fórmula (III) en una condición alcalina para 10 proporcionar un compuesto de Fórmula (IV) ;
(2) cuando A y B son ambos NHR2, calentar el compuesto de Fórmula (IV) y ciclarlo en presencia o no de formamida o de ácido metanosulfónico para proporcionar un compuesto de Fórmula (I) ; y con la condición de que cuando R2 no es hidrógeno, el compuesto de Fórmula (IV) sufre desprotección de grupos amino y después la ciclación mencionada anteriormente para proporcionar un compuesto de Fórmula (I) ;
cuando uno de A y B es NHR2 y el otro es hidroxilo, hacer reaccionar el compuesto de Fórmula (IV) en presencia de un agente de condensación para proporcionar un compuesto de Fórmula (I) ; y con la condición de que cuando R2 no es hidrógeno, el compuesto de Fórmula (IV) sufre desprotección de grupos amino y después sufre la ciclación mencionada anteriormente para proporcionar un compuesto de Fórmula (I) ;
cuando uno de A y B es NHR2 y el otro es alcoxi C1-10, ariloxi o arilalcoxi C1-4, ciclar el compuesto de Fórmula (IV) en condición alcalina para proporcionar un compuesto de Fórmula (I) ; y con la condición de que cuando R2 no es hidrógeno, el compuesto de Fórmula (IV) sufre desprotección de grupos amino y después sufre la ciclación mencionada anteriormente para proporcionar el compuesto de Fórmula (I) ;
cuando A y B son ambos hidroxilo, ciclar el compuesto de Fórmula (IV) en presencia de urea, o en presencia de trifluoroacetamida, 1-hidroxibenzotriazol y clorhidrato de N-etil-N'- (3-dimetilaminopropil) carbodiimida, para proporcionar un compuesto de Fórmula (I) ;
cuando A y B son ambos alcoxi C1-10, ariloxi o arilalcoxi C1-4, ciclar el compuesto de Fórmula (IV) en presencia de amida 5 de metal alcalino para proporcionar un compuesto de Fórmula (I) ;
cuando uno de A y B es hidroxilo y el otro es alcoxi C1-10, ariloxi o arilalcoxi C1-4, esterificar en primer lugar el compuesto de Fórmula (IV) y después ciclar en presencia de amida de metal alcalino para proporcionar un compuesto de Fórmula (I) ; alternativamente, en primer lugar realizar hidrólisis de éster del compuesto de Fórmula (IV) y después ciclar en presencia de urea, o en presencia de trifluoroacetamida, 1-hidroxibenzotriazol y clorhidrato de N-etil-N'- (3-dimetilaminopropil) carbodiimida, para proporcionar un compuesto de Fórmula (I) ; alternativamente, amonolizar en primer lugar el compuesto de Fórmula (IV) y después hacer reaccionar en presencia de un agente de condensación, para proporcionar un compuesto de Fórmula (I) ; alternativamente, acilar en primer lugar el compuesto de Fórmula (IV) , para convertir hidroxilo a amino y después ciclar en condición alcalina, para proporcionar el compuesto de Fórmula (I) ;
en la que, cada grupo sustituido en los compuestos de Fórmula de (I) hasta (IV) mencionado anteriormente se define como:
uno de R, R3, R4 y R5 es amino o amino protegido, nitro o halógeno y los otros son todos hidrógeno;
X es F, Cl, Br o I, 20 Y es =O o H;
Z es =O o H;
y con la condición de que Y y Z sean ambas =O; o uno de Y y Z es =O y el otro es H;
R' es ion metálico alcalino, hidrógeno o grupo protector imina;
A y B son cada uno independientemente hidroxilo, alcoxi C1-10, ariloxi, arilalcoxi C1-4 o NHR2 en los que, R2 es 25 hidrógeno o grupo protector amino;
R1 es alquilo C1-4 o hidrógeno.
11. El procedimiento de la reivindicación 10, en el que, dicha condición alcalina en la etapa (1) quiere decir la presencia de una base inorgánica o base orgánica, dicha base inorgánica está seleccionada de hidróxido de potasio, carbonato de potasio, hidróxido de sodio, carbonato de sodio, hidróxido de cesio y carbonato de cesio y dicha base orgánica es terc-butóxido de potasio o metóxido de sodio.
12. El procedimiento de la reivindicación 11, en el que dicha condición alcalina se refiere a la presencia de hidróxido de cesio o carbonato de cesio.
13. El procedimiento de una de las reivindicaciones 10 a 12, en el que, la etapa (2) es: cuando A y B son ambos alcoxi C1-10, ariloxi o arilalcoxi C1-4, amonolizar el compuesto de Fórmula (IV) para proporcionar el compuesto de Fórmula (IV')
y después ciclar el compuesto de Fórmula (IV') en una condición alcalina para proporcionar el compuesto de Fórmula (I) ;
alternativamente, continuar amonolizando el compuesto de Fórmula (IV') para proporcionar eventualmente el compuesto de Fórmula (IV") y después calentar el compuesto de Fórmula (IV") para ciclarse en presencia o no de formamida o ácido metanosulfónico, para proporcionar el compuesto de Fórmula (I) ;
en la que, cada uno de los otros grupos sustituidos en la Fórmula (IV) , (IV') , (IV") y (I) es según se define en las reivindicaciones correspondientes.
14. El procedimiento de una de las reivindicaciones 10 a 12, en el que, la etapa (2) es: después de que se proporciona el compuesto de Fórmula (IV) , cuando A y B son ambos alcoxi C1-10 alcoxi, ariloxi o arilalcoxi C1-4, comprendiendo adicionalmente:
hidrolizar el compuesto de Fórmula (IV) para proporcionar un compuesto de Fórmula (V) ;
después se proporciona el compuesto de Fórmula (V) , comprendiendo adicionalmente: 10 ciclar el compuesto de Fórmula (V) para proporcionar un compuesto de Fórmula (VI) ;
después se proporciona el compuesto de Fórmula (VI) , que comprende adicionalmente:
apertura de anillo amonolizando el compuesto de Fórmula (VI) para proporcionar un compuesto de Fórmula (VII) ; después hacer reaccionar el compuesto de Fórmula (VII) en presencia de un agente de condensación para 15 proporcionar el compuesto de Fórmula (I) :
en la que, cada uno de los otros grupos sustituidos en la Fórmula (IV) , (V) , (VI) y (VII) es según se define en la reivindicación 1 o la reivindicación 2.
15. Un procedimiento para sintetizar un compuesto de fórmula (I) , comprendiendo:
en el que; en la Fórmula (I) , el grupo R sustituido es amino, nitro o halógeno y R3, R4 y R5 son todos hidrógeno; Y es: =O; Z es: H; 10 R1 es hidrógeno o metilo;
(1) agitar el siguiente compuesto de Fórmula (II) en presencia de hidróxido de potasio, carbonato de potasio, hidróxido de sodio, carbonato de sodio, hidróxido de cesio o carbonato de cesio durante 5 minutos a 6 horas; añadir el compuesto correspondiente de Fórmula (III) en un sistema de reacción para reacción agitada y una temperatura de reacción es de -20 °C a 80 °C; el tiempo de reacción es 1 hora a 72 horas; para proporcionar el compuesto correspondiente de Fórmula (IV) en la reacción; en estas condiciones: (2) ciclar el compuesto de Fórmula (IV) de la etapa (1) en presencia de amida de litio o amida de sodio o amida de potasio; la temperatura de reacción es de -60 °C a 80 °C; el tiempo de reacción es de 30 minutos a 24 horas; para proporcionar los compuestos correspondientes de Fórmula (I) en la reacción;
alternativamente, ciclar el compuesto de Fórmula (IV) de la etapa (1) en presencia de urea; la temperatura de reacción es de 50 a 250 °C; el tiempo de reacción es de 30 minutos a 24 horas; para proporcionar los compuestos correspondientes de Fórmula (I) en la reacción;
en estas condiciones:
(continuación)
Fórmula Compuesto de Fórmula condiciones Compuesto de Fórmula
N.º (IV) (I)
de
secuencia
7 NH2CONH2
alternativamente, amonolizar el compuesto de Fórmula (IV) de la etapa (1) en una condición alcalina para proporcionar el compuesto monoamida de Fórmula (IV') ; después ciclar el compuesto monoamida de Fórmula (IV') en presencia de terc-butóxido de potasio o de carbonato de potasio para proporcionar el compuesto de Fórmula (I) ; alternativamente 5 continuar amonolizando el compuesto monoamida de Fórmula (IV') para proporcionar compuesto diamida de Fórmula (IV") y después calentar el compuesto de Fórmula (IV") para ciclarse para proporcionar el compuesto de Fórmula (I) ;
dichas condiciones de amonolización están: en presencia de un disolvente orgánico individual o mezcla de dos o más disolventes orgánicos seleccionados de amoniaco/agua, amoniaco/metanol, amoniaco/tetrahidrofurano, amoniaco/dioxano o amoniaco/dimetilformamida; la temperatura de reacción está entre -20 ºC y la temperatura de reflujo; el tiempo de reacción para preparar el compuesto de Fórmula (IV') es de 10 minutos a 18 horas; el tiempo de reacción para producir el compuesto de Fórmula (IV") es de 6 horas a 72 horas;
condiciones de reacción opcionales para ciclar los compuestos de Fórmula (IV') son: en presencia de álcali, se proporcionan por ciclación los compuestos de Fórmula (I) ; cuando dicho álcali es base orgánica metálica, la temperatura de reacción está entre -20 ºC y temperatura de reflujo y el tiempo de reacción es de 10 minutos a 48
horas; cuando dicho álcali es base inorgánica, el disolvente de reacción se selecciona de acetonitrilo y tetrahidrofurano y la temperatura de reacción está entre 30 ºC y temperatura de reflujo;
en estas condiciones: las condiciones de reacción opcionales de síntesis del compuesto de fórmula (I) por ciclación del compuesto de Fórmula (IV") son: en presencia o no de formamida o ácido metanosulfónico, se proporciona por ciclación calentada el compuesto de Fórmula (I) ; la temperatura de reacción opcional es de 0 °C a 250 °C; el tiempo de reacción es de 10 minutos a 12 horas;
en estas condiciones: alternativamente, hidrolizar el compuesto de Fórmula (IV) de la etapa (1) para producir un compuesto de Fórmula (V) , con las condiciones de reacción donde el compuesto de Fórmula (IV) se sitúa en un sistema de mezclas de un disolvente orgánico y agua en proporción opcional y en el sistema alcalino a una temperatura, por reacción agitada se proporciona el compuesto de Fórmula (V) , en el que dicha condición alcalina se selecciona de hidróxido de litio, hidróxido de sodio, carbonato de sodio y carbonato de potasio; dicha temperatura de reacción está entre -20 °C y la temperatura de reflujo; el tiempo de reacción es de 30 minutos a 24 horas:
en estas condiciones:
después de eso, ciclar el compuesto obtenido de Fórmula (V) para proporcionar un compuesto de Fórmula (VI) y con el procedimiento de reacción que rodea en seco una mezcla del compuesto de Fórmula (V) , se agitan anhídrido acético y cantidad catalítica de piridina calentando con agitación y después el reactivo se concentra hasta sequedad para proporcionar el compuesto de Fórmula (VI) , en el que la temperatura de reacción está entre temperatura ambiente y 120 °C y el tiempo de reacción es de 1 minuto a 12 horas;
en estas condiciones: posteriormente, abrir anillo amonolizando el compuesto de Fórmula (VI) para proporcionar un compuesto de Fórmula (VII) , y después ciclar el compuesto de Fórmula (VII) en presencia de un agente de condensación para proporcionar el compuesto de Fórmula (I) ;
en estas condiciones:
16. Un compuesto de Fórmula (IV) o de Fórmula (VI) , que se selecciona a partir de los siguientes compuestos:
Patentes similares o relacionadas:
Derivados de bencimidazol como inhibidores Nav 1.7 (subunidad alfa del canal de sodio, dependiente del voltaje, tipo IX (SCN9A)) para tratar el dolor, la disuria y la esclerosis múltiple, del 22 de Julio de 2020, de Sumitomo Dainippon Pharma Co., Ltd: Un compuesto de fórmula (I): **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, donde R1a, R1b, R1c, y R1d son independientemente hidrógeno, […]
Isotopólogos de 3-(5-amino-2-metil-4-oxoquinazolin-3(4H)-il) piperidina-2-6-diona y métodos de preparación de los mismos, del 15 de Julio de 2020, de CELGENE CORPORATION: Un compuesto de la fórmula: **(Ver fórmula)** o una sal farmacéuticamente aceptable, solvato o hidrato del mismo, en donde: por lo menos uno de Y1,Y2 e Y5 es […]
Inhibidores de btk de tipo nicotinimida sustituida y su preparación y uso en el tratamiento del cáncer, la inflamación y las enfermedades autoinmunitarias, del 15 de Julio de 2020, de Guangzhou InnoCare Pharma Tech Co., Ltd: Un compuesto seleccionado del grupo que consiste en: 6-(1-acriloilpiperidin-4-il)-2-(4-fenoxifenil)nicotinamida; **(Ver fórmula)** 6-(4-acriloilpiperazin-1-il)-2-(4-fenoxifenil)nicotinamida; […]
Derivado de isoindolina, producto intermedio, método de preparación, composición farmacéutica y uso del mismo, del 8 de Julio de 2020, de Kangpu Biopharmaceuticals, Ltd: Un derivado de isoindolina que tiene una estructura de fórmula general (I), una sal, un solvato, un polimorfo, un estereoisómero o un compuesto isotópico farmacéuticamente aceptables […]
Compuestos de 6-heterociclil-4-morfolin-4-ilpiridin-2-ona útiles para el tratamiento del cáncer y la diabetes, del 1 de Julio de 2020, de Sprint Bioscience AB: Un compuesto de la Fórmula (I) **(Ver fórmula)** en donde R1, R2 y R3 se seleccionan independientemente de hidrógeno, haloalquiloC1-C3 […]
Compuestos utilizados como inhibidores de la quinasa reordenada durante la transfección (RET), del 1 de Julio de 2020, de GlaxoSmithKline Intellectual Property Development Limited: Un compuesto de acuerdo con la Fórmula (I), o una sal farmacéuticamente aceptable del mismo: **(Ver fórmula)** en donde: X es N o CR5; Y es un enlace; […]
Nuevos derivados de dihidroisoquinolin-1-ona bicíclicos, del 17 de Junio de 2020, de F. HOFFMANN-LA ROCHE AG: Un compuesto seleccionado de 6-cloro-2-piridin-3-il-3,4-dihidro-2H-isoquinolin-1-ona; 5-(6-cloro-1-oxo-3,4-dihidro-1H-isoquinolin-2-il)-nicotinonitrilo; […]
1-Ciclohexilo-2-fenilaminobenzimidazoles como inhibidores de MIDH1 para el tratamiento de tumores, del 17 de Junio de 2020, de DEUTSCHES KREBSFORSCHUNGSZENTRUM STIFTUNG DES OFFENTLICHEN RECHTS: Un compuesto de fórmula (I) **(Ver fórmula)** en donde: R1 representa un átomo de halógeno o un grupo seleccionado de: C1-C6-alquilo, C1-C6-alcoxi, C1-C6-haloalquilo, […]