Moléculas de reconocimiento específicas de tumor.
Procedimiento para la identificación y/o aislamiento y/o para la obtención de una molécula que lleva el Core-1,
una célula que lleva el Core-1, un virus que lleva el Core-1, una bacteria que lleva el Core-1, o partes de células que llevan el Core-1 mediante la unión a una molécula de reconocimiento específico de Core-1, donde la molécula de reconocimiento comprende una secuencia de amino ácidos que contiene:
(i) la secuencia de amino ácidos SEC ID NO: 1, o una secuencia de amino ácidos que es al menos un 80 % homóloga a la SEC ID Nº: 1; y
(ii) la secuencia de amino ácidos SEC ID Nº: 2 ó 3, o una secuencia de amino ácidos que es al menos un 80 % homóloga a la SEC ID Nº: 2 ó 3; y
(iii) la secuencia de amino ácidos SEC ID Nº: 4, 5 ó 6, o una secuencia de amino ácidos que es al menos un 80 % homóloga a la SEC ID Nº: 4, 5 ó 6;
y que se une específicamente al antígeno Core-1.
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E10012760.
Solicitante: GLYCOTOPE GMBH.
Nacionalidad solicitante: Alemania.
Dirección: ROBERT-RÖSSLE-STRASSE 10 13125 BERLIN ALEMANIA.
Inventor/es: RAVN, PETER, GOLETZ,STEFFEN, DANIELCZYK,ANTJE, KARSTEN,UWE, STAHN,RENATE, ASTRUP CHRISTENSEN,PETER.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K39/00 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53).
- A61K47/48
- A61K51/10 A61K […] › A61K 51/00 Preparaciones que contienen sustancias radioactivas utilizadas para la terapia o para el examen in vivo. › Anticuerpos o inmunoglobulinas; Sus fragmentos.
- C07K16/30 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 16/00 Inmunoglobulinas, p. ej. anticuerpos mono o policlonales. › de células tumorales.
- C12N5/00 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00).
PDF original: ES-2523761_T3.pdf



Fragmento de la descripción:
Moléculas de reconocimiento específicas de tumor
La invención se refiere a procedimientos para la producción e identificación de moléculas, células, virus y bacterias que llevan Core-1. [0002] Las enfermedades tumorales o cancerosas son enfermedades de proliferación celular que describen un aumento circunscrito en el espacio del volumen tisular. En un sentido más amplio, cada hinchazón localizada por edemas, inflamaciones agudas y/o crónicas, una expansión aneurismática o incluso una hinchazón de órganos debido a inflamación es un tumor. En sentido más restringido se consideran enfermedades tumorales sobre todo neoformaciones tisulares como tumefacciones, blastomas y/o neoplasias en forma de un sobrecrecimiento espontáneo, desinhibido de diverso modo, autónomo e irreversible de tejido del propio cuerpo, que está asociado por norma a una pérdida de diferente modalidad de células específicas y funciones tisulares. Es posible sistematizar tumores de acuerdo con su comportamiento biológico, sin embargo, también de acuerdo con una sistemática histogenética o de acuerdo con hallazgos clínicos o anatomopatológicos. [0003] Particularmente en el ámbito clínico puede ser necesario detectar los tumores lo más tempranamente posible e incluso de forma selectiva, ya que una detección temprana y el tratamiento o la retirada posterior garantiza que la proliferación se pueda tratar de forma exitosa sin que se deformen las estructuras orgánicas o los segmentos génicos afectados, pudiéndose evitar adicionalmente la conformación de metástasis. Incluso en las consultas de seguimiento después de un tratamiento de cáncer se tienen que detectar de forma temprana las metástasis más pequeñas para optimizar el tratamiento posterior adicional. Además, para ámbitos amplios de la medicina del trabajo es necesario determinar si un tejido o un órgano muestra una potencial susceptibilidad a cáncer sin que el propio órgano o el tejido ya haya degenerado o se haya transformado. [0004] El método más antiguo y al mismo tiempo más sencillo y en parte incluso todavía usado actualmente con éxito para detectar un tumor es la palpación y la inspección visual. De este modo, por ejemplo, el carcinoma de mama o el carcinoma de próstata se pueden palpar como nódulos. Se pueden detectar ópticamente indicios de cáncer de piel por lunares evidentes por el médico o por el
propio paciente. Otros procedimientos ópticos son, por ejemplo, los métodos de formación de imágenes. En este caso se toman con ayuda de aparatos imágenes del cuerpo, en las que se puede reconocer un tumor. A estos métodos pertenecen, por ejemplo, la radiografía así como la tomografía computerizada (CT) . En este procedimiento se examina el cuerpo con radiación de alta energía, donde las estructuras tisulares degeneradas, debido a la permeabilidad modificada para esta radiación se pueden detectar por comparación con el tejido sano. A menudo, en estos métodos se usan medios de contraste que se inyectan en regiones correspondientes y que aumentan la absorción. Además, el diagnóstico de cáncer es posible mediante ultrasonidos así como por el uso de anticuerpos marcados radiactivamente, donde los antígenos típicos de tumor se unen a los órganos que se tienen que examinar y de este modo hacen detectables los tumores dentro del procedimiento de formación de imágenes. Además de los métodos de formación de imágenes, las pruebas de laboratorio son un medio importante adicional para la detección temprana de cáncer. Se examinan muestras de orina,
sangre o incluso muestras tisulares en relación a anormalidades. Esto puede ser, por ejemplo, una composición modificada de estas muestras, sin embargo, también la presencia de sustancias que normalmente no están presentes o solamente en cantidades reducidas. Estas sustancias se denominan generalmente marcadores tumorales. Se producen por el propio tejido tumoral o se forman 5 como reacción del cuerpo frente al tumor. Se denominan marcadores tumorales, además de las sustancias, también modificaciones celulares, cuyo análisis cualitativo o cuantitativo posibilita una afirmación sobre la presencia, la evolución o un pronóstico de enfermedades malignas. Los marcadores tumorales son la mayoría de las veces sustancias presentes fisiológicamente o modificadas que, frente a condiciones fisiológicas o la expresión normal genotípica/fenotípica en orina, 10 suero u otros líquidos corporales, se pueden detectar con concentración aumentada o reducida o en o sobre células tumorales, donde estas sustancias se sintetizan y/o secretan por el tejido tumoral y se liberan después por la lísis del tumor o se forman como reacción del organismo frente a un tumor. Se ha descrito una pluralidad de marcadores tumorales, cuya utilización se considera razonable particularmente en el cáncer de colon, cáncer de mama, cáncer de ovarios, cáncer de próstata y
testículos y en el carcinoma de pulmón de células pequeñas. A estos marcadores de cáncer pertenecen, por ejemplo el CEA, CA 15-3, CA 125, alfafetoproteína, HCG, el antígeno específico de próstata, la enolasa especifica de neuronas, CA 19-9 y SCC. [0005] Los marcadores mencionados muestran por un aumento en suero o en tejidos o por su presencia como proteínas, lípidos y/o carbohidratos modificados por un lado, por ejemplo (i)
enfermedades inflamatorias, pólipos intestinales, inflamaciones virales, sin embargo, particularmente también (ii) cirrosis, degeneraciones, tumores y metástasis. Una gran parte de estos marcadores consiste en moléculas que comprenden estructuras tanto proteicas como de carbohidratos, en un caso dado, lípidos. Cuanto menor sea el componente proteico y, por lo tanto, cuanto mayor sea el componente de carbohidratos o lípidos de estos marcadores, más difíciles serán de detectar los mismos, por ejemplo, con moléculas de reconocimiento como, por ejemplo, anticuerpos. Hasta ahora, por la inmunización de ratones con ayuda de la tecnología de hibridoma se han producido diferentes anticuerpos contra estructuras de carbohidratos. [0006] El diagnóstico de cáncer con moléculas de reconocimiento presenta varias desventajas. De este modo pueden presentarse determinados marcadores tumorales incluso en enfermedades no carcinógenas, por lo que las moléculas de reconocimiento utilizadas muestran una reacción positiva; además, una no interacción de las moléculas de reconocimiento no significa que no exista una enfermedad tumoral. Una desventaja adicional es que las sustancias de reconocimiento conocidas por norma son inespecíficas. Esto significa que una detección positiva solamente en pocos casos indica un tipo determinado de enfermedad tumoral. Una desventaja adicional muy decisiva de las moléculas de reconocimiento conocidas es, además, que solamente se pueden usar de forma limitada para el control de la evolución del desarrollo de tumores, por ejemplo, después de una cirugía. Esto quiere decir que los marcadores tumorales conocidos por norma no se pueden utilizar para la detección temprana o para el tratamiento posterior, particularmente para la profilaxis. [0007] Además de estas desventajas generales, en moléculas de reconocimiento que se dirigen contra estructuras de carbohidratos se presentan desventajas especiales. La inmunización con antígenos de carbohidratos conduce la mayoría de las veces solamente a una respuesta de IgM
primaria o la respuesta inmune no se produce en absoluto, ya que muchas estructuras de carbohidratos también son autoantígenos. Ya que los carbohidratos son antígenos independientes de células T que no son capaces de provocar un cambio de clase y la maduración asociada por mutaciones somáticas, la respuesta de anticuerpos queda limitada la mayoría de las veces a la clase 5 de IgM. Debido a la interacción generalmente débil y la multivalencia necesaria es difícil, por lo tanto, producir anticuerpos con elevada afinidad. Un problema en anticuerpos contra estructuras de carbohidratos no es solamente la baja afinidad, sino también la especificidad. Es extremadamente difícil producir anticuerpos específicos particularmente contra estructuras de carbohidratos no cargados cortas, alcanzándose una determinada especificidad en muchos casos solamente si la 10 estructura de carbohidratos se ubica sobre un soporte determinado. De este modo, Karsen et al. (1995) Hybridoma 14 (1) , 37-44, describen la especificidad de unión y de epítopo de un anticuerpo monoclonal que se une de forma específica al antígeno de Thomsen-Friedenreich (epítopo Galβ13GaINAc) y, entre otras cosas, es adecuado para la inmunohistoquímica. Frente a esto, por ejemplo el anticuerpo JAA/F11, que se dirige contra Galβ13GaINAc, no solamente reconoce este propio 15 antígeno, sino también GlcNAcβ16GaIβ13-... [Seguir leyendo]
Reivindicaciones:
1. Procedimiento para la identificación y/o aislamiento y/o para la obtención de una molécula que lleva el Core-1, una célula que lleva el Core-1, un virus que lleva el Core-1, una bacteria que lleva el Core-1, o partes de células que llevan el Core-1 mediante la unión a una molécula de reconocimiento específico de Core-1, donde la molécula de reconocimiento comprende una secuencia de amino ácidos que contiene:
(i) la secuencia de amino ácidos SEC ID NO: 1, o una secuencia de amino ácidos que es al menos un 80 % homóloga a la SEC ID Nº : 1; y
(ii) la secuencia de amino ácidos SEC ID Nº : 2 ó 3, o una secuencia de amino ácidos que es al menos un 80 % homóloga a la SEC ID Nº : 2 ó 3; y
(iii) la secuencia de amino ácidos SEC ID Nº : 4, 5 ó 6, o una secuencia de amino ácidos que es al menos un 80 % homóloga a la SEC ID Nº : 4, 5 ó 6; y que se une específicamente al antígeno Core-1.
2. El procedimiento de acuerdo con la reivindicación 1, donde se identifica, aisla y/u obtiene una bacteria que lleva el Core-1.
3. El procedimiento de acuerdo con la reivindicación 1, donde la molécula que lleva el Core-1 se
selecciona del grupo que consiste en glicoproteínas, glicopéptidos y glicolípidos, y donde la parte de célula que lleva el Core-1 se selecciona del grupo que consiste en exosomas y liposomas.
4. El procedimiento de acuerdo con una cualquiera de las reivindicaciones 1 a 3, donde la molécula que lleva el Core-1, la célula que lleva el Core-1, el virus que lleva el Core-1, la bacteria que 25 lleva el Core-1, o la parte de célula que lleva el Core-1 también lleva estructuras de Core-2.
5. El procedimiento de acuerdo con una cualquiera de las reivindicaciones 1 a 4, donde la molécula de reconocimiento comprende además una secuencia de aminoácidos que contiene (i) la secuencia de aminoácidos SEC ID Nº 7 u 8 ó 9, o una secuencia de amino ácidos que 30 es al menos un 80 % homóloga a la SEC ID Nº 7 u 8 ó 9; y
(ii) la secuencia de aminoácidos SEC ID Nº 10 u 11, o una secuencia de amino ácidos que es al menos un 80 % homóloga a la SEC ID Nº 10 u 11; y
(iii) la secuencia de aminoácidos SEC ID Nº 12 ó 13, o una secuencia de amino ácidos que es al menos un 80 % homóloga a la SEC ID Nº 12 ó 13; y 35 se une específicamente al antígeno Core-1.
6. El procedimiento de acuerdo con una cualquiera de las reivindicaciones 1 a 5, donde la secuencia SEC ID Nº 1 se sustituye por una variante estructural canónica equivalente de SEC ID Nº s:14 a 17 y/o al menos una secuencia de las secuencias SEC ID Nº s: 2 ó 3 se sustityue por una variante estructural canónica equivalente de SEC ID Nº s:18 a 27 y/o al menos una secuencia de SEC ID Nº s: 7 a 9 se sustituye por una variante estructural canónica equivalente de SEC ID Nº s: 28 a 45, y
la molécula de reconocimiento se une específicamente al antígeno Core-1.
7. El procedimiento de acuerdo con una cualquiera de las reivindicaciones 1 a 6, donde la molécula de reconocimiento comprende además secuencias flanqueantes, que separan las 5 secuencias de amino ácidos de cada una de ellas, que las incluyen y/o flanquean, donde las secuencias flanqueantes se seleccionan preferentemente del grupo que comprende la superfamilia de las inmunoglobulinas, inhibidores de proteasas, lectinas, proteínas de grupos de hélices y/o lipocalinas, donde las secuencias flanqueantes son preferentemente secuencias flanqueantes de anticuerpo, donde las secuencias flanqueantes de anticuerpo para la molécula fe reconocimiento de acuerdo con la reivindicación 1 son preferentemente secuencias de la cadena pesada variable VH y las secuencias flanqueantes de anticuerpo para las secuencias adicionales de la molécula de reconocimiento de acuerdo con la reivindicación 5 son preferentemente de la cadena ligera variable VL.
8. El procedimiento de acuerdo con una cualquiera de las reivindicaciones 1 a 7, donde la molécula de reconocimiento comprende una combinación de secuencias SEC ID Nº : 46 y 80, o SEC ID Nº : 47 y 81, o SEC ID Nº : 48 y 80, o SEC ID Nº : 50 y 80, o SEC ID Nº : 53 y 82, o SEC ID Nº : 52 y 83, o SEC ID Nº : 55 y 83, o SEC ID Nº : 54 y 80, o SEC ID Nº : 51 y 83, o SEC ID Nº : 49 y 80, o SECID Nº : 56 y 90, o SEC ID Nº : 57 y 90, o SEC ID Nº : 57 y 86, o SEC ID Nº : 58 y 87, o SEC ID Nº : 56 y 91,
o SEC ID Nº : 59 y 91, o SEC ID Nº : 60 y 87, o SEC ID Nº : 61 y 90, o SEC ID Nº : 56 y 88, o SEC ID Nº : 56 y 85, o SEC ID Nº : 59 y 90, o SEC ID Nº : 62 y 90, o SEC ID Nº : 59 y 86, o SEC ID Nº : 74 y 92, o SEC ID Nº : 63 y 87, o SEC ID Nº : 74 y 87, o SEC ID Nº : 74 y 89, o SEC ID Nº : 74 y 85, SEC ID Nº : 64 y 86, o SEC ID Nº : 74 y 86, o SEC ID Nº : 63 y 86, o SEC ID Nº : 65 y 85, o SEC ID Nº : 65 y 86, o SEC ID Nº : 66 y 85, o SEC ID Nº : 67 y 87, o SEC ID Nº : 68 y 86, o SEC ID Nº : 72 y 88, o SEC ID Nº : 69 y
90, o SEC ID Nº : 70 y 90, SEC ID Nº :69 y 92, o SEC ID Nº : 73 y 86, o SEC ID Nº :69 y 89, o SEC ID Nº : 71 y 92, o SEC ID Nº : 56 y 86, o SEC ID Nº : 65 y 92.
9. El procedimiento de acuerdo con una cualquiera de las reivindicaciones 1 a 8, donde la molécula de reconocimiento comprende una cadena pesada variable VH y una cadena ligera variable VL, donde la cadena pesada variable VH y la cadena ligera variable VL están en cadenas polipeptídicas diferentes o donde la cadena pesada variable VH y la cadena ligera variable VL están directamente entre ellas en una proteína de fusión.
10. El procedimiento de acuerdo con una cualquiera de las reivindicaciones 1 a 9, donde la molécula de reconocimiento comprende además el marcador His, el marcador myc, secuencias ricas en lisinas y/o secuencias de multimerización.
11. El procedimiento de acuerdo con una cualquiera de las reivindicaciones 1 a 10, donde la molécula de reconocimiento deriva de una inmunoglobulina. 40
12. El procedimiento de acuerdo con una cualquiera de las reivindicaciones 1 a 11, donde la
molécula de reconocimiento se caracteriza por una o más de las siguientes características:
(i) es un fragmento de anticuerpo de cadena simple, un multicuerpo, un fragmento Fab, una proteína de fusión de un fragmento de anticuerpo con péptidos o proteínas y/o una inmunoglobulina de los isotipos IgG, IgM, IgA, IgE, IgD y/o subclases de los mismos;
(ii) es un anticuerpo o fragmento de anticuerpo murino, quimérico, humanizado o parcialmente humanizado;
(iii) es una IgM sin cadena J.
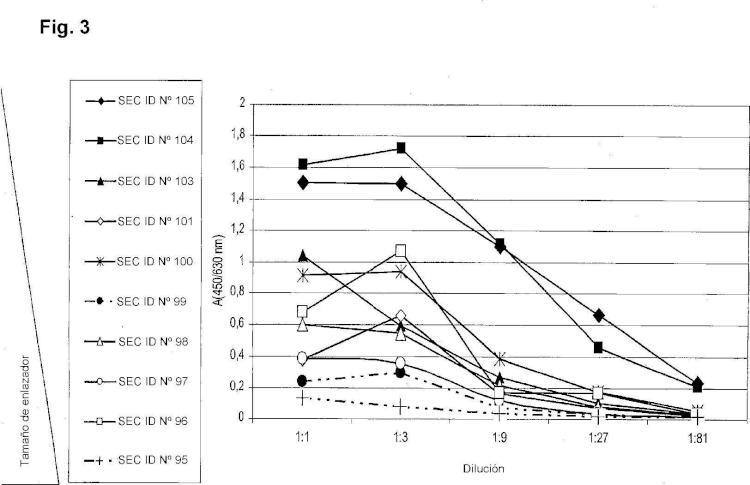
13. El procedimiento de acuerdo con una cualquiera de las reivindicaciones 1 a 12, donde la 10 molécula de reconocimiento comprende una secuencia de acuerdo con las SEC ID Nº 95 a 113.
176
180
181
REFERENCIAS CITADAS EN LA DESCRIPCIÓN
Esta lista de referencias citadas por el solicitante únicamente es para comodidad del lector. Dicha lista no forma parte del documento de patente europea. Aunque se ha tenido gran cuidado en la recopilación de las referencias, no se pueden excluir errores u omisiones y la EPO rechaza toda responsabilidad a este respecto.
Documentos de patentes citados en la descripción EP 03788853 [0151] DE 10256900 [0151]
Patentes similares o relacionadas:
Eliminación de impurezas de cultivos celulares residuales, del 29 de Julio de 2020, de NOVARTIS AG: Un método para eliminar la Proteína Nuclear (NP) de la Gripe de una preparación que comprende proteínas del virus de la gripe de interés que incluyen hemaglutinina […]
 Cepas de Bordetella vivas atenuadas como vacuna de dosis única contra la tos ferina, del 29 de Julio de 2020, de INSTITUT PASTEUR DE LILLE: Una vacuna que comprende una cepa viva, atenuada y mutada de Bordetella pertussis que comprende al menos una mutación del gen (ptx) de la toxina […]
Cepas de Bordetella vivas atenuadas como vacuna de dosis única contra la tos ferina, del 29 de Julio de 2020, de INSTITUT PASTEUR DE LILLE: Una vacuna que comprende una cepa viva, atenuada y mutada de Bordetella pertussis que comprende al menos una mutación del gen (ptx) de la toxina […]
Inmunoterapia novedosa contra diversos tumores, entre ellos tumores cerebrales y neuronales, del 22 de Julio de 2020, de IMMATICS BIOTECHNOLOGIES GMBH: Péptido que comprende una secuencia de aminoácidos acorde con la SEQ ID N.º 19, en que dicho péptido tiene una longitud total de entre 9 y 16 aminoácidos.
Método para producir inmunoconjugados de anticuerpo-SN-38 con un enlazador CL2A, del 22 de Julio de 2020, de IMMUNOMEDICS, INC.: Un método para producir un compuesto, CL2A-SN-38, que presenta la estructura, **(Ver fórmula)** que comprende realizar un esquema de reacción como el que se muestra: **(Ver […]
Composición de vacuna que contiene un adyuvante sintético, del 22 de Julio de 2020, de INFECTIOUS DISEASE RESEARCH INSTITUTE: Una composición farmacéutica que comprende: un adyuvante lípido de glucopiranosilo (GLA), que tiene la fórmula: **(Ver fórmula)** en la que: […]
Arenavirus trisegmentados como vectores de vacunas, del 22 de Julio de 2020, de UNIVERSITE DE GENEVE: Una partícula de arenavirus trisegmentada infecciosa y competente para la replicación que comprende un segmento L y dos segmentos S, en donde uno de los dos segmentos […]
Polipéptidos biparatópicos antagonistas de la señalización WNT en células tumorales, del 15 de Julio de 2020, de Boehringer Ingelheim International GmbH & Co. KG: Un polipéptido que se une específicamente a LRP5 o LRP6, que comprende - un primer dominio variable individual de inmunoglobulina seleccionado del grupo de dominios […]
Anticuerpos del OPGL, del 15 de Julio de 2020, de AMGEN FREMONT INC.: Un anticuerpo, que comprende una cadena pesada y una cadena ligera, donde: a) la cadena pesada comprende: 1) una secuencia de aminoácidos recogida […]