Método para monitorizar las respuestas de linfocitos T citotóxicos (LTC) mediante una reacción de hipersensibilidad de tipo retardado usando epítopos de LTC definidos.
Método para monitorizar las respuestas de linfocitos T citotóxicos (LTC) mediante una reacción de hipersensibilidad de tipo retardado usando epítopos de LTC definidos.
La presente invención se refiere a un método in vivo para monitorizar las repuestas de linfocitos T citotóxicos (LTC) induciendo una reacción de hipersensibilidad de tipo retardado (DTH) usando epítopos de LTC definidos. Se refiere además a los epítopos y sus kits.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2012/067794.
Solicitante: LABORATORIOS DEL DR. ESTEVE, S.A..
Nacionalidad solicitante: España.
Inventor/es: BRANDER,Christian, RUIZ RIOL,Marta.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K39/145 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Orthomyxoviridae, p. ej. virus de la influenza.
- A61K39/21 A61K 39/00 […] › Retroviridae, p. ej. virus de la anemia infecciosa equina.
- A61K49/00 A61K […] › Preparaciones para examen in vivo.
- C07K4/02 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 4/00 Péptidos con hasta 20 aminoácidos en una secuencia indeterminada o sólo parcialmente determinada; Sus derivados. › de virus.
PDF original: ES-2490915_A2.pdf


Fragmento de la descripción:
CAMPO DE LA INVENCIÓN
La presente invención se refiere a un método in vivo para monitorizar las respuestas de linfocitos T citotóxicos (LTC) induciendo una reacción de hipersensibilidad de tipo retardado (DTH) usando epítopos de LTC definidos. La invención también se refiere a un kit que contiene dichos epítopos de LTC definidos.
ANTECEDENTES DE LA INVENCIÓN
Los ensayos de seguimiento inmunitario sencillos y precisos que miden la(s) función(es) efectora(s) fisiológicamente relevantes de respuestas de células T y B inducidas por vacunas son un prerrequisito para el desarrollo eficaz de vacunas contra VIH. Sin embargo, el diseño de tales ensayos está dificultado por la ausencia de correlaciones inmunitarias bien definidas del control vírico en sujetos con VIH y otros asuntos. Véase, Prado J, et al., Curr. Med. Chem. 211; 18(26):3963-397. El desarrollo con éxito de tales planteamientos de monitorización inmunitaria se beneficiaría también de un entendimiento mejorado sobre cómo las células reactivas median sus efectos in vivo y cuáles de sus muchas funciones efectoras pueden estar más estrechamente unidas a su eficacia in vivo. En los ensayos de vacunas actuales, se emplean intensivos ensayos de laboratorio ex vivo e in vitro para medir la inmunidad de células T inducidas por la vacuna. Estos incluyen análisis por citometría de flujo que evalúan la producción de citoquinas y la capacidad de desgranulación, el potencial de las células para inhibir la replicación vírica in vitro, y ensayos ELISpot que permiten probar grandes números de antígenos, a pesar de su foco muy limitado. Véase, Koup R, et al., PLoS One 21; 5(2):e915 y Yang O, et al., Trends Immunol. 23; 24(2):67-72. Ninguno de estos ensayos ha definido inequívocamente marcadores de un control inmunitario durable en sujetos crónicamente infectados por VIH. Mientras que varios ensayos (por ejemplo, ELISpot de citoquina única, detección por citometría de flujo de la producción intracelular de citoquinas) se puede usar para evaluar la magnitud y amplitud de las respuestas inducidas por la vacuna, es improbable que muestren las funciones efectoras que son cruciales para una respuesta eficaz in vivo. Por tanto, se necesita desarrollar ensayos alternativos, que midan de los efectos antivíricos más directamente o evaluando la funcionalidad de las células efectoras. Para grandes ensayos de eficacia de vacunas, también se necesita que tales ensayos sean aplicables en marcos
de pocos recursos, sin infraestructura extensa, y que mantengan su sensibilidad y especificidad.
Las respuestas inmunitarias a algunas vacunas se prueban midiendo las reacciones cutáneas a la exposición intradérmica de antígenos, lo que permite evaluar la inmunocompetencia a agentes infecciosos después de infecciones o inmunizaciones previas. Véase, Birx D, et al., J. Acquir. Immune Defic. Syndr. 1993; 6(11): 1248-1257, Palmer D, etal., J. Infect. Dis. 1974; 13(2): 138-143, y Palmer D, et al., J. Infect. Dis. 1974; 13(2): 132-137. Las reacciones de hipersensibilidad de tipo retardado (DTH) se manifiestan clínicamente como un área de induración y eritema alrededor del sitio de inyección del antígeno y que se vuelve visible generalmente a las 24-72 horas después de la inyección del antígeno. El infiltrado celular local está dominado por macrófagos y linfocitos T, comúnmente asociados con perfil de citoquinas Th1. Como la inducción de reacción de DTH generalmente se dirige hacia la detección de inmunidad mediada por células T CD4, no existe una prueba similar ampliamente usada y sencilla para evaluar específicamente la presencia de células T citotóxicas CD8. Véase, Hladik F, et al., J. Immunol. 21; 166(5):358-3588. Sin embargo, cuando se han inyectado en ratones péptidos bien caracterizados con epítopos restringidos a MHC de clase I, se han observado infiltrados intradérmicos de células T CD4+ y CD8+, lo que sugiere que epítopos de células T CD8 cortos, óptimamente definidos, también podrían provocar tales respuestas DTH por sí mismos. Véase, Kundig T, et al., Proc. Nati. Acad. Sci. USA 1992; 89(16):7757-7761. En efecto, la inyección de epítopos derivados de cáncer en la piel de receptores de vacunas contra el cáncer mostró la presencia de células T CD8 específicas de antígenos CD8, lo que indica que al menos las respuestas inducidas por vacunas a autoantígenos se pueden detectar por medio de reacciones DTH. Véase, Chen Q, et al., Cáncer Immun. 25; 5:5. Además, se considera que las reacciones alérgicas a la penicilina y sus derivados están mediadas en gran parte por células T CD8 que reaccionan a los epítopos de clase I haptenizados y que también provocan una reacción DTH tras la administración intradérmica de penicilina. Véase, Brander C, et al., J. Immunol. 1995; 155(5):267-2678. Sin embargo, no hay datos en seres humanos donde se haya probado el potencial de epítopos de LTC definidos de diferentes virus para inducir reacciones DTH y que habrían unido la reactividad DTH al control vírico in vivo relativo.
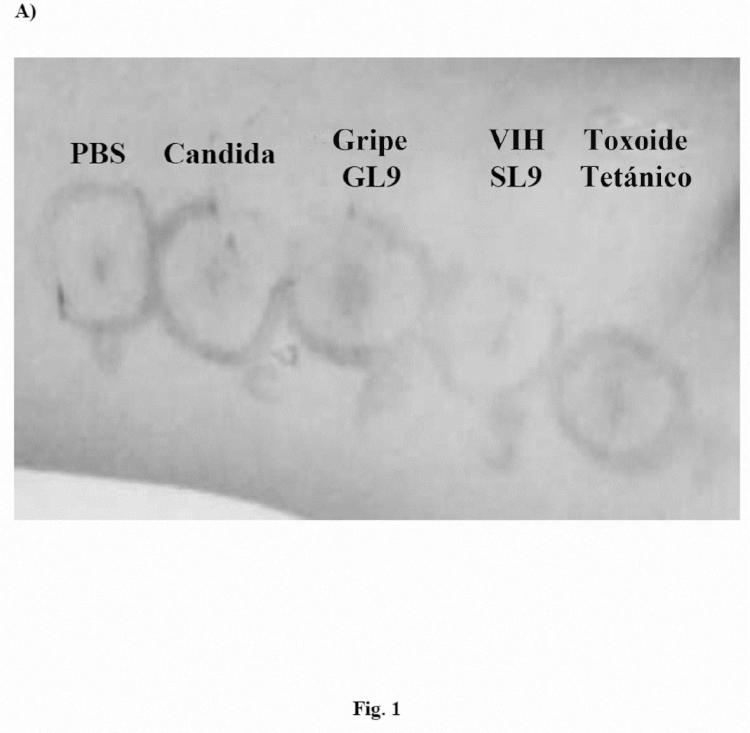
FIGURAS Figura 1. A) Ejemplo representativo de respuesta DTH 72h después de la administración intradérmica de PBS, Candida, péptido del virus de la gripe GL9, péptido de VIH SL9 y toxoide tetánico (TT). B) Se muestra el grado de DTH (determinado como el diámetro de la induración (mm)) para todos los sujetos que expresan HLA-A2 incluidos en el
estudio. Los símbolos negros indican sujetos sin infectar con VIH, los símbolos blancos representan los pacientes infectados con VIH.
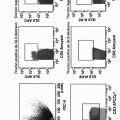
Figura 2. A) Ejemplo representativo de la estrategia de separación con tinción positiva (medio) y negativa (derecha) con dextrámero para poblaciones de células T específicas de SL9 y GL9. B) Porcentajes de células positivas CD3CD8SL9 y CD3CD8GL9 que expresan los marcadores de maduración CCR7 y CD45RA. Las células indiferenciadas se definen como CCR7+CD45RAh'9h, las células de memoria centrales (CM) como CCR7+CD45RA-, las células de memoria efectoras (EM) como CCR7A- y las células de memoria efectoras terminalmente diferenciadas (EMRA) como CCR7-CD45RAh'9h. El panel de la derecha muestra la comparación directa de la frecuencia de células de memoria centrales entre células positivas para SL9 y GL9. C) Nivel de expresión de CD27 expresada en subconjuntos de células T específicas para SL9 y GL9. Se indica la intensidad de fluorescencia media (IFM), con foco especial en las células de memoria efectoras terminalmente diferenciadas a mano derecha.
Figura 3. A) Diferencias en la expresión de CLA entre poblaciones específicas de epítopos, mostradas como porcentajes de todas las células específicas de epítopos (paneles izquierdos) y niveles de IFM (paneles derechos Y) para los tiempos tanto de antes de la inyección del epítopo como para las 72 horas después de la inyección. B) Nivel de expresión de CD13 en células específicas de epítopo mostrado como intensidad de fluorescencia media (IFM) en los tiempos de antes de la inyección del epítopo y 72 horas después de la inyección. El porcentaje de células positivas no se muestra ya que no se diferenció entre LTC específicos de epítopo (valor de p: ,7622 Mann-Whitney). C) Expresión de BLT1 (paneles izquierdos) y CXCR1 (paneles derechos) entre LTC específicos de epítopos mostrada como porcentaje de células con niveles de expresión en superficie detectable, en los tiempos tanto de antes de la inyección del epítopo como 72 horas después de la inyección.
COMPENDIO DE LA INVENCIÓN La presente invención se refiere a un método in vivo para monitorizar la respuesta de linfocitos T citotóxicos (LTC) contra un virus en un sujeto. El método comprende los pasos de i) administrar un epítopo restringido a HLA-A2 de un antígeno vírico al sujeto, y ii) determinar si se produce una reacción DTH cutánea, en donde una reacción DTH positiva es indicativa de que el sujeto puede montar una respuesta de LTC eficaz contra el virus. El método implica administrar el epítopo antigénico por vía intradérmica al sujeto y observar si se produce induración y eritema después de 48-72 horas tras la inyección. Una respuesta positiva significa que el sujeto se ha expuesto al antígeno al menos de 4 a 6 semanas antes de la administración y que su mecanismo de inmunidad
celular es eficaz en reconocer y responder al antígeno. La falta de una respuesta de DTH al antígeno se debe considerar como una evidencia de anergia. En ausencia de enfermedades subyacentes, la anergia puede indicar inmunodeficiencia primaria o secundaria de células T.
En un segundo aspecto, la invención se refiere a un kit o composición que comprende un epítopo restringido a HLA-A2 de la invención para ensayar la respuesta inmunitaria de LTC en un sujeto.
DESCRIPCIÓN DETALLADA DE LA INVENCIÓN... [Seguir leyendo]
Reivindicaciones:
1. Uso de un péptido restringido a HLA-de un antígeno de un virus de la gripe o del HIV, para la fabricación de un producto diagnóstico para determinar si un sujeto puede
montar una respuesta de linfocitos T citotóxicos (LTC) eficaz contra dicho virus, en
donde la determinación de dicha respuesta comprende determinar si se produce una reacción de hipersensibilidad de tipo retardado.
2. El uso de la reivindicación 1, en donde el péptido restringido a HLA-A2 es un péptido
seleccionado del grupo que consiste en SEQ ID NO: 1-SEQ ID NO: 4.
3. El uso de la reivindicación 2, en donde el péptido restringido a HLA-A2 es SEQ ID NO. 1.
4. El uso de cualquiera de las reivindicaciones 1 a 3 en donde el péptido se administra
sin adyuvante.
5. El uso de cualquiera de las reivindicaciones 1 a 4 en donde el péptido se administra por vía intradérmica.
6. El uso de cualquiera de las reivindicaciones 1 a 5 en donde el sujeto ha sido infectado previamente por el virus y/o inmunizado con un inmunógeno que comprende el antígeno vírico.
7. El uso de cualquiera de las reivindicaciones 1 a 6 en donde la determinación de la
reacción de hipersensibilidad de tipo retardado (DTH) comprende determinar la aparición de una reacción DTH cutánea.
8. El uso de la reivindicación 7 en donde la reacción DTH cutánea se determina
determinando la presencia de induración y/o eritema en un área que rodea un sitio de
exposición al antígeno.
9. El uso de cualquiera de las reivindicaciones 1 a 6 en donde la determinación de la reacción de hipersensibilidad de tipo retardado (DTH) comprende determinar el
aumento en el número de LTC específicos de epítopo CLA+ y/o el aumento en el
número de LTC específicos de epítopo CD13+.
1. El uso como en cualquiera de las reivindicaciones 1 a 9, en donde el sujeto es humano.
11. Uso de un péptido restringido a HLA-A2 de un antígeno del virus de la gripe o del HIV, para la fabricación de un producto diagnóstico para determinar una infección por dicho virus, en donde la determinación de dicha infección comprende determinar si se produce una reacción de hipersensibilidad de tipo retardado (DHT).
12. El uso de la reivindicación 11, en donde el péptido restringido a HLA-A2 es seleccionado del grupo que consiste en las SEQ ID NO: 1-SEQ ID NO: 4.
13. El uso de la reivindicación 12, en donde el péptido restringido a HLA-A2 es un epítopo del virus de la gripe y la infección que se va a diagnosticar es una infección por el virus de la gripe.
14. El uso de la reivindicación 13, en donde el péptido restringido a HLA-A2 es SEQ ID NO. 1.
15. El uso según cualquiera de las reivindicaciones 11 a 14 en donde el péptido se administra sin adyuvante.
16. El uso según cualquiera de las reivindicaciones 11 a 15 en donde el péptido se administra por vía intradérmica.
17. El uso de cualquiera de las reivindicaciones 11 a 16 en donde la determinación de la reacción de hipersensibilidad de tipo retardado (DTH) comprende determinar la aparición de una reacción DTH cutánea.
18. El uso de la reivindicación 17 en donde la reacción DTH cutánea se determina por la presencia de induración y/o eritema en un área que rodea un sitio de exposición al antígeno.
19. El uso de cualquiera de las reivindicaciones 11 a 18 en donde la determinación de la reacción de hipersensibilidad de tipo retardado (DTH) comprende determinar el
aumento en el número de LTC específicos de epítopo CLA+ y/o el aumento en el número de LTC específicos de epítopo CD13+.
2. El uso de cualquiera de las reivindicaciones 11 a 19, en donde el sujeto es humano.
21. Un péptido que comprende el epítopo restringido a HLA-A2 de SEQ ID NO. 1.
22. Un kit que comprende el péptido de la reivindicación 21.
Patentes similares o relacionadas:
Régimen de glicosidasa para el tratamiento de enfermedades infecciosas, del 15 de Abril de 2020, de Kline, Ellis: Una composición de glicosidasa de señalización inmunológica para uso en el tratamiento de un paciente que tiene una infección viral crónica, en donde un régimen […]
 Inmunógenos de anticuerpos ampliamente neutralizantes del VIH-1, métodos de generación y usos de los mismos, del 25 de Marzo de 2020, de INTERNATIONAL AIDS VACCINE INITIATIVE: Un inmunógeno 10E8 que consiste en la secuencia de aminoácidos:
**(Ver fórmula)**
Inmunógenos de anticuerpos ampliamente neutralizantes del VIH-1, métodos de generación y usos de los mismos, del 25 de Marzo de 2020, de INTERNATIONAL AIDS VACCINE INITIATIVE: Un inmunógeno 10E8 que consiste en la secuencia de aminoácidos:
**(Ver fórmula)**
Vacuna de trímero de Env VIH-1 bioquímicamente estabilizado, del 25 de Diciembre de 2019, de CHILDREN'S MEDICAL CENTER CORPORATION: Un trímero de gp140 de VIH que comprende un polipéptido gp140 de VIH que comprende una secuencia de aminoácidos al menos 95% idéntica a la secuencia: **(Ver secuencia)** […]
Tratamiento de trastornos inflamatorios, autoinmunitarios y neurodegenerativos con polipéptidos derivados de Tat inmunosupresores, del 4 de Septiembre de 2019, de PIN Pharma, Inc: Un polipéptido derivado del trans-activador de la transcripción (Tat) inmunosupresor, comprendiendo el polipéptido derivado de Tat una secuencia de aminoácidos que […]
Vectores víricos Isfahan recombinantes, del 10 de Julio de 2019, de THE BOARD OF REGENTS OF THE UNIVERSITY OF TEXAS SYSTEM: Un virus Isfahan competente en replicación, recombinante que comprende un gen de proteína N que codifica una proteína N que tiene una secuencia de aminoácidos […]
Procedimiento novedoso y composiciones, del 12 de Junio de 2019, de GLAXOSMITHKLINE BIOLOGICALS S.A.: Uno o más primeros polipéptidos inmunógenos para su uso en un procedimiento de generación de una respuesta inmunológica frente a Mycobacterium spp., en los […]
Vectores y construcciones de liberación de antígenos de virus de la gripe, del 8 de Mayo de 2019, de ALTIMMUNE UK LIMITED: Una construcción de vector fluorocarbonado-antígeno de estructura CmFN--CyHx-(Sp)-R, donde m = 3 a 30, n <= 2m + 1, y = 0 a 15, x <= 2y, […]
Vectores de transferencia de gen lentivírico y sus aplicaciones medicinales, del 11 de Abril de 2019, de INSTITUT PASTEUR: Una combinación de compuestos para su uso en el tratamiento terapéutico o profiláctico de una infección por un Virus de la Inmunodeficiencia en donde los […]