Composiciones y procedimientos para el tratamiento y prevención de afecciones fibróticas, inflamatorias y de neovascularización.
Un anticuerpo monoclonal humanizado, o un fragmento, variante o derivado del mismo,
que se une y neutraliza unlípido bioactivo o precursor o metabolito de lípido bioactivo, en el que el lípido bioactivo, el precursor o metabolito delípido bioactivo es esfingosina-1-fosfato (S1P) o un precursor o metabolito de S1P, para usar en un procedimientopara disminuir la concentración eficaz de dicho lípido bioactivo en un ojo de un animal con el fin de
(i) tratar o prevenir la fibrogénesis aberrante, fibrosis o cicatrización en el ojo,
(ii) modular las respuestas de cicatrización de heridas quirúrgica o traumática en el ojo,
(iii) disminuir o prevenir la inflamación en el ojo,
(iv) disminuir o prevenir la neovascularización aberrante del ojo,
(v) atenuar una respuesta inmunitaria ocular en el ojo, o
(vi) disminuir la concentración ocular eficaz o la actividad del lípido bioactivo, el precursor o metabolito del lípidobioactivo con el fin de tratar o prevenir una enfermedad o afección ocular que se caracteriza, al menos en parte,por fibrogénesis aberrante, fibrosis, cicatrización, inflamación, neovascularización aberrante o una respuestainmunitaria en el ojo.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2006/042027.
Solicitante: Lpath, Inc.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 4025 Sorrento Valley Blvd. San Diego, CA 92121 ESTADOS UNIDOS DE AMERICA.
Inventor/es: GARLAND, WILLIAM, A., SABBADINI,ROGER A, STOLLER,GLENN L.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K39/395 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Anticuerpos (aglutininas A61K 38/36 ); Inmunoglobulinas; Inmunosuero, p. ej. suero antilinfocitario.
- C07K16/00 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › Inmunoglobulinas, p. ej. anticuerpos mono o policlonales.
- C12P21/08 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12P PROCESOS DE FERMENTACION O PROCESOS QUE UTILIZAN ENZIMAS PARA LA SINTESIS DE UN COMPUESTO QUIMICO DADO O DE UNA COMPOSICION DADA, O PARA LA SEPARACION DE ISOMEROS OPTICOS A PARTIR DE UNA MEZCLA RACEMICA. › C12P 21/00 Preparación de péptidos o de proteínas (proteína monocelular C12N 1/00). › Anticuerpos monoclonales.
PDF original: ES-2398919_T3.pdf
Fragmento de la descripción:
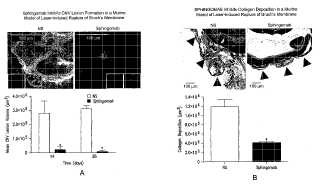
Composiciones y procedimientos para el tratamiento y prevención de afecciones fibróticas, inflamatorias y de neovascularización Campo de la técnica En el presente documento se divulgan procedimientos de tratamientos para trastornos oculares usando restos derivados de inmunitarios que son reactivos contra moléculas lipídicas bioactivas que desempeñan un papel en la enfermedad humana y/o animal como moléculas de señalización. Una clase concreta de lípidos bioactivos de señalización considerados de acuerdo con la presente divulgación es la de los lisolípidos. Lisolípidos de señalización particularmente preferidos son la esfingosina-1-fosfato (S1P) y los diversos ácidos lisofosfatídicos (LPA) . Los anticuerpos contra lípidos de señalización, y derivados y variantes de los mismos, se pueden usar en el tratamiento y/o prevención de enfermedades o trastornos oculares a través de la liberación de composiciones farmacéuticas que contienen dichos anticuerpos, solos o en combinación con otros agentes terapéuticos y/o tratamientos.
Antecedentes de la invención I. Introducción La descripción siguiente incluye información que puede ser útil para la comprensión de la presente invención. No es una admisión de que algo de esta información sea técnica anterior, o relevante a ella, de las invenciones reivindicadas en el presente documento, o que ninguna publicación a la que se haga referencia específica o implícitamente sea técnica anterior o incluso particularmente relevante a la invención reivindicada en el presente documento.
II. Antecedentes La presente invención se refiere a procedimientos de disminución o atenuación de neovascularización aberrante, angiogénesis, fibrogénesis aberrante, fibrosis y cicatrización, e inflamación y respuestas inmunitarias. Estos procesos, por separado o juntos, están implicados en muchas enfermedades y afecciones. Estas enfermedades o afecciones pueden ser sistémicas o pueden estar relativamente localizadas, por ejemplo en la piel o el ojo.
A. Enfermedades y afecciones oculares La angiogénesis/neovascularización patológica o aberrante, el remodelado aberrante, la fibrosis y cicatrización y la inflamación se producen asociadas con enfermedades isquémicas retinianas y oculares tales como la degeneración macular relacionada con la edad (DME) , la retinopatía diabética (RD) y la retinopatía de los prematuros (RDP) y otros trastornos del desarrollo [Eichler y col., (2006) , Curr Pharm Des, vol 12: 2645-60] además de ser el resultado de infecciones y lesiones mecánicas en el ojo [Ciulla y col., (2001) , Curr Opin Ophthalmol, vol 12: 442-9 y Dart y col., (2003) , Eye, vol 17: 886-92].
La angiogénesis ocular patológica es una causa principal de ceguera en diversas afecciones clínicas. La neovascularización coroidea (NVC) se produce en varias enfermedades oculares, siendo la más prevalente de ellas la forma exudativa o “húmeda” de la DME. Como resultado de una población cada vez más envejecida, la DME es una epidemia de estos días y la causa principal de ceguera en el mundo occidental en pacientes mayores de 60 años de edad. A pesar de la epidemia de pérdida de visión causada por la DME, sólo unas pocas terapias, principalmente a base de anti-VEGF, pueden ralentizar la progresión de la DME y todavía menos pueden invertir la pérdida de visión [Bylsma y Guymer (2005) , Clin Exp Optom, . vol 88: 322-34, Gr y ziewicz (2005) , Adv Drug Deliv Rev, vol 57: 2092-8 y Liu y Regillo (2004) , Curr Opin Ophthalmol, vol 15: 221-6.]. Por tanto, el descubrimiento de nuevos tratamientos para la neovascularización patológica es extremadamente importante.
En el presente documento, la DME se usa únicamente con fines ilustrativos en la descripción de afecciones oculares relacionadas con angiogénesis/neovascularización aberrante, remodelado aberrante, fibrosis y cicatrización, e inflamación, afecciones que se encuentran en otras enfermedades y trastornos oculares como se divulga y reivindica en el presente documento. La DME implica cambios patológicos relacionados con la edad [Tezel, Bora y Kaplan (2004) , Trends Mol Med, vol 10: 417-20 y Zarbin (2004) , Arch Ophthalmol, 122: 598-614]. Existen múltiples teorías pero la etiología y patogenia exactas de la DME todavía no se conocen bien. El envejecimiento se asocia con lesiones oxidativas acumuladas, engrosamiento de la membrana de Bruch y formación de drusas. La tensión oxidativa tiene como resultado lesiones en las células epiteliales pigmentarias de la retina (EPR) y, en algunos casos, en la lámina coriocapilar [Zarbin (2004) , Arch Ophthalmol, vol 122: 598-614 y Gorin y col., (1999) , Mol Vis, . vol 5: 29]. Probablemente, las lesiones en el EPR provoquen una respuesta inflamatoria crónica dentro de la membrana de Bruch y en la coroides [Johnson y col. (2000) , Exp Eye Res, . vol 70: 441-9]. Esta lesión e inflamación fomenta y potencia los daños en la retina al estimular NVC y atrofia [Zarbin (2004) , Arch Ophthalmol, vol 122: 598614 y Witmer y col., (2003) , Prog Retin Eye Res, vol 22: 1-29]. La NVC tiene como resultado vasos sanguíneos (VS) defectuosos y con fugas que probablemente sean reconocidos como heridas [Kent y Sheridan (2003) , Mol Vis, vol 9: 747-55]. La cicatrización de las heridas comienza en la coroides e invade el espacio subretiniano a través de la membrana de Bruch y el EPR. Las respuestas de cicatrización de heridas se caracterizan por una típica respuesta
de inflamación precoz, una prominente respuesta angiogénica y formación de tejido, seguidas de la maduración terminal de todos los elementos implicados. El remodelado de heridas puede comprometer de forma irreversible a los fotorreceptores y los EPR, justificando de este modo la necesidad de tratar la NVC con algo más que terapias antiangiogénicas [La Cour, Kiilgaard y Nissen (2002) , Drugs Aging, vol 19: 101-33.12].
Las alteraciones en la arquitectura retiniana y subretiniana normal como resultado de fibrosis relacionada con NVC, edema e inflamación individualmente o de forma acumulada, conducen a pérdida de visión relacionada con la DME [Tezel y Kaplan (2004) , Trends Mol Med, vol 10: 417-20 y Ambati y col., (2003) , Surv Ophthalmol, vol 48: 257-93]. Las múltiples interacciones celulares y de las citocinas que están asociadas con la DME exudativa complican considerablemente la búsqueda de tratamientos eficaces. Aunque la NVC y el edema se pueden tratar en parte con terapéuticas anti-VEGF, no se han abordado adecuadamente los posibles tratamientos para mitigar la formación de cicatrices y la inflamación [Bylsma y Guymer (2005) , Clin Exp Optom, vol 88: 322-34 y Pauleikhoff (2005) , Retina, vol
25: 1065-84]. Siempre que el complejo neovascular permanezca intacto, como parece ser el caso en pacientes tratados con agentes anti-VEGF, el potencial de fibrosis subretiniana y futura pérdida de visión persiste.
Las terapias anti-VEGF-A representan un reciente avance significativo en el tratamiento de la DME exudativa. No obstante, en el ensayo de fase III VISION con PEGAPTANIB, un aptámero de alta afinidad que inhibe de forma selectiva la isoforma 165 de VEGFA, se demostró que el paciente medio sigue perdiendo visión y solo un pequeño porcentaje ha ganado visión [Gragoudas y col., (2004) , N Engl J Med, vol 351: 2805-16]. La inhibición de todas las isoformas de VEGF-A (inhibición de pan-VEGF) con el fragmento de anticuerpo RANIBIZUMAB dio resultados mucho más impresionantes [Brown y col., N Eng Med, 2006 355:1432-44, Rosenfeld y col., N Eng J Med 2006355:1419-31]. En el ensayo de 2 años de duración MARINA y el ANCHOR de 1 año de duración se demostró que aproximadamente el 40 % de los pacientes alcanza alguna ganancia de visión. Aunque estos resultados representan un gran avance en nuestra capacidad para tratar la DME exudativa, también demuestran que en el 60 % de los pacientes no mejora la visión. Adicionalmente, estos pacientes tenían que cumplir unos criterios de inclusión y de exclusión estrictamente definidos. Los resultados en una población más amplia de pacientes pueden ser menos sólidos.
Todavía existe la necesidad bien definida de desarrollar otros agentes terapéuticos dirigidos a otras etapas en el desarrollo de la NVC y los procesos que conducen en última instancia a la destrucción de fotorreceptores. En primer lugar, el crecimiento de VS coroideos implica una interacción orquestada entre muchos mediadores, no solo el VEGF, lo que ofrece la oportunidad de modular o inhibir la totalidad del proceso [Gragoudas y col., (2004) , N Engl J Med, vol 351: 2805-16]. En segundo lugar, la MDE comprende componentes vasculares y extravasculares. El componente vascular implica células endoteliales vasculares (CE) , precursores de CE y pericitos. El componente extravascular,... [Seguir leyendo]
Reivindicaciones:
1. Un anticuerpo monoclonal humanizado, o un fragmento, variante o derivado del mismo, que se une y neutraliza un lípido bioactivo o precursor o metabolito de lípido bioactivo, en el que el lípido bioactivo, el precursor o metabolito de lípido bioactivo es esfingosina-1-fosfato (S1P) o un precursor o metabolito de S1P, para usar en un procedimiento para disminuir la concentración eficaz de dicho lípido bioactivo en un ojo de un animal con el fin de
(i) tratar o prevenir la fibrogénesis aberrante, fibrosis o cicatrización en el ojo,
(ii) modular las respuestas de cicatrización de heridas quirúrgica o traumática en el ojo,
(iii) disminuir o prevenir la inflamación en el ojo,
(iv) disminuir o prevenir la neovascularización aberrante del ojo,
(v) atenuar una respuesta inmunitaria ocular en el ojo, o
(vi) disminuir la concentración ocular eficaz o la actividad del lípido bioactivo, el precursor o metabolito del lípido bioactivo con el fin de tratar o prevenir una enfermedad o afección ocular que se caracteriza, al menos en parte, por fibrogénesis aberrante, fibrosis, cicatrización, inflamación, neovascularización aberrante o una respuesta inmunitaria en el ojo.
2. Un anticuerpo monoclonal humanizado, o un fragmento, variante o derivado del mismo, como se define en la reivindicación 1, en el que el animal es un ser humano.
3. Un anticuerpo monoclonal humanizado, o fragmento, variante o derivado del mismo como se define en la reivindicación 1 para usar de acuerdo con la reivindicación 1, en el que (i) la enfermedad o afección ocular caracterizada, al menos en parte, por neovascularización aberrante se selecciona del grupo que consiste en degeneración macula relacionada con la edad, retinopatía diabética, retinopatía del prematuro, rechazo de injerto corneano, glaucoma neovascular, sobredesgaste por lentes de contacto, infecciones de la córnea, incluida la infección por herpes simple, infección por herpes zoster e infección por protozoos; pterigión, retinopatía isquémica, enfermedad venooclusiva retiniana, uveítis infecciosa, desprendimiento crónico de retina, lesión por láser, retinopatía por drepanocitosis, enfermedad venooclusiva, neovascularización coroidea, proliferación angiomatosa retiniana y vasculopatía coroidea polipoidal idiopática; o (ii) la enfermedad o afección ocular caracterizada, al menos en parte, por fibrogénesis o fibrosis o cicatrización aberrante se selecciona del grupo que consiste en degeneración macular relacionada con la edad, retinopatía diabética, retinopatía del prematuro, retinopatía por drepanocitosis, retinopatías isquémicas, enfermedad venooclusiva retiniana, arruga macular, retinopatía en celofán, formación de MER, sobredesgaste por lente de contacto, desprendimiento de retina por tracción, vitreoretinoptía proliferativa, lesión traumática, penfigoide cicatricial ocular, síndrome de Stevens Johnson, necrólisis epidérmica tóxica, pterigión y consecuencias de la cirugía ocular, incluida la cirugía refractaria, vitrectomía y cirugía de glaucoma.
4. Un anticuerpo monoclonal humanizado, o fragmento, variante o derivado del mismo como se define en la reivindicación 1 para usar de acuerdo con la reivindicación 1, en el que la enfermedad o afección ocular es una afección inflamatoria o inmunológica, opcionalmente una afección inflamatoria o inmunológica seleccionada del grupo que consiste en degeneración macular relacionada con la edad, uveítis, vitritis, infecciones, incluida la infección por herpes simple, infección por herpes zoster e infección por protozoos; rechazo de injerto corneado e histoplasmosis ocular.
5. Un anticuerpo monoclonal humanizado, o fragmento, variante o derivado del mismo como se define en la reivindicación 1 para usar de acuerdo con las reivindicaciones 1-4, en el que el anticuerpo monoclonal humanizado,
o fragmento, variante o derivado de un anticuerpo monoclonal es para administrar sistémicamente, tópicamente, mediante inyección intravítrea o periocular, iontoforesis, pulverización o gotas, o como parte de un gel in situ, inserto ocular, escudo corneano o lentes de contacto, liposoma, niosoma/discoma, sistema mucoahesivo, sistema de vehículo liofilizado, partículas, emulsión en submicrómetros, dendrímero, microesfera, nanoesfera o colasoma, o combinación de los mismos.
6. Un anticuerpo monoclonal humanizado, o fragmento, variante o derivado del mismo como se define en una cualquiera de las reivindicaciones 1-5 para usar de acuerdo con una cualquiera de las reivindicaciones 1-5, en el que el anticuerpo monoclonal humanizado, o fragmento, variante o derivado de un anticuerpo monoclonal está modificado, no está modificado o es proporcionado como profármaco, con o sin potenciadores y/o potenciadores de la penetración.
7. Un anticuerpo monoclonal humanizado, o fragmento, variante o derivado del mismo como se define en una cualquiera de las reivindicaciones 1-6 para usar de acuerdo con una cualquiera de las reivindicaciones 1-6, en el que el anticuerpo monoclonal humanizado, o fragmento, variante o derivado de un anticuerpo monoclonal está combinado con un vehículo farmacéuticamente aceptable y/o solución salina tamponada con fosfato.
Patentes similares o relacionadas:
Formulaciones estabilizadas que contienen anticuerpos anti-receptor de interleucina 4 (IL-4R), del 29 de Julio de 2020, de REGENERON PHARMACEUTICALS, INC.: Una jeringuilla precargada que contiene una formulación farmacéutica líquida estable, en la que la formulación farmacéutica líquida comprende: […]
Composición de anticuerpos monoclonales dirigidos contra BDCA-2, del 22 de Julio de 2020, de LABORATOIRE FRANCAIS DU FRACTIONNEMENT ET DES BIOTECHNOLOGIES: Composición de anticuerpos monoclonales dirigidos contra la proteína BDCA-2, presentando dichos anticuerpos un porcentaje de fucosilación inferior al 60% […]
Anticuerpos anti-PD-L1 y usos de los mismos, del 22 de Julio de 2020, de MERCK PATENT GMBH: Un anticuerpo anti-PD-L1 aislado o su fragmento de union a antigeno que comprende una secuencia de region variable de cadena pesada y de cadena ligera, en donde: […]
Composición para el tratamiento de enfermedades isquémicas o trastornos inflamatorios neurogénicos, que contienen el secretoma de células progenitoras neurales como ingrediente activo, del 22 de Julio de 2020, de S-BIOMEDICS: Una composición para uso en el tratamiento de enfermedad cerebrovascular isquémica, cardiopatía isquémica, infarto de miocardio, enfermedad de Alzheimer, enfermedad […]
Utilización de anticuerpos optimizados en ADCC para tratar a los pacientes con bajo nivel de respuesta, del 22 de Julio de 2020, de LABORATOIRE FRANCAIS DU FRACTIONNEMENT ET DES BIOTECHNOLOGIES: Utilización de una composición de anticuerpo monoclonal quimérico, humanizado o humano de isotipo IgG1 anti- Rhesus del glóbulo rojo humano cuya […]
Composiciones farmacéuticas que contienen una leucocidina E mutada, del 22 de Julio de 2020, de NEW YORK UNIVERSITY: Una composición que comprende: una proteína Leucocidina E (LukE) aislada que comprende la secuencia de aminoácidos de la SEQ ID NO: 4, o un polipéptido […]
Método para producir inmunoconjugados de anticuerpo-SN-38 con un enlazador CL2A, del 22 de Julio de 2020, de IMMUNOMEDICS, INC.: Un método para producir un compuesto, CL2A-SN-38, que presenta la estructura, **(Ver fórmula)** que comprende realizar un esquema de reacción como el que se muestra: **(Ver […]
Métodos de tratamiento y prevención de infecciones por staphylococcus aureus y afecciones asociadas, del 15 de Julio de 2020, de NEW YORK UNIVERSITY: Una composición para uso en un método de inmunización de un sujeto contra la infección por S. aureus, comprendiendo dicha composición: (i) un fragmento de polipéptido […]