COMPOSICIONES DE CEFQUINOMA Y METODOS PARA SU USO.
Una composición líquida adecuada para administración parenteral a un mamífero,
pez o ave, caracterizada por que la composición comprende:
una cantidad terapéuticamente eficaz de cefquinoma o una sal farmacéuticamente aceptable de la misma y fosfato de sodio dibásico
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2006/041952.
Solicitante: INTERVET INTERNATIONAL BV.
Nacionalidad solicitante: Países Bajos.
Dirección: WIM DE KORVERSTRAAT 35,5831 AN BOXMEER.
Inventor/es: BARBOT, CAROLE, CADY,SUSAN M.
Fecha de Publicación: .
Fecha Concesión Europea: 7 de Julio de 2010.
Clasificación Internacional de Patentes:
- A61K9/00M5
Clasificación PCT:
- A61K31/545 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › Compuestos que contienen sistemas cíclicos 5-tia-1-aza biciclo [4.2.0] octano, es decir, compuestos que contienen un sistema cíclico de fórmula , p. ej. cefalosporinas, cefaclor, cefalexina.
- A61K9/08 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › Soluciones.
Fragmento de la descripción:
Composiciones de cefquinoma y métodos para su uso.
Remisión a solicitudes de patente relacionadas
Esta patente reivindica prioridad respecto a la Solicitud de Patente Provisional de Estados Unidos Nº 60/731.463 (presentada el 29 de octubre de 2005) y la Solicitud de Patente Europea Nº 06111029.2 (presentada el 13 de marzo de 2006).
Campo de la invención
Esta invención se refiere generalmente a composiciones de cefquinoma (incluyendo composiciones que comprenden sales de cefquinoma), los procesos para preparar tales composiciones, los usos de tales composiciones para preparar medicamentos, los kits para preparar tales composiciones y los métodos para usar tales composiciones y kits para tratar infecciones.
Antecedentes de la invención
La cefquinoma (Nº CAS 84957-30-2) es un antibiótico de ß-lactama de la clase cefalosporinas. Tiene un amplio espectro de actividad contra bacterias gram-positivas y bacterias gram-negativas, incluyendo Actinobacillus spp., Actinobacillus pleuropneumoniae, Haemophilus spp., Clostridium spp., Corynebacterium, Erysipelothrix rhusiopatiae, Streptococcus spp. y Pasteurella spp. La cefquinoma puede usarse, por ejemplo, para tratar meningitis causada por Streptococcus suis, epidermitis causada por Staphylococcus spp. y el síndrome de mastitis-metritis-agalactia ("MMA") causado por E. coli y Staphylococcus spp. La forma de la molécula de cefquinoma tiende a facilitar la distribución en animales tratados y el paso a través de las paredes de las células bacterianas, dando como resultado un efecto bactericida rápido después de la inyección. También tiende a ser resistente contra la inactivación por bacterias que producen ß-lactamasa.
Las formulaciones de cefquinoma disponibles en el mercado han incluido, por ejemplo, COBACTAN 2,5%, comercializado por Intervet International B.V., Boxmeer, The Netherlands. COBACTAN 2,5%, que también se ha comercializado con el nombre CEPHAGUARD 2,5%, contiene 25 mg/ml de sulfato de cefquinoma (Nº CAS 123766-80-3):
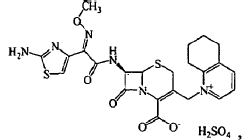
es decir, hidróxido de 1-[[6R,7R)-7-[2-(2-amino-4-tiazolil)glioxilamido]-2-carboxi-8-oxo-5-tia-1-azabiciclo[4.2.0]oct-2-en-3-il]metil]-5,6,7,8-tetrahidroquinolinio, sal interna 72-(Z)-(O-metiloxima), sulfato. En esta formulación, el sulfato de cefquinoma se suspende en oleato de etilo. Se ha indicado que las inyecciones intramusculares o subcutáneas de COBACTAN 2,5% a una dosis de 1 mg de sulfato de cefquinoma por kg de peso corporal, generalmente dan como resultado una concentración de plasma eficaz durante un período de 8-12 horas. Con tal dosificación, se recomienda un tratamiento con inyecciones diarias durante 3-5 días consecutivos.
En la Patente de Estados Unidos Nº 5.071.979, Lattrell et al. analizan un género de compuestos de cefalosporina, así como los métodos para preparar tales compuestos y los métodos para usar tales compuestos para tratar las infecciones bacterianas. Este género incluye cefquinoma y sales de adición de ácidos fisiológicamente aceptables de la misma.
En la Patente de Estados Unidos Nº 4.845.087, Lattrell et al. analizan las sales de adición de ácidos cristalinas de cefquinoma y el uso de tales sales cristalizadas para tratar infecciones bacterianas. Lattrell et al. indican que las sales cristalizadas muestran propiedades antibacterianas contra gérmenes bacterianos gram-positivos y gram-negativos. Lattrell et al. indican también que las sales cristalizadas son inesperadamente activas contra bacterias que forman penicilinasa y cefalosporinasa y muestran propiedades toxicológicas y farmacológicas favorables, convirtiéndolas en agentes quimioterapéuticos valiosos.
En la Patente de Estados Unidos Nº 5.747.484, Lattrell et al. analizan un género de sales de adición de ácido fenol carboxílico de compuestos de cefalosporina, así como los métodos para preparar tales compuestos y los métodos para usar tales compuestos para tratar infecciones bacterianas. Este género incluye sales de adición de ácido carboxílico de cefquinoma. Lattrell et al. indican que estas sales proporcionan ventajas basadas en su baja solubilidad y farmacocinética en animales.
En la Patente de Estados Unidos Nº 4.692.516, Kirrstetter et al. analizan un proceso para preparar un género de 3-piridinio-metil-cefalosporinas mediante el reemplazo nucleófilo en presencia de trialquil-C1-C4 yodosilano. El género de cefalosporina incluye cefquinoma.
En la Patente de Estados Unidos Nº 6.911.441, Schmid et al. analizan las composiciones de una cefalosporina (por ejemplo, cefquinoma) en un vehículo de liberación que comprende un aceite y diestearato de aluminio. Schmid et al. indican que tales composiciones proporcionan una duración prolongada de la concentración eficaz en plasma sanguíneo de la cefalosporina después de la inyección a un animal.
El documento EP 0 388 510 describe una formulación parenteral que comprende decaplanina y un derivado de cefalosporina.
A pesar de lo anterior, continua habiendo una necesidad de formulaciones de cefquinoma alternativas que, por ejemplo, permitan la dosificación consistente, sean simples de administrar (por ejemplo, se administren fácilmente por inyección), permanezcan estables a temperaturas ambiente, se absorban rápidamente, tengan alta tolerabilidad local, tengan retención en el día cero y/o tengan descarte de leche en el día cero. La siguiente descripción describe tales formulaciones y métodos para usar tales formulaciones.
Sumario de la invención
Esta invención se refiere a composiciones de cefquinoma y a su uso para tratar infecciones en animales. Tales composiciones son particularmente adecuadas para usarse con mamíferos. Tales mamíferos incluyen, por ejemplo, porcinos, bovinos y equinos. Además, se contempla que tales mamíferos incluyen, por ejemplo, otros mamíferos de granja o ganado (por ejemplo, cabras, ovejas, etc.), mamíferos de laboratorio (por ejemplo, ratones, ratas, etc.), animales de compañía (por ejemplo, perros, gatos, etc.) y mamíferos salvajes y de zoo (por ejemplo, búfalo, ciervo, etc.). Se contempla que las composiciones de esta invención también son adecuadas para su uso con otros animales, tales como aves (por ejemplo, pavos, pollos, etc.) y peces.
En resumen, por lo tanto, esta invención se refiere, en parte, a una composición líquida (particularmente acuosa) adecuada para la administración parenteral a un animal. La composición comprende cefquinoma o una sal farmacéuticamente aceptable de la misma. Además, la composición comprende fosfato de sodio dibásico (es decir, Na2HPO4).
Esta invención también se refiere, en parte, al uso de una composición líquida descrita anteriormente para preparar un medicamento, particularmente un medicamento para tratar una infección bacteriana en un animal.
Esta invención también se refiere, en parte, a un método para tratar una infección bacteriana en un animal. El método comprende formar una composición líquida. La composición comprende cefquinoma o una sal farmacéuticamente aceptable de la misma. Además, la composición comprende fosfato de sodio dibásico.
La invención también se refiere, en parte, a un kit. El kit comprende un primer volumen que comprende una cantidad de cefquinoma terapéuticamente eficaz o una sal farmacéuticamente aceptable de la misma. Además, el kit comprende un segundo volumen que comprende agua. Además, el kit comprende fosfato de sodio dibásico o un hidrato del mismo. El fosfato de sodio dibásico o el hidrato pueden estar presentes en el primer volumen, en el segundo volumen y/o en un tercer volumen.
Los beneficios adicionales de la invención de los Solicitantes serán evidentes para los expertos en la materia a partir de la lectura de esta memoria descriptiva.
Descripción detallada de las realizaciones preferidas
Esta descripción detallada de las realizaciones preferidas está destinada únicamente a informar a otros expertos en la materia de la invención de los Solicitantes, sus principios y su aplicación práctica, por lo que otros expertos en la materia puedan adaptar y poner en práctica la invención en sus numerosas formas, puesto que éstas pueden ser las más apropiadas para los requisitos de un uso particular. Esta descripción detallada...
Reivindicaciones:
1. Una composición líquida adecuada para administración parenteral a un mamífero, pez o ave, caracterizada por que la composición comprende:
una cantidad terapéuticamente eficaz de cefquinoma o una sal farmacéuticamente aceptable de la misma y fosfato de sodio dibásico.
2. La composición de acuerdo con la reivindicación 1, caracterizada por que la cefquinoma o sal de la misma está presente en la composición a una concentración de 44 a 57 mg/ml.
3. La composición de acuerdo con la reivindicación 1 ó 2, caracterizada por que el fosfato de sodio dibásico está presente en la composición a una concentración que es suficiente para conferir un pH de 6 a 7 a la composición.
4. La composición de acuerdo con una cualquiera de las reivindicaciones 1 a 3, caracterizada por que la composición comprende alcohol bencílico.
5. La composición de acuerdo con una cualquiera de las reivindicaciones 1 a 4, caracterizada por que la composición comprende sulfato de cefquinoma.
6. La composición de acuerdo con una cualquiera de las reivindicaciones 1 a 5, caracterizada por que la composición comprende: sulfato de cefquinoma a una concentración de 52 a 57 mg/ml y fosfato de sodio dibásico a una concentración de 300 a 350 mM.
7. El uso de una composición de acuerdo con una cualquiera de las reivindicaciones 1 a 6 para la fabricación de un medicamento para tratar una infección bacteriana.
8. Un kit, en el que el kit comprende:
un primer envase que comprende una cantidad terapéuticamente eficaz de cefquinoma o una sal farmacéuticamente aceptable de la misma,
un segundo envase que comprende agua, y
fosfato de sodio dibásico o un hidrato del mismo.
9. El kit de acuerdo con la reivindicación 8, en el que el primer envase comprende una cantidad terapéuticamente eficaz de sulfato de cefquinoma.
10. El kit de acuerdo con la reivindicación 8 ó 9, en el que el fosfato de sodio dibásico está presente en el kit como una solución acuosa de fosfato de sodio dibásico en el segundo envase.
11. El kit de acuerdo con una cualquiera de las reivindicaciones 8 a 10, en el que el kit comprende además un aparato para administrar parenteralmente una mezcla de la cefquinoma (o sal de la misma) y una de solución fosfato de sodio dibásico a un mamífero.
12. El kit de cuerdo con la reivindicación 11, en el que el aparato comprende una jeringa.
13. El kit de acuerdo con las reivindicaciones 11 ó 12, en el que el mamífero es un animal bovino, equino o porcino.
Patentes similares o relacionadas:
NOVEDOSAS FORMULACIONES PARA VACUNAS DE PÉPTIDOS ASOCIADOS A TUMORES, UNIDOS A MOLÉCULAS DEL ANTÍGENO DE LEUCOCITO HUMANO (HLA) DE CLASO I O II, del 14 de Febrero de 2012, de IMMATICS BIOTECHNOLOGIES GMBH: Una formulación farmacéutica que comprende: entre 2 y 18 péptidos asociados a tumor; en donde cada péptido tiene una longitud de entre 8 y 22 aminoácidos; […]
COMPOSICIONES Y PROCEDIMIENTOS PARA EL SUMINISTRO DE AGENTES ANTICANCEROSOS, del 9 de Febrero de 2012, de THE UNIVERSITY OF WOLLONGONG: Composición que comprende: (i) 5-fluorouracilo (5-FU) o 5-fluoro-2-desoxiuridina (5-FUdr), o su sal farmacéuticamente aceptable; (ii) ácido folínico, o una sal […]
COMPOSICIONES ANESTÉSICAS LIPOSOMIALES DE LIBERACIÓN SOSTENIDA, del 9 de Febrero de 2012, de PACIRA PHARMACEUTICALS, INC: Un procedimiento para preparar una composición de liposomas multivesiculares que contiene un anestésico tipo amida, que comprende a) preparar un primer componente acuoso […]
SOLUCIÓN ANTIINFECCIOSA QUE COMPRENDE UN COMPUESTO DE TIPO PIRIDO (3,2,1-IJ) BENZOXADIAZINA, del 11 de Enero de 2012, de SA VETOQUINOL: Solución antiinfecciosa que comprende: (i) de 10 a 30% en peso con respecto al volumen total de la solución de al menos un compuesto que responde a la […]
MEDICAMENTOS TÓPICOS MEJORADOS Y MÉTODOS PARA EL TRATAMIENTO FOTODINÁMICO DE UNA ENFERMEDAD, del 11 de Enero de 2012, de PROVECTUS PHARMATECH, INC: Uso de al menos un xanteno halogenado para la fabricación de un medicamento para aplicación tópica, para el tratamiento fotodinámico de enfermedades seleccionadas […]
FORMULACIONES INTRASINOVIALES DE ESTANOZOLOL, del 22 de Diciembre de 2011, de ACME DRUGS: Formulaciones intrasinoviales que contienen estanozolol y un portador adecuado en forma de suspensión de estanozolol micronizado de dimensiones que no […]
AGENTE PROFILÁCTICO O TERAPÉUTICO PARA LA DEGENERACIÓN MACULAR ASOCIADA A LA EDAD, del 22 de Diciembre de 2011, de SANTEN PHARMACEUTICAL CO., LTD.: Agente para su utilización en la profilaxis o terapia de la degeneración macular asociada a la edad, que comprende 2-fenil-1,2-benzisoselenazol-3(2H)-ona o […]
SUSPENSIÓN INYECTABLE DE ARIPIPRAZOL, del 7 de Diciembre de 2011, de ALKERMES, INC.: Una composición inyectable para la liberación prolongada de aripiprazol que comprende una suspensión de aripiprazol en un vehículo de inyección […]