Formulaciones de nalbufina de liberación sostenida.
Una formulación oral de liberación sostenida que comprende: nalbufina o una sal farmacéuticamente aceptable de esta y un sistema de suministro de liberación sostenida,
donde el sistema de suministro de liberación sostenida comprende al menos un compuesto hidrófilo seleccionado del grupo constituido por gomas, éteres de celulosa, resinas acrílicas, polivinilpirrolidona, compuestos derivados de proteínas y mezclas de estos, al menos un agente reticulante y al menos un diluyente farmacéutico, y donde dicha formulación oral de liberación sostenida proporciona una liberación controlada durante al menos 8 horas
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2006/033011.
Solicitante: ENDO PHARMACEUTICALS INC..
Inventor/es: BAICHWAL, ANAND R., CARPANZANO,ANTHONY E, GOLIBER,PHILIP A, SCIASCIA,THOMAS, DIEHL,DONALD II, VOGLER,BRIAN.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K9/22 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › del tipo de liberación prolongada o discontinua.
- A61K9/24 A61K 9/00 […] › en dosis unitarias constituidas por capas u hojas.
PDF original: ES-2441766_T3.pdf
Fragmento de la descripción:
Formulaciones de nalbufina de liberación sostenida
CAMPO DE LA INVENCIÓN
La invención proporciona formulaciones orales de nalbufina de liberación sostenida y sales farmacéuticamente aceptables de esta; métodos para preparar las formulaciones de nalbufina de liberación sostenida y sales farmacéuticamente aceptables de esta; y métodos para emplear las formulaciones de nalbufina de liberación sostenida y sales farmacéuticamente aceptables de esta para tratar pacientes que padecen dolor.
ANTECEDENTES DE LA INVENCIÓN
El dolor es el síntoma que se manifiesta con más frecuencia y supone un problema clínico común al cual se enfrentan los médicos. Muchos millones de personas en los Estados Unidos padecen dolor que se gestiona de forma inadecuada o se trata crónicamente de forma insuficiente. La utilidad clínica de las propiedades analgésicas de los opioides ha sido reconocida durante siglos y tanto la morfina como sus derivados se han utilizado extensamente para la analgesia durante décadas en varios estados clínicos del dolor.
El clorhidrato de nalbufina (clorhidrato de 17- (ciclobutilmetil) -4, 5α-epoximorfinan-3, 6α, 14-triol) es un analgésico agonista-antagonista opioide sintético que pertenece a la clase de opioides de los fenantrenos. La nalbufina está relacionada con el antagonista opioide naloxona y también con el analgésico opioide oximorfona. Endo Pharmaceuticals comercializa el clorhidrato de nalbufina en los Estados Unidos con el nombre comercial Nubain® y este es principalmente un analgésico agonista kappa/antagonista parcial mu.
Aunque se ha estudiado la administración oral de nalbufina (Lo, MW et al. “The Disposition and Bioavailability of Intravenous and Oral Nalbuphine in Healthy Volunteers”, J. Clin. Pharmacol. 27:866-873 (1987) ; Aitkenhead, AR et al. "The Pharmacokinetics of Oral and Intravenous Nalbuphine in Healthy Volunteers, Br. J. Clin. Pharmacol. 25:264
288 (1988) ; Jaillon P, et al. “Pharmacokinetics of Nalbuphine in Infants, Young Healthy Volunteers, and Elderly Patients”, Clin. Pharmacol. Ther. 46:226-233 (1989) ) , nunca se ha aprobado su comercialización. Actualmente, la nalbufina se comercializa solamente como inyección (10 mg/mL en viales de dosis múltiples de 10 mL; 20 mg/mL en viales de dosis múltiples de 10 mL; 10 mg/mL en ampollas de 1 mL; 20 mg/mL en ampollas de 1 mL) para administración intramuscular, subcutánea e intravenosa. Yen et al. (Int. J. Pharm. 220 (2001) 91-99) describen microesferas de PLGA para inyección con carga de nalbufina.
El intervalo de dosificación para la inyección de nalbufina es de aproximadamente cada tres a seis horas. Aunque se ha descrito que la semivida tras la administración oral de nalbufina de liberación inmediata es un poco más larga (de aproximadamente cinco a siete horas) , el efecto farmacológico generalmente desaparece hacia el final de la ventana terapéutica.
COMPENDIO DE LA INVENCIÓN
La invención proporciona composiciones orales que incluyen nalbufina o una sal farmacéuticamente aceptable de esta y un sistema de suministro de liberación sostenida que incluye al menos un compuesto hidrófilo, al menos un agente reticulante y al menos un diluyente farmacéutico de acuerdo con la reivindicación 1. El sistema de suministro de liberación sostenida puede incluir además uno o más compuestos reticulantes adicionales.
La invención también proporciona composiciones que incluyen nalbufina o una sal farmacéuticamente aceptable de esta y un sistema de suministro de liberación sostenida de acuerdo con la reivindicación 1. El sistema de suministro de liberación sostenida incluye al menos un compuesto hidrófilo, al menos un compuesto reticulante catiónico y al menos un diluyente farmacéutico. El sistema de suministro de liberación sostenida puede incluir además uno o más compuestos reticulantes adicionales.
La invención proporciona además composiciones multicapa que incluyen nalbufina o una sal farmacéuticamente aceptable de esta y un sistema de suministro de liberación sostenida. La formulación incluye una primera capa y una segunda capa. La primera capa incluye una formulación de liberación inmediata de clorhidrato de nalbufina o una sal farmacéuticamente aceptable de este, mientras que la segunda capa incluye una formulación de liberación prolongada de nalbufina o una sal farmacéuticamente aceptable de nalbufina. En este aspecto, la primera capa incluye nalbufina o una sal farmacéuticamente aceptable de nalbufina y la segunda capa incluye nalbufina o una sal farmacéuticamente aceptable de nalbufina y un sistema de suministro de liberación sostenida. La primera capa incluye opcionalmente un sistema de suministro de liberación sostenida. En una realización, la segunda capa incluye aproximadamente 45 mg de nalbufina o una sal farmacéuticamente aceptable de nalbufina y de aproximadamente 110 mg a aproximadamente 150 mg de un sistema de suministro de liberación sostenida; y la primera capa incluye de aproximadamente 10 mg a aproximadamente 20 mg de nalbufina o una sal farmacéuticamente aceptable de nalbufina y, opcionalmente, de aproximadamente 3 mg a aproximadamente 19 mg de un sistema de suministro de liberación sostenida. En otra realización, la segunda capa incluye aproximadamente 45 mg de nalbufina o una sal farmacéuticamente aceptable de nalbufina y de aproximadamente 110 mg a aproximadamente 150 mg de un sistema de suministro de liberación sostenida; y la primera capa incluye de aproximadamente 10 mg a aproximadamente 20 mg de nalbufina o una sal farmacéuticamente aceptable de nalbufina. En esta realización, la primera capa no incluye ningún sistema de suministro de liberación sostenida. En algunas realizaciones, el sistema de suministro de liberación sostenida incluye de aproximadamente un 12% a un 42% en peso de goma de algarrobo, de aproximadamente un 8% a aproximadamente un 28% en peso de goma xantana, de aproximadamente un 20% a aproximadamente un 70% en peso de manitol y de aproximadamente un 5% a aproximadamente un 20% en peso de sulfato de calcio dihidratado.
En un aspecto, la invención proporciona una forma farmacéutica unitaria oral que incluye nalbufina o una sal farmacéuticamente aceptable de esta. La forma farmacéutica oral proporciona un efecto analgésico durante un periodo de al menos aproximadamente 12 horas. En algunas realizaciones, la forma farmacéutica oral proporciona un nivel de nalbufina en suero sanguíneo caracterizado por uno o más máximos seguidos de una región plana. En algunas realizaciones, la forma farmacéutica oral se caracteriza por que libera un 75-100% de nalbufina después de aproximadamente 12 horas, según se determina utilizando un Aparato III de USP a 15 dpm en un tampón de pH 6.8 a 37 °C.
En un aspecto, la invención proporciona una forma farmacéutica unitaria oral de un medicamento que incluye una dosificación uniforme de nalbufina y un sistema de suministro de liberación sostenida. La forma farmacéutica unitaria oral se caracteriza por que la forma farmacéutica se desgasta de manera que se libera nalbufina en uno o más máximos seguidos de una región plana.
La invención también proporciona métodos para tratar el dolor en pacientes mediante la administración de una cantidad eficaz de cualquiera de las composiciones de la invención. El dolor puede ser de moderado a grave. En algunas realizaciones, el dolor es un dolor agudo, dolor crónico, dolor nociceptivo, dolor neuropático, dolor visceral o dolor idiopático.
La invención también proporciona métodos para preparar tales composiciones.
Estos y otros aspectos de la invención se describen detalladamente en la presente.
DESCRIPCIÓN DE LOS DIBUJOS
Se tendrá una visión más completa de la invención y de muchas de sus ventajas haciendo referencia a la descripción de la invención, considerada junto con los siguientes dibujos, que se presentan con fines ilustrativos solamente y no se pretende que sean limitantes, y en los cuales:
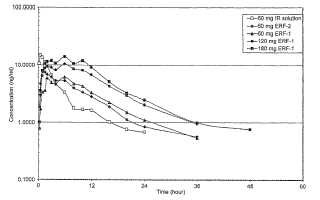
La Figura 1 es una representación gráfica del logaritmo de la concentración de nalbufina en plasma media frente al tiempo para numerosas composiciones de nalbufina que se describen en la presente.
DESCRIPCIÓN DETALLADA DE LA INVENCIÓN
La invención proporciona formulaciones orales de nalbufina de liberación sostenida que incluyen una cantidad de nalbufina eficaz como analgésico o una sal farmacéuticamente aceptable de esta. Las formulaciones orales de liberación sostenida de la invención proporcionan una liberación controlada del fármaco durante un periodo más largo que el observado para formulaciones orales de liberación inmediata o inyectables (p. ej., al menos aproximadamente 8-12 horas) . De este... [Seguir leyendo]
Reivindicaciones:
1. Una formulación oral de liberación sostenida que comprende: nalbufina o una sal farmacéuticamente aceptable de esta y un sistema de suministro de liberación sostenida, donde el sistema de suministro de liberación sostenida comprende al menos un compuesto hidrófilo seleccionado del grupo constituido por gomas, éteres de celulosa, resinas acrílicas, polivinilpirrolidona, compuestos derivados de proteínas y mezclas de estos, al menos un agente reticulante y al menos un diluyente farmacéutico, y donde dicha formulación oral de liberación sostenida proporciona una liberación controlada durante al menos 8 horas.
2. La formulación de liberación sostenida de la reivindicación 1, donde la proporción de nalbufina o una sal farmacéuticamente aceptable de esta respecto al sistema de suministro de liberación sostenida es de 4:1 a 1:25.
3. La formulación de liberación sostenida de la reivindicación 1, donde el sistema de suministro de liberación sostenida está presente en una cantidad de 10 mg a 420 mg en la formulación.
4. La formulación de liberación sostenida de la reivindicación 3, donde el o los compuestos hidrófilos están presentes en el sistema de suministro de liberación sostenida en una cantidad de un 5% a un 80% en peso; el o los agentes reticulantes están presentes en el sistema de suministro de liberación sostenida en una cantidad de un 0.5% a un 80% en peso; y el o los diluyentes farmacéuticos están presentes en el sistema de suministro de liberación sostenida en una cantidad de un 20% a un 80% en peso.
5. La formulación de liberación sostenida de la reivindicación 1, donde el o los agentes reticulantes son una goma de homopolisacárido.
6. La formulación de liberación sostenida de la reivindicación 5, donde la goma de homopolisacárido es una goma de algarrobo o una goma guar.
7. La formulación de liberación sostenida de la reivindicación 1, donde la proporción del o de los compuestos hidrófilos respecto al o a los agentes reticulantes es de 5:1 a 1:5.
8. La formulación de liberación sostenida de la reivindicación 1, donde la proporción del o de los diluyentes farmacéuticos respecto al o a los compuestos hidrófilos es de 9:1 a 1:9.
9. La formulación de liberación sostenida de la reivindicación 1, donde la proporción de la nalbufina o la sal farmacéuticamente aceptable de esta respecto a la suma del o de los compuestos hidrófilos y el o los agentes reticulantes es de 10:1 a 1:10.
10. La formulación de liberación sostenida de la reivindicación 1, donde el sistema de suministro de liberación sostenida comprende además al menos un compuesto reticulante catiónico.
11. La formulación de liberación sostenida de la reivindicación 10, donde el o los compuestos reticulantes catiónicos están presentes en el sistema de suministro de liberación sostenida en una cantidad de un 0.5% a un 30% en peso.
12. Una formulación oral de liberación sostenida que comprende: nalbufina o una sal farmacéuticamente aceptable de esta y un sistema de suministro de liberación sostenida, donde el sistema de suministro de liberación sostenida comprende al menos un compuesto hidrófilo seleccionados del grupo constituido por gomas, éteres de celulosa, resinas acrílicas, polivinilpirrolidona, compuestos derivados de proteínas y mezclas de estos, al menos un agente reticulante catiónico y al menos un diluyente farmacéutico, y donde dicha formulación oral de liberación sostenida proporciona una liberación controlada durante al menos 8 horas.
13. La formulación de liberación sostenida de la reivindicación 12, donde la proporción de nalbufina o una sal farmacéuticamente aceptable de esta respecto al sistema de suministro de liberación sostenida es de 5:1 a 1:5.
14. La formulación de liberación sostenida de la reivindicación 1 o la reivindicación 12, donde la nalbufina o la sal farmacéuticamente aceptable de esta está presente en una cantidad de 1 mg a 200 mg en la formulación.
15. La formulación de liberación sostenida de la reivindicación 12, donde el sistema de suministro de liberación sostenida está presente en una cantidad de 10 mg a 420 mg en la formulación.
16. La formulación de liberación sostenida de la reivindicación 12, donde el o los compuestos hidrófilos están presentes en el sistema de suministro de liberación sostenida en una cantidad de un 5% a un 80% en peso; el o los agentes reticulantes catiónicos están presentes en el sistema de suministro de liberación sostenida en una cantidad de un 0.5% a un 30% en peso; y el o los diluyentes farmacéuticos están presentes en el sistema de suministro de liberación sostenida en una cantidad de un 20% a un 80% en peso.
17. La formulación de liberación sostenida de la reivindicación 1 o la reivindicación 12, donde el o los compuestos hidrófilos son una goma de heteropolisacárido.
18. La formulación de liberación sostenida de la reivindicación 1 o la reivindicación 12, donde el o los compuestos hidrófilos son al menos un compuesto seleccionado entre goma xantana, goma tragacanto, una pectina, acacia, karaya, agar, carragenano y una goma gelana.
19.La formulación de liberación sostenida de la reivindicación 1 o la reivindicación 12, donde el o los compuestos hidrófilos son una goma xantana o un derivado de esta.
20. La formulación de liberación sostenida de la reivindicación 1 o la reivindicación 12, donde el o los compuestos reticulantes catiónicos son al menos un compuesto seleccionado entre un catión metálico monovalente, un catión metálico multivalente y una sal inorgánica.
21. La formulación de liberación sostenida de la reivindicación 20, donde la sal inorgánica es un sulfato de un metal alcalino, un cloruro de un metal alcalino, un borato de un metal alcalino, un bromuro de un metal alcalino, un citrato de un metal alcalino, un acetato de un metal alcalino, un lactato de un metal alcalino, un sulfato de un metal alcalinotérreo, un cloruro de un metal alcalinotérreo, un borato de un metal alcalinotérreo, un bromuro de un metal alcalinotérreo, un citrato de un metal alcalinotérreo, un acetato de un metal alcalinotérreo, un lactato de un metal alcalinotérreo y una mezcla de estos.
22. La formulación de liberación sostenida de la reivindicación 20, donde el o los compuestos reticulantes catiónicos son al menos un compuesto seleccionado entre sulfato de calcio, cloruro de sodio, sulfato de potasio, carbonato de sodio, cloruro de litio, fosfato de tripotasio, borato de sodio, bromuro de potasio, fluoruro de potasio, bicarbonato de sodio, cloruro de calcio, cloruro de magnesio, citrato de sodio, acetato de sodio, lactato de calcio, sulfato de magnesio, fluoruro de sodio y mezclas de estos.
23. La formulación de liberación sostenida de la reivindicación 1 o la reivindicación 12, donde el o los diluyentes farmacéuticos son al menos un compuesto seleccionado entre almidón, manitol, lactosa, dextrosa, sacarosa, celulosa microcristalina, sorbitol, xilitol y fructosa.
24. La formulación de liberación sostenida de la reivindicación 1 o la reivindicación 12, donde el sistema de suministro de liberación sostenida comprende además un segundo diluyente farmacéutico.
25. La formulación de liberación sostenida de la reivindicación 24, donde el segundo diluyente farmacéutico es al menos un compuesto seleccionado entre almidón, manitol, lactosa, dextrosa, sacarosa, celulosa microcristalina, sorbitol, xilitol y fructosa.
26. La formulación de liberación sostenida de la reivindicación 1 o la reivindicación 12, que comprende además un segundo compuesto hidrófilo.
27. La formulación de liberación sostenida de la reivindicación 26, donde el segundo compuesto hidrófilo es una hidroxietilcelulosa, una hidroxipropilcelulosa, una hidroxipropilmetilcelulosa, una carboximetilcelulosa o una mezcla de estas.
28. La formulación de liberación sostenida de la reivindicación 1 o la reivindicación 12, donde la formulación de liberación sostenida presenta una disolución in vitro de un 50% a un 100% en peso de nalbufina después de 6 horas.
29. La formulación de liberación sostenida de la reivindicación 28, donde la formulación de liberación sostenida presenta una disolución in vitro de un 75% a un 100% en peso de nalbufina desde las 6 horas hasta las 8 horas.
30. La formulación de liberación sostenida de la reivindicación 1 o la reivindicación 12, donde la formulación de liberación sostenida presenta una disolución in vitro de un 15% a un 75% en peso de nalbufina después de 1 hora.
31. La formulación de liberación sostenida de la reivindicación 1 o la reivindicación 12, donde la formulación de liberación sostenida presenta una disolución in vitro de un 50% en peso de nalbufina después de 1 hora y un 75100% en peso de nalbufina desde las 6 horas hasta las 8 horas.
32. La formulación de liberación sostenida de la reivindicación 1 o la reivindicación 12, donde la duración del efecto analgésico de la formulación de liberación sostenida es de más de 8 horas.
33. La formulación de liberación sostenida de la reivindicación 1 o la reivindicación 12, donde la duración del efecto analgésico de la formulación de liberación sostenida es de al menos 12 horas.
34. La formulación de liberación sostenida de la reivindicación 1 o la reivindicación 12, donde la duración del efecto analgésico de la formulación de liberación sostenida está comprendida entre 8 y 12 horas.
35. La formulación oral de liberación sostenida de la reivindicación 1, que comprende de 5 a 80 mg de clorhidrato de nalbufina y de 80 mg a 360 mg de un sistema de suministro de liberación sostenida; donde el sistema de suministro de liberación sostenida comprende de un 12% a un 42% en peso de goma de algarrobo, de un 8% a un 28% en peso de goma xantana, de un 20% a un 70% en peso de manitol y de un 5% a un 20% en peso de sulfato de calcio dihidratado.
36. La formulación de liberación sostenida de la reivindicación 35, que comprende 60 mg de clorhidrato de nalbufina.
37. La formulación de liberación sostenida de la reivindicación 35, que comprende de 30 mg a 225 mg de un sistema de suministro de liberación sostenida.
38. La formulación de liberación sostenida de la reivindicación 35, donde el sistema de suministro de liberación sostenida comprende un 18% de goma de algarrobo, un 12% de goma xantana, un 60% de manitol y un 10% de sulfato de calcio dihidratado.
39. La formulación de liberación sostenida de la reivindicación 35, que comprende además un recubrimiento externo.
40. La formulación oral de liberación sostenida de cualquiera de las reivindicaciones 1-39, donde el efecto analgésico se proporciona durante al menos 12 horas.
41. Un método para preparar una formulación oral de liberación sostenida que comprende: combinar nalbufina o una sal farmacéuticamente aceptable de esta y un sistema de suministro de liberación sostenida, donde el sistema de suministro de liberación sostenida comprende al menos un compuesto hidrófilo seleccionado del grupo constituido por gomas, éteres de celulosa, resinas acrílicas, polivinilpirrolidona, compuestos derivados de proteínas y mezclas de estos, al menos un agente reticulante y al menos un diluyente farmacéutico, y donde dicha formulación oral de liberación sostenida proporciona una liberación controlada durante al menos 8 horas.
42. El método de la reivindicación 44, donde el sistema de suministro de liberación sostenida comprende además un segundo diluyente farmacéutico.
43. El método de la reivindicación 44, donde el sistema de suministro de liberación sostenida comprende además al menos un compuesto reticulante catiónico.
44. El método de cualquiera de las reivindicacione.
4. 46, en el cual la formulación oral de liberación sostenida proporciona el efecto analgésico durante al menos 12 horas.
45. La formulación de liberación sostenida de cualquiera de las reivindicaciones 1-40 para su uso en el tratamiento del dolor.
46. La formulación de liberación sostenida de la reivindicación 41, donde el dolor es dolor crónico.
47. La formulación de liberación sostenida de la reivindicación 41, donde el dolor es dolor nociceptivo, dolor neuropático, dolor visceral o dolor idiopático.
48. El uso de la formulación de liberación sostenida de cualquiera de las reivindicaciones 1-40 para la elaboración de un medicamento para tratar el dolor.
49. El uso de la reivindicación 48, donde el dolor es dolor crónico.
50. El uso de la reivindicación 48, donde el dolor es dolor nociceptivo, dolor neuropático, dolor visceral o dolor idiopático.
Patentes similares o relacionadas:
Dispositivos de administración de fármacos implantables para sitios genitourinarios, del 15 de Julio de 2020, de TARIS Biomedical LLC: Un dispositivo implantable de administración de fármacos que comprende: un depósito de fármaco que tiene una forma alargada […]
Composiciones y métodos no hormonales para la anticoncepción masculina que comprenden (R)-Silodosina, del 1 de Julio de 2020, de Laboratoires Major: Composición para su uso en un método anticonceptivo no hormonal para un sujeto masculino, en la que dicha composición es una formulación de liberación prolongada […]
Métodos para tratar sujetos con síndrome de Prader-Willi o síndrome de Smith-Magenis, del 20 de Mayo de 2020, de ESSENTIALIS, INC: Un agente de apertura del canal KATP para uso en la reducción de uno o más comportamientos agresivos en un sujeto con síndrome de Prader-Willi (PWS), en el que el uso […]
Comunicación inalámbrica para dispositivos médicos sobre el cuerpo, del 13 de Mayo de 2020, de BECTON, DICKINSON AND COMPANY: Un sistema para el suministro de fluidos sobre el cuerpo que comprende: una interfaz de usuario primaria que comprende un reloj de tiempo real de interfaz […]
Formulaciones de liberación controlada de levodopa y usos de las mismas, del 8 de Abril de 2020, de Impax Laboratories, LLC: Formulación sólida oral multiparticulada de liberación controlada que comprende 50 a 600 mg de levodopa y 10 a 80 mg de carbidopa, donde los multiparticulados están en una cápsula […]
Nanopartículas de circulación prolongada para la liberación sostenida de agentes terapéuticos, del 26 de Febrero de 2020, de PFIZER INC.: Una composición de nanopartículas biocompatibles que comprende una pluralidad de nanopartículas de circulación prolongada, comprendiendo cada una: copolímero […]
Composiciones terapéuticas de nanopartículas poliméricas con alta temperatura de transición vítrea o copolímeros de alto peso molecular, del 12 de Febrero de 2020, de PFIZER INC.: Un procedimiento para cribado de suspensiones de nanopartículas para identificar una suspensión que tiene una tasa de liberación de fármaco específica, que comprende: (a) […]
Composición farmacéutica que comprende drospirenona y kit anticonceptivo, del 25 de Diciembre de 2019, de Laboratorios León Farma SA: Kit anticonceptivo que comprende una o más unidades de acondicionamiento, en el que cada unidad de acondicionamiento comprende de 21 a 28 unidades […]