PROCEDIMIENTO PARA LA PREPARACION DE 6BETA,7BETA;15BETA,16BETA-DIMETILEN-5BETA-HIDROXI-3-OXO-17ALFA-ANDROSTANO-21,17-CARBOLACTONA.
Procedimiento para la preparación de 6ß,7ß;15ß,16ß-dimetilen-5ß-hidroxi-3-oxo-17a-androstano-21,
17-carbolactona (5ß-OH-DRSP) por oxidación del 17a-(3-hidroxi-1-propil)-6ß,7ß;15ß,16ß-dimetilen-5ß-androstano-3ß,5,17ß-triol en presencia de cantidades catalíticas de una sal de rutenio
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E01250278.
Solicitante: SCHERING AKTIENGESELLSCHAFT.
Nacionalidad solicitante: Alemania.
Dirección: MULLERSTRASSE 178,13353 BERLIN.
Inventor/es: NICKISCH, KLAUS, MOHR,JIRG-THORSTEN.
Fecha de Publicación: .
Fecha Solicitud PCT: 11 de Agosto de 1997.
Fecha Concesión Europea: 28 de Octubre de 2009.
Clasificación Internacional de Patentes:
- C07J53/00C1C
- C07J53/00C1D
Clasificación PCT:
- C07J53/00 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07J ESTEROIDES (seco-steroides C07C). › Esteroides teniendo la estructura del ciclopenta [a] hidrofenantreno modificada por condensación con ciclos carbocíclicos o por formación de un ciclo adicional por un enlace directo entre dos átomos de carbono cíclicos.
Clasificación antigua:
- C07J53/00 C07J […] › Esteroides teniendo la estructura del ciclopenta [a] hidrofenantreno modificada por condensación con ciclos carbocíclicos o por formación de un ciclo adicional por un enlace directo entre dos átomos de carbono cíclicos.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Lituania, Letonia, Albania.
Fragmento de la descripción:
Procedimiento para la preparación de 6ß,7ß;15ß,16ß-dimetilen-5ß-hidroxi-3-oxo-17a-androstano-21,17-carbolactona.
El invento se refiere a un procedimiento para la preparación de 6ß,7ß;15ß,16ß-dimetilen-5ß-hidroxi-3-oxo-17a-androstano-21,17-carbolactona (5ß-OH-DRSP), que es un producto precursor de la drospirenona.
La drospirenona (6ß,7ß;15ß,16ß-dimetilen-3-oxo-17a-pregn-4-eno-21,17-carbolactona, DRSP, INN = nombre internacional sin propietario) es conocida desde hace mucho tiempo como sustancia activa esteroidea (documentos de patente alemana DE 26 52 761 C2 y de solicitud de patente alemana DE 30 22 337 A1), y la preparación de las últimas 4 etapas se efectúa en un procedimiento conocido como de un solo recipiente
, en el que después de la hidrogenación de dimetilen-propinol no se aísla ninguno de los compuestos intermedios dimetilen-propanol y 5ß-OH-DRSP por los que se pasa (véase el esquema siguiente).
Una síntesis análoga, pero mediando utilización de una oxidación con dicromato de piridinio, es conocida por el estado de la técnica [Angew. Chemie, 21, 9, (1982), páginas 696-697]. Síntesis similares para la preparación de 17,21-carbolactonas esteroideas se describen también en el contexto de los documentos de solicitudes de patentes europeas EP-A-0 075 189 y EP-A-0 051 143, pero con participación de reacciones microbiológicas. Sin embargo, no se divulgan en ellos unas oxidaciones con participación de compuestos de rutenio.
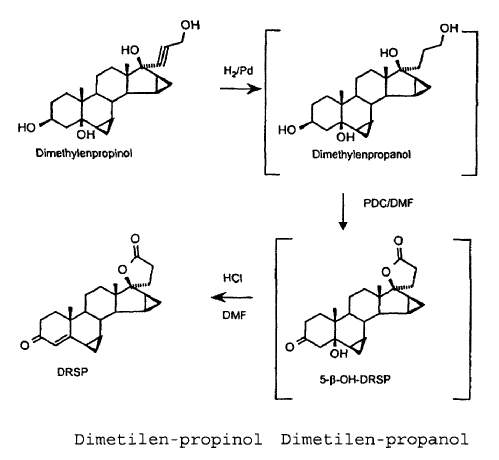
El dimetilen-propinol se hidrogena en el seno de THF con hidrógeno en presencia de paladio sobre carbón, para formar el dimetilen-propanol. La solución de hidrogenación así obtenida, que contiene el propanol como producto principal y proporciones variables de un lactol, se hace reaccionar sin aislamiento ni tratamiento intermedio para formar la drospirenona (DRSP).
Para ello, en primer lugar se efectúa un cambio de disolventes, de THF por DMF, y a continuación el propanol se oxida a 40ºC con un exceso de 3,7 equivalentes de dicromato de piridinio (PDC) para formar una mezcla de DRSP y 5-ß-OH-DRSP. La función 5-ß-OH en el producto de oxidación es inestable frente a ácidos, a ácidos de Lewis y a condiciones básicas a unas temperaturas elevadas, puesto que en todos los casos con la formación de la cetona insaturada en ?-4,5 en la drospirenona se obtiene un producto termodinámicamente más estable. La eliminación de la función ß-OH en la 5-ß-OH-DRSP transcurre hasta formar la drospirenona, que es más estable termodinámicamente, y no se podía reprimir.
La mezcla contiene por regla general unas proporciones variables de ambos componentes, presentándose la 5ß-OH-DRSP por lo general como componente principal en la relación de 2-3:1. En la última etapa de la secuencia en un solo recipiente, la mezcla de dos componentes se transforma en la DRSP, bruta, mediante una adición de ácido clorhídrico semiconcentrado.
En la siguiente tabla se recopilan las últimas cuatro tandas de funcionamiento
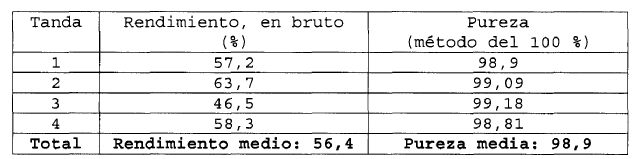
En la media de todas las tandas de funcionamiento, partiendo del dimetilen-propinol, se consigue un rendimiento teórico de 56% de la DRSP, en bruto, con una pureza según la HPLC (cromatografía de líquido de alto rendimiento) de 98,9%.
Es misión del invento poner a disposición un nuevo procedimiento de preparación de la drospirenona, que sea más selectivo y sencillo en su realización que el del estado de la técnica y además de ello sea más ecológico; (con ahorro de una oxidación con trióxido de cromo).
El problema planteado por esta misión se resuelve de acuerdo con la enseñanza de la reivindicación.
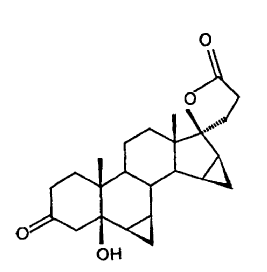
El presente invento comprende un procedimiento para la preparación del producto precursor de la drospirenona (6ß,7ß;15ß,16ß-dimetilen-5ß-hidroxi-3-oxo-17a-androstan-21,17-carbolactona).
El producto de partida del procedimiento reivindicado se prepara por hidrogenación catalítica del 17a-(3-hidroxi-1-propinil)-6ß,7ß;15ß,16ß-dimetilen-5ß-androstano-3ß,5,17ß-triol:
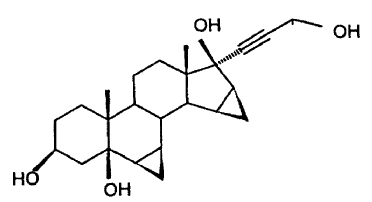
El producto de partida 7a-(3-hidroxi-1-propil)-6ß,7ß;15ß,16ß-dimetilen-5ß-androstano-3ß,5,17ß-triol,
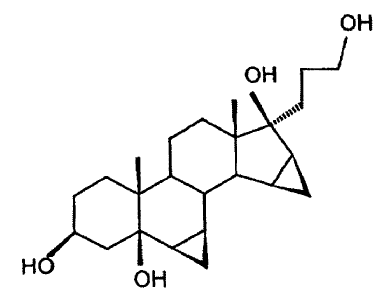
se hace reaccionar conforme al invento por oxidación en presencia de cantidades catalíticas de una sal de rutenio para formar la 6ß,7ß;15ß,16ß-dimetilen-5ß-hidroxi-3-oxo-17a-androstano-21,17-carbolactona
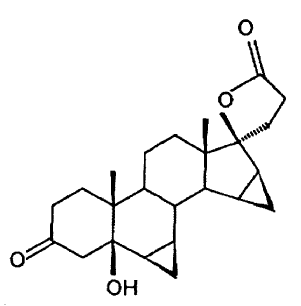
El presente invento se compone de la reacción clave de la oxidación catalizada por rutenio del dimetilen-propanol para formar la 5ß-OH-DRSP.
De manera análoga al procedimiento conocido a partir del estado de la técnica, el dimetilen-propinol se hidrogena en el seno de THF con hidrógeno en presencia de paladio sobre carbón. La solución de hidrogenación se somete a continuación a un cambio de disolventes, de THF por acetonitrilo. La solución en acetonitrilo se oxida con una cantidad catalítica de tricloruro de rutenio (1% en moles) y 3 equivalentes de bromato de sodio a 40-60ºC deliberadamente para formar la 5ß-OH-DRSP.
A pesar de la gran inestabilidad de la 5ß-OH-DRSP frente a ácidos, a ácidos de Lewis tales como por ejemplo los compuestos de cromo en el antiguo procedimiento de realización, a bases fuertes o a altas temperaturas, que en todos los casos se ha atribuir al elevado poder impulsor para la formación de la cetona insaturada en ?-4,5, que es más estable termodinámicamente, en las condiciones seleccionadas de reacción se consigue la síntesis selectiva de la 5ß-OH-DRSP, sin que se pueda observar ninguna formación de drospirenona. La 5ß-OH-DRSP se puede aislar a partir de la solución de reacción mediante una precipitación con agua, que se ha de llevar a cabo de una manera sencilla (desde el aspecto técnico).
Los rendimientos se sitúan en el intervalo de 68% a 75% a lo largo de las dos etapas, de hidrogenación y subsiguiente oxidación.
Una ventaja adicional, muy esencial, del procedimiento conforme al invento con respecto al estado de la técnica, se encuentra en el sector de la ecología. Se ha conseguido reemplazar los tóxicos compuestos de cromo hasta ahora utilizados, que se utilizaban hasta ahora en forma de las sales de PDC para la oxidación y que posteriormente se tienen que evacuar en forma de sus soluciones, por cantidades catalíticas de un metal. Además de ello es posible reciclar la mezcla empleada de acetonitrilo y agua por una destilación azeótropa, por lo que tampoco es de esperar ningún peligro para el medio ambiente.
Ejemplo
6ß,7ß;15ß,16ß-dimetilen-5ß-hidroxi-3-oxo-17a-androstano-21,17-carbolactona
50 g del 17a-(3-hidroxi-1-propinil)-6ß,7ß;15ß,16ß-dimetilen-5ß-androstano-3ß,5,17ß-triol se hidrogenan en el seno de 1.000 ml de THF en presencia de 10 g de paladio (al 10%) sobre carbón y de 3 ml de piridina, hasta que se recojan 2 equivalentes de hidrógeno. A continuación el catalizador se separa por filtración y la solución se concentra hasta sequedad, obteniéndose 52,7 g del 7a-(3-hidroxi-1-propil)-6ß,7ß;15ß,16ß-dimetilen-5ß-androstano-3ß,5,17ß-triol, que se hacen reaccionar ulteriormente sin ninguna purificación.
50,2 g del 7a-(3-hidroxi-1-propil)-6ß,7ß;15ß,16ß-dimetilen-5ß-androstano-3ß,5,17ß-triol se suspenden en 250 ml de acetonitrilo y se calientan a 45ºC. A esto, se añaden gota a gota 0,52 g de tricloruro de rutenio disueltos en 10 ml de agua y 62,46 g de bromato de sodio disueltos en 250 ml de agua. Se sigue agitando durante 2 horas a 50ºC y a continuación la solución se sofoca por adición de 1.000 ml de agua. Se añaden 200 ml de acetato de etilo, las fases se separan y a continuación la fase acuosa se extrae con 600 ml de acetato de etilo. Las fases orgánicas reunidas se secan sobre sulfato de sodio y a continuación se concentran hasta sequedad. En este caso se obtienen 43,44 g de...
Reivindicaciones:
1. Procedimiento para la preparación de 6ß,7ß;15ß,16ß-dimetilen-5ß-hidroxi-3-oxo-17a-androstano-21,17-carbolactona (5ß-OH-DRSP) por oxidación del 17a-(3-hidroxi-1-propil)-6ß,7ß;15ß,16ß-dimetilen-5ß-androstano-3ß,5,17ß-triol en presencia de cantidades catalíticas de una sal de rutenio.
Patentes similares o relacionadas:
18-METIL-19-NOR-ANDROST-4-EN-17,17-ESPIROÉTERES (18-METIL-19-NOR-20-ESPIROX-4-EN-3-ONAS), ASÍ COMO PREPARACIONES FARMACÉUTICAS QUE LOS CONTIENEN, del 28 de Abril de 2011, de BAYER SCHERING PHARMA AKTIENGESELLSCHAFT: 18-metil-15ß,16ß-metilen-19-nor-20-espirox-4-en-3-onas de la fórmula general I **Fórmula** en donde Fórmula I Z es un átomo de oxígeno, dos átomos de hidrógeno, […]
PROCEDIMIENTO PARA LA PREPARACIÓN DE DROSPIRENONA, del 1 de Abril de 2011, de INDUSTRIALE CHIMICA S.R.L.: Procedimiento para la preparación de drospirenona, que comprende la oxidación de 17α-(3-hidroxipropil)6β, 7β,115aβ,16β-dimetilen-5β-androstan-3β,5,17β-triol […]
PROCEDIMIENTO DE PREPARACIÓN DE DROSPIRENONA, del 29 de Marzo de 2011, de NEWCHEM S.P.A: Un procedimiento para la preparación de 6 ,7 ,15 ,16 -dimetilen-3-oxo-17 -pregn-4-en-21,17-carbolactona (I) que comprende las siguientes etapas: 1) hacer reaccionar […]
PROCEDIMIENTO INDUSTRIAL PARA LA PREPARACION DE GAMMA-LACTONA DE ACIDO 17-HIDROXI-6-BETA, 7-BETA, 15-BETA, 16-BETA-BISMETILEN-3-OXO-17-ALFA-PREGN-4-ENO-21-CARBOXILICO E INTERMEDIOS CLAVE PARA ESTE PROCEDIMIENTO, del 27 de Septiembre de 2010, de RICHTER GEDEON NYRT: Procedimiento industrial para la preparación de ?-lactona de ácido 17-hidroxi-6ß,7ß;15ß,16ß-bismetilen-3-oxo-17a-pregn-4-eno-21-carboxílico de fórmula […]
PROCESO PARA LA PREPARACION DE LAMBDA-LACTONA DE ACIDO 17-HIDROXI-6-BETA,7-BETA; 15-BETA,16-BETA-BISMETILEN-17 ALFA-PREGN-4-ENO-3-ONA 21-CARBOXILICO Y DE INTERMEDIOS CLAVE PARA ESTE PROCESO, del 14 de Julio de 2010, de RICHTER GEDEON NYRT: Proceso para la preparación de ?-lactona de ácido 17-hidroxi-6ß,7ß; 15ß,16ß-bismetilen-3-oxo-17a-pregn-4-eno-21-carboxílico de fórmula (I):
18-METIL-19-NOR-17-PREGN-4-ENO-21,17-CARBOLACTONAS, ASI COMO PREPARADOS FARMACEUTICOS QUE CONTIENEN ESTOS COMPUESTOS, del 29 de Diciembre de 2009, de BAYER SCHERING PHARMA AKTIENGESELLSCHAFT: 18-metil-19-nor-17-pregn-4-eno-21,17-carbolactonas de la fórmula general I **(Ver fórmula)** en la que Z significa un átomo de oxígeno, dos átomos de hidrógeno, una […]
Método para la separación de los constituyentes isoprénicos de guayule, del 6 de Noviembre de 2019, de versalis S.p.A: Método para la separación de al menos un constituyente isoprénico de la resina de una planta de guayule y/o de tipo guayule que comprende las etapas de: […]
 Composición farmacéutica que comprende una suspensión acuosa de un derivado de androstano para el tratamiento de afecciones inflamatorias y alérgicas, del 11 de Febrero de 2019, de GLAXO GROUP LIMITED: Una formulación farmacéutica que comprende:
(i) una suspensión acuosa de un compuesto en partículas de fórmula (I)**Fórmula**
o un solvato de […]
Composición farmacéutica que comprende una suspensión acuosa de un derivado de androstano para el tratamiento de afecciones inflamatorias y alérgicas, del 11 de Febrero de 2019, de GLAXO GROUP LIMITED: Una formulación farmacéutica que comprende:
(i) una suspensión acuosa de un compuesto en partículas de fórmula (I)**Fórmula**
o un solvato de […]