Vacunas de VIH basadas en Env de múltiples clados de VIH.
Una composición que comprende cuatro plásmidos diferentes y un vehículo farmacéuticamente aceptable,
en la que:
(a) el primer plásmido comprende una secuencia de ácidos nucleicos que codifica una proteína Env del VIH del clado A,
(b) el segundo plásmido comprende una secuencia de ácidos nucleicos que codifica una proteína Env del VIH del clado B,
(c) el tercer plásmido comprende una secuencia de ácidos nucleicos que codifica una proteína Env del VIH del clado C,
(d) el cuarto plásmido comprende una secuencia de ácidos nucleicos que codifica una proteína de fusión Gag-Pol-Nef del VIH.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2004/030284.
Solicitante: THE GOVERNMENT OF THE UNITED STATES OF AMERICA, as represented by THE SECRETARY, DEPARTMENT OF HEALTH AND HUMAN SERVICES .
Nacionalidad solicitante: Estados Unidos de América.
Dirección: The National Institute of Health, Office of Technology Transfer, 6011 Executive Boulevard, Suite 325 Rockville, MD 20852 ESTADOS UNIDOS DE AMERICA.
Inventor/es: NABEL, GARY, J., YANG,ZHI-YONG, CHAKRABARTI,BIMAL, KONG,WING-PUI, HUANG,YUE.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K39/12 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Antígenos virales.
- A61K39/21 A61K 39/00 […] › Retroviridae, p. ej. virus de la anemia infecciosa equina.
- C07K14/16 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › VIH-1.
PDF original: ES-2388527_T3.pdf
Fragmento de la descripción:
Vacunas de VIH basadas en Env de múltiples clados de VIH
Antecedentes de la invención
Campo de la invención
Esta invención se refiere al campo de las vacunas contra el VIH.
Descripción de la técnica relacionada
Existe una necesidad de una vacuna segura y eficaz contra el virus de inmunodeficiencia humana de mutación constante (VIH) . Un requisito de una vacuna altamente eficaz contra el sida es la necesidad de inducir tanto anticuerpos neutralizadores como inmunidad celular a las numerosas cepas de VIH-1 que circulan por todo el mundo. El tema principal de suministro de un cóctel de múltiples envolturas de distintos aislados de VIH, para intentar alcanzar la protección frente a cualquier aislado del VIH, se conoce en la técnica. Véase, por ejemplo, Immunologic Research, 21, 2000, 7-21, documento WO 97/27311.
Sumario de la invención
La presente invención se refiere a lo siguiente:
1. Una composición que comprende cuatro plásmidos diferentes y un vehículo farmacéuticamente aceptable, en la que:
(a) el primer plásmido comprende una secuencia de ácidos nucleicos que codifica una proteína Env del VIH del clado A,
(b) el segundo plásmido comprende una secuencia de ácidos nucleicos que codifica una proteína Env del VIH del clado B,
(c) el tercer plásmido comprende una secuencia de ácidos nucleicos que codifica una proteína Env del VIH del clado C,
(d) el cuarto plásmido comprende una secuencia de ácidos nucleicos que codifica una proteína de fusión Gag-Pol-Nef del VIH.
2. La composición del punto 1, en la que la proteína Env de cada uno de los clados A, B y C es una proteína gp145 que carece de (a) los dominios de fusión y escisión, y (b) el interespacio entre la héptada (H) 1 y 2.
3. La composición del punto 1 ó 2, en la que el la secuencia de ácidos nucleicos que codifica las proteínas Env y/o Gag-Nef-Pol del VIH comprende codones optimizados para la expresión en un ser humano.
4. Uso de la composición de uno cualquiera de los puntos 1 a 3 para la fabricación de un medicamento para inducir una respuesta inmunitaria contra el VIH en un mamífero.
5. Composición de uno cualquiera de los puntos 1 a 3 para su uso en la inducción de una respuesta inmunitaria protectora contra el VIH en un mamífero.
También se divulga en el presente documento una vacuna de vector vírico o ADN de plásmido de VIH multiclado que incluye componentes de diferentes clados de Env (opcionalmente quimeras de Env) y Gag-Pol- (opcionalmente) Nef de un único clado. Esta vacuna puede incluir además deleciones de V1, V2, V3 o V4 o combinaciones de los mismos. En otro aspecto, en el presente documento se divulgan inmunógenos de envoltura del VIH multiclado.
Breve descripción de los dibujos
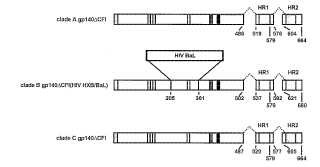
Figura 1. Representación esquemática de vectores de Env del VIH con reemplazos en la región V3. A. El HXB2 del VIH CXCR4-trópico, un gp140ΔCFI de clado B, se realizó como se describe previamente (Chakrabarti, B.K. et al. 2002 J virol 76:5357-5368) . La región más divergente incluidas las regiones V3, de HXB2 del VIH se reemplazó por la región similar de BaL del VIH para preparar HXB/BaL de VIH de clado B trópico R5. El gp140ΔCFI tanto del clado A como del clado C también se realizaron como se describe en Materiales y procedimientos (véase la PARTE I) . B. La expresión de los vectores indicados se confirmó por transfección en 293 células y análisis de bandas Western. Se detectó el Env por bandas de Western con anticuerpo policlonal contra gp160 (Intracel, Rockville, MD) a una dilución de 1:3000.
Figura 2. Inducción de anticuerpos neutralizantes por Env quimérico con sustituciones en la región V3. A. Actividad de anticuerpos neutralizantes de cobayas inmunizadas conHXB2/BaL gp140ΔCFI de VIH. Se sometieron a prueba los sueros inmunitarios para determinar su capacidad para inhibir IIIB de VIH (barras en blanco) y MN de VIH (barras llenas) . La valoración de anticuerpos neutralizantes se define como la dilución de suero que proporciona una neutralización de virus de un 50 % en la destrucción de ensayo de MT2 (Montefiori, D.C. et al. 1988 J Clin Microbiol 26:231-5) . B. Se sometió a prueba los mismos sueros mostrados en la Fig. 2A contra BaL de VIH. Los datos representan el % de neutralización de BaL de VIH por estos sueros a una dilución de 1:4.
Figura 3. Valoración y especificidad de anticuerpos neutralizantes generados en cobayas después de la inmunización con Env de gp145/140ΔCFI. A. Se midió la neutralización específica de V3 de BaL de VIH en células mononucleares de sangre periférica (PBMC) usando muestras de suero que se preincubaron en presencia y ausencia de diferentes péptidos de V3 como se describe previamente (Bures, R. et al. 2000 AIDS Res Hum Retroviruses 16:2019-35) . Se sometieron a prueba los sueros a una dilución de 1:5 en el ensayo de PBMC. B. La actividad neutralizante específica de péptido de V3 inducida por gp145/140ΔCFI de BaL de VIH se detectó por una reducción en la valoración de anticuerpos neutralizantes específicos de MN en presencia de péptidos de V3 de IIIB de VIH o bien BaL de VIH en comparación con el control no tratado. Los ensayos se realizaron en células MT2 como se describe en la sección Materiales y procedimientos de la PARTE I (Montefiori, D.C. et al. 1988 J Clin Microbiol 26:231-5) . La línea discontinua corresponde a un corte de un 50 % considerado positivo para neutralización.
Figura 4. Representación esquemática y expresión de diferentes mutaciones de 2F5/V3 en Env de HXB/BaL ΔCFI de VIH. A. Representación esquemática de gp145ΔCFI derivado de HXB/BaL de VIH de clado B con 2F5 epítopos expresados en V3. Se indican dominios funcionales y motivos estructurales principales, como se describe previamente (Chakrabarti, B.K. et al. 2002 J virol 76:5357-5368) . V1, V2, V3 y V4 se refieren a las regiones variables respectivas, y se muestran las secuencias de los bucles de V3 relevantes. La repetición de héptada 2 (HR-2) , la secuencia peptídica de superhélice corriente arriba del dominio transmembrana en la envoltura R5/clado B, se reemplazó por la región similar del Env de clado C. La secuencia de nucleótidos correspondiente a los aminoácidos en la punta de V3 (GPGRA, SEQ ID NO: 12) se reemplazó por secuencias de nucleótidos correspondientes al polipéptido que contienen el epítopo 2F5 mínimo o bien por secuencias de nucleótidos correspondientes el polipéptido que contiene el epítopo 2F5 extendido. CTRPNNNTRKSIHIGPGRAFYTTGEIIGDIRQAHC (SEQ ID NO: 1) ; CTRPNNNTRKAIHIFYTTGEIIGDlRQAHC (SEQ ID NO: 2) ; LELDKWAS (SEQ ID NO: 3) ; KNEQELLELDKWAS (SEQ ID NO: 4) ; KNEKDLLALDSWRN (SEQ ID NO: 5) . B. Expresión de envolturas de gp140ΔCFI mutantes de 2F5. Se muestran la expresión de los gp140ΔCFI B (C-HR2) o -2F5, gp140ΔCFIΔGPGRA B (C-HR2) o -punta -2F5, gp140ΔCFI B (C-HR2) ext 2F5, V3 ext 2F5, y gp140ΔCFI de clado B indicados. Las proteínas indicadas se detectaron por inmunotransferencia como se describe en la sección Materiales y procedimientos de la PARTE I. Los sobrenadantes libres de células producidos por transfección con vector que no contiene inserción se usaron como controles. C. Análisis de la reactividad de Env modificada de 2F5 con anticuerpo monoclonal, 2F5 e IgG de VIH-1. La unión de
mutantes indicados de gp140ΔCFI o de controles transfectados con vector solo se analizaron por ELISA con
anticuerpo monoclonal 2F5 (panel izquierdo) e IgG de VIH-1 (panel derecho) . Los valores representan la media y la desviación estándar (barras de error) para cada punto.
Figura 5. Respuesta de anticuerpos a péptido de 2F5 en cobayas inmunizadas. Comparación de la respuesta de anticuerpos por ELISA en cobayas inmunizadas con vectores de expresión designados. Se recogieron los sueros 2 semanas después de que se usaran ADN (A.) y refuerzo de ADV (B.) para detectar el anticuerpo que se podía unir con el péptido de 2F5. El suero de un animal inmunizado con el vector de control solo sirvió como control negativo. C. Se
muestra el porcentaje de neutralización de los mutantes de 2F5/V3 en Env de HXB/BaL ΔCFI de VIH frente a un panel
de cepas de clado B de VIH-1 a una valoración de anticuerpos de 1:5. Se examinaron... [Seguir leyendo]
Reivindicaciones:
1. Una composición que comprende cuatro plásmidos diferentes y un vehículo farmacéuticamente aceptable, en la que:
(a) el primer plásmido comprende una secuencia de ácidos nucleicos que codifica una proteína Env del VIH del 5 clado A,
(b) el segundo plásmido comprende una secuencia de ácidos nucleicos que codifica una proteína Env del VIH del clado B,
(c) el tercer plásmido comprende una secuencia de ácidos nucleicos que codifica una proteína Env del VIH del clado C,
(d) el cuarto plásmido comprende una secuencia de ácidos nucleicos que codifica una proteína de fusión Gag-Pol-Nef del VIH.
2. La composición de la reivindicación 1, en la que la proteína Env de cada uno de los clados A, B y C es una proteína gp145 que carece de (a) los dominios de fusión y escisión, y (b) el interespacio entre la héptada (H) 1 y 2.
3. La composición de la reivindicación 1 ó 2, en la que el la secuencia de ácidos nucleicos que codifica las proteínas 15 Env y/o Gag-Nef-Pol del VIH comprende codones optimizados para la expresión en un ser humano.
4. Uso de la composición de una cualquiera de las reivindicaciones 1 a 3 para la fabricación de un medicamento para inducir una respuesta inmunitaria contra el VIH en un mamífero.
5. Composición de una cualquiera de las reivindicaciones 1 a 3 para su uso en la inducción de una respuesta inmunitaria protectora contra el VIH en un mamífero.
Grupo de inmunización de Env
Fig. 20
Patentes similares o relacionadas:
Uso de una proteína accesoria derivada del VIH para la reactivación del VIH latente, del 27 de Mayo de 2020, de Janssen Sciences Ireland Unlimited Company: Una proteína que consiste en los primeros 66 aminoácidos N-terminales (T66) de la proteína accesoria Tat derivada del virus de inmunodeficiencia humana […]
Sal de cloruro de Tat-NR2B9c, del 29 de Enero de 2020, de NoNO Inc: Una sal de cloruro de un péptido que es TAT-NR2B9c (SEQ ID NO:6) o difiere de TAT-NR2B9c en hasta 5 sustituciones, inserciones o deleciones de […]
Direccionamiento de factores de coagulación al TLT-1 en plaquetas activadas, del 23 de Octubre de 2019, de NOVO NORDISK HEALTH CARE AG: Una proteína procoagulante que comprende (i) al menos un factor de coagulación, que es un polipéptido de FVII o un polipéptido de FIX, unido covalentemente […]
Vector dual para la inhibición del virus de la inmunodeficiencia humana, del 16 de Octubre de 2019, de Calimmune Inc: Una célula hospedadora preparada transduciendo una célula hematopoyética con un vector de expresión lentiviral, comprendiendo el vector de expresión lentiviral una primera […]
Antígenos del virus de la inmunodeficiencia humana, vectores, composiciones y métodos de uso de los mismos, del 28 de Agosto de 2019, de Janssen Vaccines & Prevention B.V: Un ácido nucleico que codifica una proteína de la envoltura del VIH sintética que comprende la secuencia de aminoácidos de la SEQ ID NO: 8, o la SEQ ID […]
Procedimiento novedoso y composiciones, del 12 de Junio de 2019, de GLAXOSMITHKLINE BIOLOGICALS S.A.: Uno o más primeros polipéptidos inmunógenos para su uso en un procedimiento de generación de una respuesta inmunológica frente a Mycobacterium spp., en los […]
 Producción rápida de virus de título elevado, del 29 de Mayo de 2019, de ALEXION PHARMACEUTICALS, INC.: Procedimiento de producción de partículas virales, que comprende:
introducir de forma transitoria en una línea celular DF-1 una secuencia de nucleótidos […]
Producción rápida de virus de título elevado, del 29 de Mayo de 2019, de ALEXION PHARMACEUTICALS, INC.: Procedimiento de producción de partículas virales, que comprende:
introducir de forma transitoria en una línea celular DF-1 una secuencia de nucleótidos […]
Vectores y construcciones de liberación de antígenos de virus de la gripe, del 8 de Mayo de 2019, de ALTIMMUNE UK LIMITED: Una construcción de vector fluorocarbonado-antígeno de estructura CmFN--CyHx-(Sp)-R, donde m = 3 a 30, n <= 2m + 1, y = 0 a 15, x <= 2y, […]