Proceso para preparar una formulación estéril de ácido hialurónico de alto peso molecular.
Un proceso para preparar una formulación farmacéutica estéril acuosa lista-para-el- uso compuesta por una salde ácido hialurónico de alto peso molecular (Acido Hialurónico) (HA) de no menos de 0,
5*106 Daltons con unaconcentración especificada, que comprende las etapas de:
- proporcionar una formulación acuosa compuesta por Acido Hialurónico de alto peso molecular a unaconcentración inferior a la concentración especificada;
- pasar dicha formulación acuosa a través de un filtro de un tamaño de poro menor de 0,45 μm y mayor de0,1 μm;
- concentrar dicha formulación acuosa mediante la aplicación de vacío a una presión absoluta inferior a 200milibares y ebullición del agua mientras se mide la concentración de Acido Hialurónico en tiempo real;
- detener el proceso de ebullición en vacío cuando se alcanza dicha concentración especifica de AcidoHialurónico.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/IB2003/003524.
Solicitante: LABORATOIRE MEDIDOM S.A..
Nacionalidad solicitante: Suiza.
Dirección: ENETRIEDERSTRASSE 44 6060 SARNEN SUIZA.
Inventor/es: CARLINO, STEFANO.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/728 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › Acido hialurónico.
- A61K47/36 A61K […] › A61K 47/00 Preparaciones medicinales caracterizadas por los ingredientes no activos utilizados, p. ej. portadores o aditivos inertes; Agentes de direccionamiento o agentes modificadores enlazados químicamente al ingrediente activo. › Polisacáridos; Sus derivados, p. ej. gomas o resinas, almidón, alginato, dextrina, ácido hialurónico, quitosano, inulina, agar o pectina.
- A61K9/00 A61K […] › Preparaciones medicinales caracterizadas por un aspecto particular.
- A61K9/08 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › Soluciones.
- C08B37/00 QUIMICA; METALURGIA. › C08 COMPUESTOS MACROMOLECULARES ORGANICOS; SU PREPARACION O PRODUCCION QUIMICA; COMPOSICIONES BASADAS EN COMPUESTOS MACROMOLECULARES. › C08B POLISACARIDOS; SUS DERIVADOS (polisacáridos que contienen menos de seis radicales sacáridos unidos entre sí por enlaces glucosídicos C07H; procesos de fermentación o procesos que utilizan enzimas C12P 19/00; producción de celulosa D21). › Preparación de polisacáridos no previstos en los grupos C08B 1/00 - C08B 35/00; Sus derivados (celulosa D21).
PDF original: ES-2397382_T3.pdf
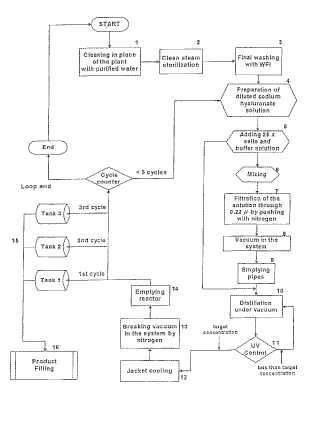
Fragmento de la descripción:
Proceso para preparar una formulación estéril de ácido hialurónico de alto peso molecular
La presente invención se refiere a un proceso para preparar una sal estéril del ácido hialurónico de alto peso molecular como una formulación final para uso farmacéutico.
El acido hialurónico en forma de sal puede incluir por ejemplo hialuronato de sodio, hialuronato de potasio, hialuronato de magnesio, hialuronato de calcio u otras.
El ácido hialurónico es un polisacárido mucoide de origen biológico, que está ampliamente distribuido en la naturaleza. Por ejemplo, se sabe que el ácido hialurónico está presente en varios tejidos animales como cordón umbilical, líquido sinovial, humor vítreo, cresta de gallo y varios tejidos conjuntivos tales como piel y cartílago.
Químicamente, el ácido hialurónico es un miembro de los glicosaminoglicanos y está constituido por unidades alternantes y repetitivas de ácido D-glucurónico y N-acetil-D-glucosamina, para formar una cadena lineal con un peso molecular hasta 13 x 106 Daltons.
En el sentido de la presente invención, el ácido hialurónico de alto peso molecular es el ácido hialurónico que tiene un peso molecular promedio de no menos de 0, 5 x 106 Daltons.
El uso farmacéutico del ácido hialurónico o de una sal derivada del mismo está ampliamente descrito en la literatura.
Debido a que el ácido hialurónico es una sustancia no inmunogénica y tiene propiedades viscoelásticas e hidrofílicas, se utiliza, desde hace varios años, como un sustitutivo del humor vítreo del ojo o líquido de las articulaciones o como un medio de apoyo en cirugía oftálmica, como por ejemplo se divulga en US A-4, 141, 973 de Balazs.
En los líquidos de las articulaciones, la solución viscosa de ácido hialurónico sirve como lubricante para proporcionar una protección ambiental para las células y por esta razón, se utiliza en el tratamiento de las articulaciones de la rodilla inflamada.
La patente EP-A-0 781 547 divulga un hialuronato de sodio según formulación oftálmica para uso en la cirugía ocular.
La patente EP-A-0 719 559 divulga soluciones viscosas de hialuronato de sodio para su utilización como fluido máscara en foto-queratectomía terapéutica mediante láser excimer.
La patente EP-A-0 875 248 divulga el uso de ácido hialurónico o de una de sus sales farmacéuticamente aceptables para la preparación de una solución acuosa útil como líquido de lavado intra-articular.
La patente EP-A-0 698 388 de Chemedica S.A. divulga una preparación oftálmica para el uso como lágrimas artificiales con hialuronato como un espesante de la viscosidad.
El uso farmacéutico de ácido hialurónico o de una sal derivada del mismo requiere un producto altamente puro y estéril.
El ácido hialurónico puede extraerse y purificarse de fuentes animales o microbianas como cordones umbilicales, crestas de gallo o de Estreptococos del grupo A y C, tal como se divulga, por ejemplo, en las patentes US-A4, 141, 973 de Balazs, US-A-5, 559, 104 de Romeo y al. y WO 00/4925.
El proceso industrial de extracción y purificación de ácido hialurónico produce normalmente sales de ácido hialurónico, como hialuronato de sodio, en forma de polvo seco. El polvo seco purificado de calidad farmacéutica puede utilizarse para preparar, por ejemplo, formulaciones farmacéuticas acuosas para diversos usos farmacéuticos tales como inyección interarticular, colirios o sustitución de humor vítreo.
Un proceso industrial común para la preparación de formulaciones farmacéuticas listas-para-el-uso comprende la mezcla de una cantidad definida en peso de hialuronato de sodio con un volumen exacto de agua y sal y dependiendo del caso, como el cloruro de sodio y tampones tales como fosfatos y otros excipientes. Como la concentración y la composición de la formulación para uso farmacéutico deben mantenerse dentro de un rango definido por un estrecho margen, los diferentes componentes de la formulación se miden cuidadosamente. La formulación, a continuación, se introduce en recipientes como jeringas y viales de dosis definidas listos-para-usar. Tras el llenado de los recipientes, la formulación es esterilizada por autoclave típicamente alrededor de 121 °C durante quince minutos o más.
Uno de los problemas con el uso de calor para esterilizar el ácido hialurónico es el efecto conocido en romper las cadenas moleculares que forman el Acido Hialurónico, reduciendo el peso molecular medio de Acido Hialurónico.
El alto peso molecular del ácido hialurónico es una importante propiedad farmacológica.
En muchas aplicaciones farmacéuticas no es conveniente que exista Acido Hialurónico de bajo peso molecular en la formulación, por ejemplo, teniendo en cuenta los efectos inflamatorios del Acido Hialurónico de bajo peso molecular como se divulga en US 4.141.973 y la pérdida de propiedades beneficiosas reológicas de Acido Hialurónico de alto peso molecular. Para compensar la degradación del Acido Hialurónico en una formulación de determinada concentración en los métodos de esterilización mencionados, el ácido hialurónico o sus sales derivadas, inicialmente utilizado en la preparación de la formulación tiene un peso molecular medio que es mayor que el deseado mínimo peso molecular promedio de la formulación final. Esto es, sin embargo, antieconómico debido a que el rendimiento de la producción de ácido hialurónico desde la materia prima disminuye tanto como el peso molecular medio requerido aumenta.
Otro método conocido de esterilización del ácido hialurónico es por filtración. Esta técnica se utiliza en procesos industriales convencionales para preparar sales purificadas del ácido hialurónico en forma concentrada, generalmente en forma de polvo seco, mediante el cual una solución acuosa de baja concentración es pasada por el filtro y posteriormente secada.
Tales medidas de esterilización, se describen en la solicitud de patente europea EP 867453 y aplicación PCT WO 00/44925. En estas solicitudes también se divulga, un filtro para la esterilización con un tamaño de poro tan pequeño como 0, 22 μm. Filtros con un tamaño de poro de 0, 22 μm tienen un reto bacteriano de 1 entre 107 bacterias, basado en la conocida y más pequeña bacteria Pseudomonas diminuta, mientras que filtros con un tamaño de poro de 0, 45 μm tienen un reto bacteriano de 1 entre 104 bacterias (siempre basadas en Pseudomonas diminuta) . Por esta razón, filtros de poro de un tamaño menor de 0, 45 μm se consideran ser de esterilización.
En la WO 93/20858 Acido Hialurónico y descritas soluciones como adhesivos para sustituciones de hueso granular compuestas por ácido hialurónico, esteres de ácido hialurónico o sales antibióticas de ácido hialurónico en combinación con gránulos de hueso. Esta solicitud de patente describe la preparación de soluciones de alta viscosidad de ácido hialurónico de bajo peso molecular, esteres de ácido hialurónico o sal de ácido hialurónico en asociación con antibióticos, previamente esterilizado con rayos gamma, en agua estéril o tampón. La WO 93/20858 describe también un filtro con un tamaño de poro de 0, 22 μm para la esterilización de una solución de ácido hialurónico de bajo peso molecular.
En procesos industriales convencionales, no se conoce la utilización del método de esterilización por filtración para la preparación de formulaciones farmacéuticas de alta viscosidad listas para su uso, ya que en la concentración requerida de Acido Hialurónico en formulaciones acuosas farmacéuticas de alta viscosidad, típicamente en el rango de 1 a 2% peso/volumen, no todo el ácido hialurónico pasa por el filtro de 0, 22 μm. Debido a que esto da como resultado un cambio en la concentración y/o una pérdida de ácido hialurónico, la esterilización por filtración para la preparación de formulaciones farmacéuticas de alta viscosidad lista-para-el-uso es problemática.
En la US 5.093.487, se describe la preparación de una formulación farmacéutica acuosa que incluye hialuronato de sodio de alto peso molecular esterilizado y listo para su uso a través de un filtro de 0, 22 μm. Sin embargo, el método de esterilización descrito en esta patente se basa en un número de pasadas de la formulación acuosa de ácido hialurónico a través del filtro de 0, 22 μm, con el fin de reducir irreversiblemente la viscosidad del ácido hialurónico. La esterilización de una formulación farmacéutica acuosa que incluya Acido Hialurónico en una concentración de 1%
o más es, según esta publicación, posible teniendo en cuenta la reducción de la viscosidad del ácido hialurónico resultante de múltiples... [Seguir leyendo]
Reivindicaciones:
1. Un proceso para preparar una formulación farmacéutica estéril acuosa lista-para-el-uso compuesta por una sal
de ácido hialurónico de alto peso molecular (Acido Hialurónico) (HA) de no menos de 0, 5*106 Daltons con una 5 concentración especificada, que comprende las etapas de:
- proporcionar una formulación acuosa compuesta por Acido Hialurónico de alto peso molecular a una concentración inferior a la concentración especificada;
- pasar dicha formulación acuosa a través de un filtro de un tamaño de poro menor de 0, 45 μm y mayor de 0, 1 μm;
- concentrar dicha formulación acuosa mediante la aplicación de vacío a una presión absoluta inferior a 200
milibares y ebullición del agua mientras se mide la concentración de Acido Hialurónico en tiempo real; 15
- detener el proceso de ebullición en vacío cuando se alcanza dicha concentración especifica de Acido Hialurónico.
2. Proceso según la Reivindicación 1, en donde, después del etapa de la concentración, la formulación farmacéutica es llenada en recipientes estériles listos-para-su-uso o en depósitos estériles y posteriormente llenada en recipientes estériles listos-para-su-us0.
3. Proceso según cualquiera de las Reivindicaciones anteriores, en donde el peso molecular medio de Acido Hialurónico está en el rango de 800’000' a 5'000'000 Daltons. 25
4. Proceso según cualquiera de las Reivindicaciones anteriores, en donde el filtro tiene un tamaño de poro de 0, 22 μm o menos.
5. Proceso según cualquiera de las Reivindicaciones anteriores, en donde la concentración de Acido Hialurónico se 30 mide con un espectrofotómetro de detección de absorción de la radiación de onda en la formulación.
6. Proceso según cualquiera de las Reivindicaciones anteriores, donde los excipientes se agregan a la formulación después de la etapa de filtración y en donde se mide la conductividad de la formulación de Acido Hialurónico en tiempo real hasta que la cantidad de excipientes alcanza el valor requerido.
Patentes similares o relacionadas:
Formulaciones estabilizadas que contienen anticuerpos anti-receptor de interleucina 4 (IL-4R), del 29 de Julio de 2020, de REGENERON PHARMACEUTICALS, INC.: Una jeringuilla precargada que contiene una formulación farmacéutica líquida estable, en la que la formulación farmacéutica líquida comprende: […]
Neuregulina para tratar la insuficiencia cardíaca, del 29 de Julio de 2020, de Zensun (Shanghai) Science & Technology, Co., Ltd: Neuregulina para usar en un método para tratar la insuficiencia cardíaca crónica en un paciente, donde el paciente tiene un nivel plasmático de NT-proBNP […]
Matrices de microagujas obtenidas mediante disolución y colada que contienen un principio activo, del 29 de Julio de 2020, de Corium, Inc: Un método para formar una matriz de microprotusiones, que comprende: (a) dispensar en un molde que tiene una matriz de cavidades correspondientes al negativo […]
Potenciador de la conservación, del 29 de Julio de 2020, de DSM IP ASSETS B.V.: Una composición tópica que comprende fitantriol y eritrulosa.
 Formulaciones de finasterida para la liberación de fármacos en el cabello y el cuero cabelludo, del 29 de Julio de 2020, de POLICHEM SA: Una composición que contiene:
(a) hidroxipropil-quitosano o una sal fisiológicamente aceptable de este en una cantidad de un 0,25 a un 2,0 % […]
Formulaciones de finasterida para la liberación de fármacos en el cabello y el cuero cabelludo, del 29 de Julio de 2020, de POLICHEM SA: Una composición que contiene:
(a) hidroxipropil-quitosano o una sal fisiológicamente aceptable de este en una cantidad de un 0,25 a un 2,0 % […]
Administración intravascular de composiciones de nanopartículas y usos de las mismas, del 29 de Julio de 2020, de ABRAXIS BIOSCIENCE, LLC: Una composición que comprende nanopartículas que comprenden rapamicina y albúmina para su uso en un procedimiento para inhibir la remodelación […]
 Inhibidor de galactósido de galectina-3 y su uso para tratar fibrosis pulmonar, del 29 de Julio de 2020, de Galecto Biotech AB: Un dispositivo adecuado para administración pulmonar en el que dicho dispositivo es un inhalador de polvo seco que comprende una composición que comprende un compuesto de […]
Inhibidor de galactósido de galectina-3 y su uso para tratar fibrosis pulmonar, del 29 de Julio de 2020, de Galecto Biotech AB: Un dispositivo adecuado para administración pulmonar en el que dicho dispositivo es un inhalador de polvo seco que comprende una composición que comprende un compuesto de […]
Composición para el tratamiento de enfermedades isquémicas o trastornos inflamatorios neurogénicos, que contienen el secretoma de células progenitoras neurales como ingrediente activo, del 22 de Julio de 2020, de S-BIOMEDICS: Una composición para uso en el tratamiento de enfermedad cerebrovascular isquémica, cardiopatía isquémica, infarto de miocardio, enfermedad de Alzheimer, enfermedad […]