ESFENISCINAS Y PEPTIDOS ANALOGOS ANTIMICROBIANOS PARA LA CONSERVACION DE LOS ALIMENTOS.
Péptido o un análogo de esfeniscina que presenta una actividad antimicrobiana y que comprende tres enlaces intramoleculares,
y que responde a la fórmula (II) siguiente:
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/FR2003/002041.
Solicitante: CENTRE NATIONAL DE LA RECHERCHE SCIENTIFIQUE (CNRS).
Nacionalidad solicitante: Francia.
Dirección: 3, RUE MICHEL-ANGE,75794 PARIS.
Inventor/es: BULET, PHILIPPE, THOUZEAU,CECILE, LE MAHO,YVON.
Fecha de Publicación: .
Fecha Concesión Europea: 9 de Diciembre de 2009.
Clasificación Internacional de Patentes:
- C07K14/465 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › de aves.
Clasificación PCT:
- A23L3/3463 NECESIDADES CORRIENTES DE LA VIDA. › A23 ALIMENTOS O PRODUCTOS ALIMENTICIOS; SU TRATAMIENTO, NO CUBIERTO POR OTRAS CLASES. › A23L ALIMENTOS, PRODUCTOS ALIMENTICIOS O BEBIDAS NO ALCOHOLICAS NO CUBIERTOS POR LAS SUBCLASES A21D O A23B - A23J; SU PREPARACION O TRATAMIENTO, p. ej. COCCION, MODIFICACION DE LAS CUALIDADES NUTRICIONALES, TRATAMIENTO FISICO (conformación o tratamiento, no enteramente cubierto por la presente subclase, A23P ); CONSERVACION DE ALIMENTOS O DE PRODUCTOS ALIMENTICIOS, EN GENERAL (conservación de la harina o las masas panificables A21D). › A23L 3/00 Conservación de alimentos o de productos alimenticios, en general, p. ej. pasteurización o esterilización, especialmente adaptada a alimentos o productos alimenticios (conservación de alimentos o productos alimenticios en asociación con el envasado B65B 55/00). › Compuestos orgánicos; Microorganismos; Enzimas.
- A23L3/3535 A23L 3/00 […] › Compuestos orgánicos que contienen azufre.
- A61K38/17 A […] › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › que provienen de animales; que provienen de humanos.
Clasificación antigua:
- C07K7/00 C07K […] › Péptidos con 5 a 20 aminoácidos en una secuencia totalmente determinada; Sus derivados.
Fragmento de la descripción:
Esfeniscinas y péptidos análogos antimicrobianos para la conservación de los alimentos.
La presente invención se refiere al campo de la conservación de los alimentos y de la lucha contra las infecciones microbianas, bacterianas y/o fúngicas en el ser humano, el animal o las plantas. Está dirigida a péptidos antimicrobianos que poseen una estructura de beta-defensina, en particular las esfeniscinas y sus análogos, así como a las composiciones que las contienen para prevenir y/o tratar las infecciones por agentes patógenos como los microbios, las bacterias y los hongos así como para la conservación de los alimentos.
Se ha publicado en la técnica anterior que el macho de Pingüino Real es capaz, durante su estancia en tierra para asegurar la última parte de la incubación, de guardar el alimento en su estómago durante más de dos semanas (Gauthier-Clerc et al., 2000). Él mismo ayuna y vive de sus reservas corporales.
No existe actualmente una situación similar conocida de almacenamiento de alimento durante varias semanas en un vertebrado superior. El estado de conservación de este alimento es notable, no modificándose su masa ni su valor energético (Gauthier-Clerc et al., 2002). Estas observaciones sobre el estado de conservación del alimento sugieren fuertemente un control de la flora bacteriana presente en el contenido estomacal. Este control de la flora bacteriana permitiría reducir las degradaciones de la alimentación almacenada. Este control podría hacerse a través de la producción de sustancias con actividad antimicrobiana.
En efecto, la bibliografía relata la existencia de sustancias con actividad antimicrobiana en el tracto gastro-intestinal de los Vertebrados. Una gran parte de estas sustancias tienen naturaleza peptídica, principalmente magaininas, brevininas y buforinas en los anfibios (Moore et al., 1991; Minn et al., 1998; Wang et al., 1998), lactoferricinas y defensinas (a, ß) en los mamíferos, entre ellos el ser humano (Jones & Bevins, 1992; Zhao et al., 1999; O'Neil et al., 2000). En las aves, las defensinas se han encontrado en otras partes del tracto digestivo, principalmente la lengua, el esófago y el intestino (Zhao et al. 2001). Además, numerosos péptidos antimicrobianos están igualmente presentes en el epitelio de superficie (para revisión véase Schröder 1999).
Los inventores han puesto de manifiesto ahora la presencia de péptidos antimicrobianos en el contenido estomacal de los Pingüinos Reales y han mostrado la implicación de estos péptidos con actividad antimicrobiana en el fenómeno de conservación del bolo alimenticio durante el ayuno de incubación en el macho de Pingüino Real. Estos trabajos de investigación han permitido definir nuevos péptidos que se designarán de aquí en adelante "esfeniscinas" según la familia de las Esfeniscidas a la que pertenece el Pingüino Real.
La invención tiene por lo tanto por objeto un péptido o un análogo de esfeniscina que presenta una actividad anti-bacteriana y que comprende tres enlaces intra-moleculares, y que responde a la fórmula (II) siguiente:
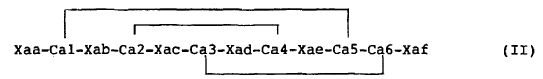
En la que:
Xaa responde a la fórmula siguiente: -Xaa1-Xaa2-(SEQ ID NO.2), en la que Xaa1 representa un grupo -NH2 o un resto peptídico de 1 a 13 aminoácidos, y Xaa2 es Ser-Phe-Gly-Leu;
Xab responde a la fórmula siguiente: -Xab1-Xab2-Xab3-Xab4-Xab5- (SEQ ID NO.3), y Xab3 representa un resto peptídico que responde a la fórmula siguiente: -Xab3.1-Xab3.2-(SEQ ID NO.4),
Xac responde a la fórmula siguiente: -Xac1-Xac2-Xac3-Xac4- (SEQ ID NO.5), en la que Xac2 es His o Arg
Xad con la secuencia siguiente: -Xad1-Xad2-Xad3-xad4-xad5-xad6-Xad7-Xad8-Xad9- (SEQ ID NO.6), en la que Xad2 es Pro o Phe y Xad3 es Pro;
Xae responde a la secuencia siguiente: -Xae1-Xae2-Xae3-Xae4-Xae5- (SEQ ID NO.7), en la que Xae2 es Gln o Arg y Xae5 es Gln;
Xaf responde a la secuencia siguiente: -Xaf1-Xaf2-Xaf3-Xaf4- (SEQ ID NO.8) y Xaf2 y/o Xaf3 es Val; y - Cal, Ca2, Ca3, Ca4, Ca5 y Ca6, son aminoácidos azufrados.
Xab representa un resto peptídico de 6 aminoácidos Xab responde a la fórmula siguiente: -Xab1-Xab2-Xab3-Xab4-Xab5- (SEQ ID NO.3), en la que estos Xab1, Xab2, Xab4 y Xab5 presentes, idénticos o diferentes, se eligen del grupo que comprende aminoácidos básicos, aminoácidos polares cargados negativamente, aminoácidos polares pequeños no cargados, aminoácidos polares grandes no cargados y aminoácidos hidrófobos o apolares, y Xab3 representa un resto peptídico que responde a la fórmula siguiente: -Xab3.1-Xab3.2-(SEQ ID NO.4), en la que estos Xab3.1 y Xab3.2 presentes, idénticos o diferentes, se eligen del grupo que comprende aminoácidos básicos, aminoácidos polares cargados negativamente, aminoácidos polares pequeños no cargados, aminoácidos polares grandes no cargados y aminoácidos hidrófobos o apolares;
Xac representa un resto peptídico que comprende 4 aminoácidos Xac responde a la fórmula siguiente: -Xac1-Xac2-Xac3-Xac4- (SEQ ID NO.5), en la que estos Xac1, Xac3 y Xac4 presentes, idénticos o diferentes, se eligen del grupo que comprende aminoácidos básicos, aminoácidos polares pequeños no cargados, aminoácidos hidrófobos o apolares y aminoácidos polares grandes no cargados y Xac2 es His o Arg
Xad representa un resto peptídico que comprende 9 aminoácidos, Xad responde a la secuencia siguiente: -Xad1-Xad2-Xad3-Xad4-Xad5-Xad6-Xad7-Xad8-Xad9- (SEQ ID NO.6), en la que estos Xad1, Xad4, Xad5, Xad6, Xad7, Xad8 y Xad9 presentes, idénticos o diferentes, se eligen del grupo que comprende aminoácidos básicos, aminoácidos polares pequeños no cargados, aminoácidos hidrófobos o apolares, aminoácidos polares grandes no cargados y aminoácidos polares cargados negativamente; en la que Xad2 es Pro o Phe y Xad3 es Pro
Xae representa un resto peptídico que comprende 5 aminoácidos, ventajosamente Xae responde a la secuencia siguiente: -Xae1-Xae2-Xae3-Xae4-Xae5- (SEQ ID NO.7), en la que estos Xae1, Xae3, Xae4 y presentes, idénticos o diferentes, se eligen del grupo que comprende aminoácidos básicos, aminoácidos polares pequeños no cargados, aminoácidos hidrófobos o apolares, aminoácidos polares grandes no cargados y aminoácidos polares cargados negativamente; en la que Xac2 es Gln o Arg y Xaes es Gln,
Xaf representa un resto peptídico de 4 aminoácidos, ventajosamente Xaf responde a la secuencia siguiente: -Xaf1-Xaf2-Xaf3-Xaf4- (SEQ ID NO.8), en la que estos Xaf1, y Xaf4 presentes, idénticos o diferentes, se eligen del grupo que comprende aminoácidos básicos, aminoácidos polares pequeños no cargados, aminoácidos hidrófobos o apolares, aminoácidos polares grandes no cargados y aminoácidos polares cargados negativamente; y Xaf2 y/o Xaf3 es Val
Ca1, Ca2, Ca3, Ca4, Ca5 y Ca6, idénticos o diferentes, Ca1, Ca2, Ca3, Ca4, Ca5 y Ca6 son aminoácidos azufrados y preferentemente cisteínas.
Ca1 y -Ca5 están unidos por covalencia. Preferentemente:- Xab1 se elige del grupo que comprende aminoácidos básicos, aminoácidos hidrófobos o apolares, aminoácidos polares grandes no cargados, preferentemente Xab1 es un aminoácido básico y muy preferentemente arginina (Arg).
Xab2 se elige del grupo que comprende aminoácidos hidrófobos o apolares, aminoácidos polares pequeños no cargados, aminoácidos básicos, aminoácidos polares grandes no cargados, preferentemente Xab2 es un aminoácido hidrófobo o apolar y muy preferentemente leucina (Leu).
Xab3.2 se elige del grupo que comprende aminoácidos básicos, aminoácidos polares pequeños no cargados y aminoácidos hidrófobos o apolares y muy preferentemente arginina (Arg).
Xab4 se elige del grupo que comprende aminoácidos hidrófobos o apolares, y muy preferentemente Xab4 es glicina (Gly).
rabs se elige del grupo que comprende aminoácidos hidrófobos o apolares, aminoácidos polares grandes no cargados, aminoácidos básicos, aminoácidos polares cargados negativamente, aminoácidos polares pequeños no cargados, preferentemente Xab5 es un aminoácido hidrófobo o apolar y muy preferentemente fenilalanina (Phe).
Ca2 y Ca4 están unidos por covalencia.
Xac1 se elige del grupo que comprende aminoácidos básicos, aminoácidos hidrófobos o apolares, aminoácidos...
Reivindicaciones:
1. Péptido o un análogo de esfeniscina que presenta una actividad antimicrobiana y que comprende tres enlaces intramoleculares, y que responde a la fórmula (II) siguiente:
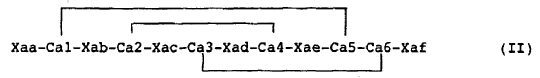
En la que:
- Xaa responde a la fórmula siguiente: -Xaa1-Xaa2-(SEQ ID NO.2), en la que Xaa1 representa un grupo -NH2 o un resto peptídico de 1 a 13 aminoácidos, y Xaa2 es Ser-Phe-Gly-Leu;
- Xab responde a la fórmula siguiente: -Xab1-Xab2-Xab3-Xab4-Xab5- (SEQ ID NO.3), y Xab3 representa un resto peptídico que responde a la fórmula siguiente: -Xab3.1-Xab3.2-(SEQ ID NO.4),
- Xac responde a la fórmula siguiente: -Xac1-Xac2-Xac3-Xac4- (SEQ ID NO.5), en la que Xac2 es His o Arg
- Xad con la secuencia siguiente: -Xad1-Xad2-Xad3-xad4-xad5-xad6-Xad7-Xad8-Xad9- (SEQ ID NO.6), en la que Xad2 es Pro o Phe y Xad3 es Pro
- Xae responde a la secuencia siguiente: -Xae1-Xae2-Xae3-Xae4-Xae5- (SEQ ID NO.7), en la que Xae2 es Gln o Arg y Xae5 es Gln;
- Xaf responde a la secuencia siguiente: -Xaf1-Xaf2-Xaf3-Xaf4- (SEQ ID NO.8) y Xaf2 y/o Xaf3 es Val; y - Ca1, Ca2, Ca3, Ca4, Ca5 y Ca6, son aminoácidos azufrados.
2. Péptido según la reivindicación 1, en el que:
- Xaa es Ser-Phe-Gly-Leu,
- Xab es Arg-Leu-Arg-Arg-Gly-Phe,
- Xac es Ala-Xac2 -Gly-Arg,
- Xad es Arg-Phe-Pro-Ser-Ile-Pro-Ile-Gly-Arg,
- Xae es Ser-Arg-Phe-Val-Gln,
- Xaf es Arg-Arg-Val-Trp, y
- Xac2 es His o Arg.
3. Composición farmacéutica, agroalimentaria o agronómica que comprende como agente activo al menos un péptido según una cualquiera de las reivindicaciones 1 a 2.
4. Composición según la reivindicación 3, caracterizada porque es útil para la conservación de los alimentos.
5. Composición según la reivindicación 4, caracterizada porque es útil para prevenir y/o tratar una infección bacteriana y/o fúngica, en el ser humano, el animal o las plantas.
6. Polinucleótido caracterizado porque codifica un péptido según una cualquiera de las reivindicaciones 1 a 2.
7. Molécula de ácido nucleico, como un vector, que comprende al menos un polinucleótido según la reivindicación 6.
8. Anfitrión, como una célula animal o vegetal o también un procariota, que comprende una molécula de ácido nucleico según la reivindicación 7.
Patentes similares o relacionadas:
Péptidos antimicrobianos basados en CMAP27, del 26 de Abril de 2019, de UNIVERSITEIT UTRECHT HOLDING B.V.: Derivados de CMAP27 que consisten en la secuencia de aminoácidos general RX1GRX2LRKIRRX3X4 en la que X1, X2 y X3 pueden ser independientemente F, L, W […]
ALBUMINAS Y PEPTIDOS CAPACES DE HIDROLIZAR COMPUESTOS ORGANOFOSFORADOS Y CARBAMATOS Y USOS DE LOS MISMOS, del 25 de Enero de 2018, de UNIVERSIDAD MIGUEL HERNANDEZ DE ELCHE: La presente invención divulga la secuencia amino terminal de la albúmina de aves unida a cationes divalentes tales como cobre o zinc, así como cualquier proteína recombinante […]
ALBÚMINAS Y PÉPTIDOS CAPACES DE HIDROLIZAR COMPUESTOS ORGANOFOSFORADOS Y CARBAMATOS, Y USOS DE LOS MISMOS, del 24 de Enero de 2018, de UNIVERSIDAD MIGUEL HERNANDEZ: Albúminas y péptidos capaces de hidrolizar compuestos organofosforados y carbamatos, y usos de los mismos. La presente invención divulga la secuencia […]
Péptidos antimicrobianos basados en CMAP27, del 9 de Noviembre de 2016, de UNIVERSITEIT UTRECHT HOLDING B.V.: Derivados de CAP27 que consisten de la secuencia de aminoácidos general RX1GRX2LRKIRRX3X4 en la que X1, X2 y X3 pueden ser independientemente F, L, W o Y y X4 pueden tener […]
Factor de transferencia a partir de huevos de ave, del 15 de Junio de 2016, de 4LIFE RESEARCH LC: Un método para obtener el factor de transferencia, que comprende: exponer de forma no invasiva un animal de fuente no mamífera a por lo […]
Nuevos péptidos, del 25 de Abril de 2013, de KANGAWA, KENJI: Un compuesto de tipo péptido, que consiste en una secuencia de aminoácidos seleccionada del grupo queconsiste en secuencias de aminoácidos representadas en las SEQ ID NOS: […]
Procedimiento para producir un péptido modificado, del 11 de Abril de 2013, de DAIICHI SANKYO COMPANY, LIMITED: Método para producir un fragmento de péptido protegido que contiene uno o más aminoácidos o noaminoácidos modificados, en el que al menos un aminoácido […]
 CÉLULAS ES MODIFICADAS Y GEN ESPECÍFICO DE CÉLULAS ES, del 13 de Mayo de 2011, de INSTITUT NATIONAL DE LA RECHERCHE AGRONOMIQUE CENTRE NATIONAL DE LA RECHERCHE SCIENTIFIQUE (CNRS) ECOLE NORMALE SUPERIEURE DE LYON: Ácido nucleico purificado o aislado, caracterizado porque comprende una secuencia nucleica seleccionada de entre el grupo de secuencias siguientes: a) SEC ID […]
CÉLULAS ES MODIFICADAS Y GEN ESPECÍFICO DE CÉLULAS ES, del 13 de Mayo de 2011, de INSTITUT NATIONAL DE LA RECHERCHE AGRONOMIQUE CENTRE NATIONAL DE LA RECHERCHE SCIENTIFIQUE (CNRS) ECOLE NORMALE SUPERIEURE DE LYON: Ácido nucleico purificado o aislado, caracterizado porque comprende una secuencia nucleica seleccionada de entre el grupo de secuencias siguientes: a) SEC ID […]