DETECCION DE CANCER.
SE DESCRIBE UN METODO PARA DETECTAR EL CANCER EN UN PACIENTE QUE COMPRENDE LOS PASOS DE INTRODUCCION DE UNOS ANTICUERPOS ETIQUETADOS O UN AFP ETIQUETADO EN UNA MUESTRA BIOLOGICA DEL PACIENTE DE FORMA QUE LOS ANTICUERPOS ETIQUETADOS O EL AFP ETIQUETADO REACCIONARAN CON LOS LUGARES DE UNION DEL RECEPTOR AFP EN LA MUESTRA BIOLOGICA.
DESPUES, SIGUE EL PASO DE IDENTIFICACION DE LOS LUGARES DE UNION DEL RECEPTOR AFP EN EL MATERIAL BIOLOGICO QUE SON REACCIONADOS CON LOS ANTICUERPOS ETIQUETADOS O AFP ETIQUETADO PARA DETERMINAR LA PRESENCIA DE CANCER. SE PREFIERE QUE, ANTES DE LA INTRODUCCION DE ESTE PASO, HAYA UN PASO DE OBTENCION DE UNA MUESTRA BIOLOGICA DEL CUERPO DE UN PACIENTE. UN METODO DE TRATAMIENTO DE LAS CELULAS CANCEROSAS EN UN PACIENTE QUE COMPRENDE LOS PASOS DE INTRODUCCION DE UNOS ANTICUERPOS DEL RECEPTOR AFP EN LAS CELULAS CANCEROSAS DEL PACIENTE. DESPUES, SIGUE EL PASO DE REACCIONAR LOS ANTICUERPOS DEL RECEPTOR AFP CON EL RECEPTOR AFP DE LAS CELULAS CANCEROSAS PARA INHIBIR EL CRECIMIENTO DE LAS CELULAS CANCEROSAS O EXTERMINAR LAS CELULAS CANCEROSAS. UN METODO DE SEGUIMIENTO DEL PACIENTE QUE COMPRENDE LOS PASOS DE TRATAMIENTO DEL PACIENTE PARA EL CANCER, A LO QUE SIGUE EL PASO DE REVISAR AL PACIENTE CON UNOS INTERVALOS PREDETERMINADOS DESPUES DEL TRATAMIENTO PARA LOS NIVELES DE LOS LUGARES DEL RECEPTOR DE AFP. UN METODO DE TRATAMIENTO DE UN PACIENTE QUE COMPRENDE LOS PASOS DE REVISION DEL PACIENTE PARA EL RECEPTOR AFP, A LO QUE SIGUE EL PASO DE INTRODUCCION DE ANTICUERPOS DEL RECEPTOR AFP O AFP EN EL PACIENTE PARA QUE REACCIONEN CON LAS CELULAS CANCEROSAS EN EL PACIENTE SI LA REVISION INDICA QUE SE ENCUENTRAN EN EL PACIENTE UN RECEPTOR AFP. UN METODO DE TRATAMIENTO DE CELULAS CANCEROSAS EN EL PACIENTE QUE COMPRENDE LOS PASOS DE INTRODUCCION DE UN AFP MODIFICADO EN LAS CELULAS CANCEROSAS DEL PACIENTE, A LO QUE SIGUE EL PASO DE REACCIONAR EL AFP MODIFICADO CON EL RECEPTOR AFP DE LAS CELULAS CANCEROSAS PARA INHIBIR EL CRECIMIENTO DE LAS CELULAS CANCEROSAS O ELIMINAR LAS CELULAS CANCEROSAS
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/IB95/00902.
Solicitante: MORO, RICARDO J.
Nacionalidad solicitante: Canadá.
Dirección: 2475 QUEENS AVENUE,WEST VANCOUVER, BRITISH COLUMB.
Inventor/es: MORO,RICARDO J.
Fecha de Publicación: .
Fecha Concesión Europea: 18 de Noviembre de 2009.
Clasificación Internacional de Patentes:
- A61K47/48T2C
- A61K51/10B30
- C07K16/30 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 16/00 Inmunoglobulinas, p. ej. anticuerpos mono o policlonales. › de células tumorales.
- G01N33/574R
Clasificación PCT:
- A61K47/48
- G01N33/566 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › utilizando un soporte específico o proteínas receptoras como reactivos para la formación de uniones por ligando.
- G01N33/567 G01N 33/00 […] › utilizando un extracto de tejido o de órgano como agente de unión.
- G01N33/574 G01N 33/00 […] › para el cáncer.
- G01N33/577 G01N 33/00 […] › en los que interviene anticuerpos monoclonados.
Clasificación antigua:
- A61K47/48
- G01N33/566 G01N 33/00 […] › utilizando un soporte específico o proteínas receptoras como reactivos para la formación de uniones por ligando.
- G01N33/567 G01N 33/00 […] › utilizando un extracto de tejido o de órgano como agente de unión.
- G01N33/574 G01N 33/00 […] › para el cáncer.
- G01N33/577 G01N 33/00 […] › en los que interviene anticuerpos monoclonados.
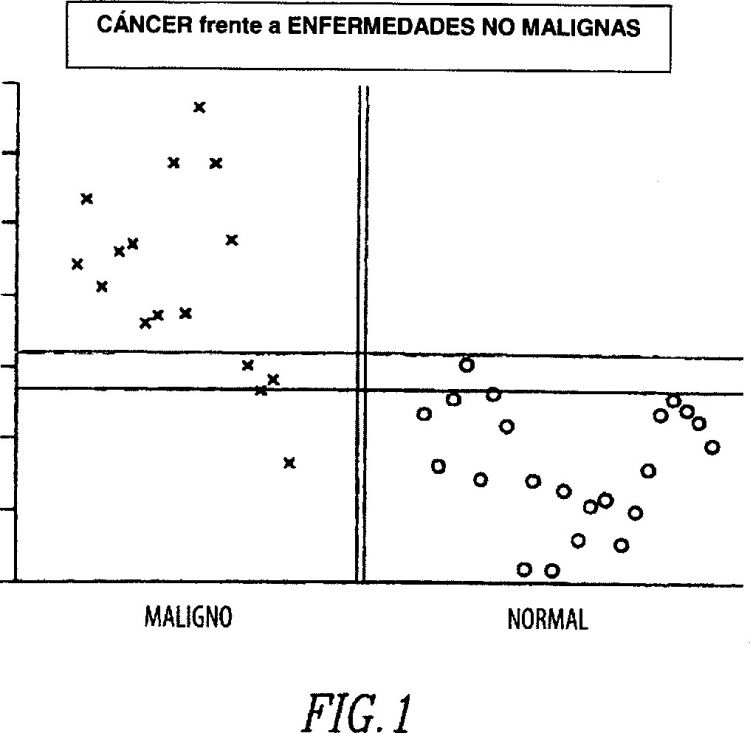
Fragmento de la descripción:
Detección de cáncer.
Esfera del invento
El presente invento está relacionado con la detección del cáncer. Mas específicamente, el presente invento utiliza la existencia de un receptor AFP como base para detectar cáncer en un paciente.
Antecedentes del invento
Hace veinte años atrás, Abelev et al. reportaron la existencia del primer antígeno oncofetal, alfa-fetaproteína (AFP) [Abelev, G. I., Perova, S. D., Khramkova, N. I., Postnikova, Z. A. e Irlin, I. S., Transplante 1. 174 (1963)]. Aunque esta es la proteína de mayor circulación durante la vida fetal, casi desaparece después del nacimiento, siendo su concentración normal de suero como adulto menor de 50 ng/ml [Rouslahti, E. y Seppals, M., Int. J. Cáncer 8, 374 (1971)]. Sin embargo, en ciertas enfermedades malignas tales como hepatocarcinomas o teratocarcinomas, los niveles de plasma pueden ser mil veces superiores [Rouslahti, E. y Seppals, M., M. Adv. Cáncer Res. 29, 275 (1979)]. Este descubrimiento no solo llamó la atención de clínicos, quienes vislumbraron un nuevo medio para detectar malignidad y monitorear pacientes de cáncer, sino también el interés de investigadores que estudiaban la fisiología de esa proteína durante la vida fetal.
Uno de los primeros parámetros estudiados fue la distribución del AFP dentro del embrión. Utilizando métodos de inmunoperoxidasa, Benno y Williams describieron la distribución de AFP en el cerebro del la rata en desarrollo [Benno, R. H. y Williams. T. H., Brain Res. 142, 1982 (1978)]. Poco después, una serie de ensayos reportaron la localización de proteínas de plasma dentro de la células nerviosas en desarrollo de varias especies incluyendo pájaros y humanos [Trojan, J. y Uriel, J., J. Oncodevelop. Biol. Med. 1, 107 (1980); Uriel, J., Trojan, J., Dubouch, P. y Pieiro, A., Path. Biol. Med. 2, 391 (1981); Dziegielewska, K. M., Evans, C. A. N., Lorscheider, E. L., Malinowska, D. H., Mollgard, K., Reynolds, M. L. y Saunders, N. R., J. Physiol! 318, 239 (1981); Mollgard, K., Jacobsen, M., Krag-Jacobsen, G., Praetorius-Claussen, P. y Saunders, N. R., Neurosci. Lett. 14, 85 (1979)]. Para un tejido u órgano dado, la cinética de tinción de la AFP y SA sigue un patrón bastante constante en distintas especies [Uriel, J., Trojan, J., Moro, R. y Pieiro, A., Ann. N. Y. Acad. Sci. 417, 321 (1983)]. Cuando una estructura nerviosa en muy inmadura, no se detecta ninguna AFP o SA intercelular. Luego, repentinamente, y por un cierto período de tiempo dependiendo de las especies, ambas proteínas son observadas simultáneamente, aún dentro de la misma célula [Torand-Allerand, C. D., Nature 286, 733 (1980)]. Subsecuentemente, la intensidad de tinción se desvanece y las células positivas se tornan escasas, primero para la AFP y luego para la SA. Las estructuras maduras so negativas para ambas proteínas. Otros constituyentes del suero, tales como IgG, u ovoalbúmina en embriones de pollos, nunca son encontrados durante la vida fetal dentro de células neurales, a pesar de estar presente en el fluido cerebroespinal [Fielitz, W., Esteves, A. y Moro, R., Dev. Brain Res. 13, 111 (1984)].
Incorporación de AFP por parte de células embriónicas
Una pregunta que surge de estas observaciones iniciales es si la AFP y SA fueron incorporadas de fuentes extracelulares o sintetizadas in-situ. Mientras no es claro aún si células neurales son capaces de sintetizar plasma proteínas [Ali, M., Raul, H. y Sahib, M., Dev. Brain Res. 1, 618 (1981); Ali, M., Mujoo, K. y Sahib, M., Dev. Brain Res. 6. 47 (1983); Schachter, B. S. y Toran-Allerand, C. D., Dev. Brain Res. 5, 95 (1982); Pieiro, A., Calvo, M., Iguaz, F., Lampreave, F. y Naval, J., Int. J. Biochem. 14, 817 (1982)], ha sido demostrado, tanto in-vitro [Uriel, J., Faivre-Bauman, A., Trojan, J. y Foiret, D., Neurosci. Lett. 27, 171 (1981); Hajeri-Germond, M., Tojan, Uriel, J. y Hauw, J. J., Dev. Neurosci. 6, 111 (1984)] como in-vivo [Villacampa, M. J., Lampreave, F., Calvo, M, Pieiro, A. y Uriel, J., Dev. Brain Res. 12, 77 (1984); Moro, R., Fielitz, W., Grunberg, J. y Uriel, J., Int. J. Dev. Neurosci. 2, 143 (1984)], que neuroblastos pueden fácilmente incorporar AFP y suero albúmina de fuentes extracelulares. Los experimentos in-vivo fueron realizados con proteínas homólogos y heterólogos. En el primer caso [Villacampa, M. J., Lampreave, F., Calvo, M, Pieiro, A. y Uriel, J., Dev. Brain Res. 12, 77 (1984)], fue demostrado que al ser inyectado en ratas grávidas, 125I-AFP se localizó en el cerebro fetal, como así también en otros órganos fetales tales como el intestino, la piel y la lengua, órganos en los cuales ya había sido reportado la existencia de AFP intracelular nativa [Trojan, J. y Uriel, J., Oncodev. Biol. Med. 3, 13 (1982)]. El segundo juego de experimentos [Moro, R., Fielitz, W., Grunberg, J. y Uriel, J., Int. J. Dev. Neurosci. 2, 143 (1984)] mostró que cuando se inyectaba suero de rata neonata en la cavidad mesencefálica de embriones de pollo, se podía detectar AFP de rata y SA de rata en el mismo lugar que sus contrapartes nativas. Esto también indicó que la AFP y SA de una especie fue asumida por células de otra especie, así apuntando a estructuras y mecanismos conservadas a lo largo de la evolución. Esto, a su vez, sugiere que un principio biológico básico está involucrado.
A pesar de alta concentración de IgG de rata inyectada, la tinción de esta proteína fue negativa. Esto no fue el resultado de su alto peso molecular (150,000) que podría dificultar una difusión pasiva, ya que tampoco se pudo detectar ovoalbúmina (peso molecular=43,000), aún cuando fuera inyectado a doble de la concentración molar normal de AFP en el fluido cerebroespinal embriónico [Fielitz, W., Esteves, A. y Moro, R., Dev. Brain Res. 13, 111 (1984)]. Esta selectividad favoreció la hipótesis de un mecanismo de endocitosis mediador receptor específico [Moro, R., y Uriel, J., J. Oncodevelop. Biol. Med. 2, 391 (1981); Moro, R., Fielitz, W., Grunberg, J. y Uriel, J., Int. J. Dev. Neurosci. 2, 143 (1984)].
La incorporación de AFP depende de la diferenciación de células
Sin embargo, hasta este momento no era claro si la absorción de AFP y SA era un fenómeno célula-dependiente, o si la tinción desaparecía como resultado de una disponibilidad baja de proteína extracelular debido al cierre de la barrera entre cerebro y sangre o debido a la baja concentración de AFP en circulación al final de la vida fetal. Fue demostrado, primero en pollos [Moro, R., Neurosci. Lett. 41, 253 (1983)] y luego en embriones humanos [Jacobsen, M., Lassen, L. C. y Mollgard, K., Tumor Biol. 5, 55 (1984)], que las células ganglionares neurales espinales realizan el ciclo completo de tinción negativo-positivo-negativo de AFP antes de lograrse el pico máximo de suero. Mas aún, cuando el AFP se torna detectable, la SA continúa presente por un tiempo, así indicando que estas proteínas de suero tiene acceso a neuroblastos ganglionares
Receptores de AFP en células inmaduras
La absorción de AFP por las células sugiere la existencia de un receptor específico cuya expresión esta regulada de acuerdo con el grado de diferenciación de la célula. [Uriel, J., Trojan, J., Moro, R. y Pieiro, A., Ann. N. Y. Acad. Sci. 417, 321 (1983); Moro, R., Neurosci. Lett. 41, 253 (1983)]. Un informe previo [Uriel, J., Bouillon, D., Russel, C. y Dupiers, M., Proc. Nat. Acad. Sci. U.S.A. 73, 1452 (1976)] mostró la presencia de dos fracciones de ultracentrifugación conteniendo AFP en el medio líquido del citoplasma [citosol] uterino de ratas inmaduras; una fracción 4s, correspondiendo íntegramente a AFP, y una fracción 8s en la cual la detección inmunológica de AFP fue solamente posible luego de un tratamiento con 0.4 M KCl. Este tratamiento transformó la fracción 8s en una fracción 4s. Es muy probable que la fracción 8s correspondió a un complejo receptor-AFP, que fue desasociado a altas concentraciones de KCl, aunque el concepto de receptor-AFP aún no había sido concebido en ese tiempo. Esta disociación del complejo receptor-AFP con KCl también fue observado por Smalley y Sarcione [Smalley, J. R. y Sarcione, E. J., Bioch. Biohys. Res. Comm. 94, 1429 (1980)] quien también proveyó evidencia que la molécula AFP podía ser sintetizada por células uterinas inmaduras de ratas.
La expresión del receptor de AFP en células cancerígenas
Ya que las células cancerígenas comparten un número de características bioquímicas y antigénicas con las células fetales [Uriel, J., Adv. Cáncer Res. 29, 127 (1979)], es posible que células malignas, derivadas de tejidos que incorporan AFP durante su vida fetal, puedan re-expresar el correspondiente receptor y así absorber...
Reivindicaciones:
1. Un método para detectar la presencia de un tumor canceroso en un paciente humano, que comprende los pasos de
introducir anticuerpos anti-receptor de a-fetoproteína (anticuerpos anti-AFPr) marcados en una muestra biológica de un fluido corporal obtenido del paciente para que unan receptor de a-fetoproteína (AFPr) soluble en la muestra biológica, y
determinar el nivel de reacción de AFPr soluble en la muestra biológica con los anticuerpos anti-AFPr para detectar la presencia del tumor canceroso en el paciente;
en donde el fluido corporal es sangre, saliva o suero y el tumor está en el ovario, ganglio linfático, extremidad, tejido blando, estómago, abdomen, útero, vejiga, próstata, recto, colon, pelvis, cerebro, pulmón, hígado, riñón o hueso.
2. Un método como se reivindica en la reivindicación 1, en donde los anticuerpos están marcados con un radioisótopo.
3. Un método como se reivindica en la reivindicación 1, en donde los anticuerpos están marcados con una enzima.
4. Un método como se reivindica en la reivindicación 1, en donde los anticuerpos están marcados con un fluorocromo.
5. Un método como se reivindica en la reivindicación 1, en donde los anticuerpos son anticuerpos monoclonales.
6. Un método como se reivindica en la reivindicación 1, en donde los anticuerpos son anticuerpos policlonales.
7. Un método como se reivindica en la reivindicación 1, en donde la muestra biológica es sangre.
8. Un método como se reivindica en la reivindicación 1, en donde la muestra biológica es suero.
Patentes similares o relacionadas:
Composiciones para la supresión del cáncer por inhibición de TMCC3, del 29 de Julio de 2020, de Development Center For Biotechnology: Un anticuerpo contra la proteína con dominios de superhélice transmembrana 3 (TMCC3), o un fragmento de unión de la misma, en donde el anticuerpo […]
Método para producir inmunoconjugados de anticuerpo-SN-38 con un enlazador CL2A, del 22 de Julio de 2020, de IMMUNOMEDICS, INC.: Un método para producir un compuesto, CL2A-SN-38, que presenta la estructura, **(Ver fórmula)** que comprende realizar un esquema de reacción como el que se muestra: **(Ver […]
Bloqueo de CD73, del 22 de Julio de 2020, de Innate Pharma: Un anticuerpo aislado que específicamente se une a un polipéptido CD73 humano en la superficie de una célula y que tiene capacidad de neutralizar […]
Método para purificar anticuerpos, del 8 de Julio de 2020, de UNITED THERAPEUTICS CORPORATION: Método para purificar una composición biológica, que comprende someter a diafiltración la composición biológica con solución salina tamponada con fosfato (PBS) para […]
Redirectores de células T específicas de antígenos, del 1 de Julio de 2020, de THE JOHNS HOPKINS UNIVERSITY: Una nanoparticula que comprende en su superficie: (A) un anticuerpo que se une especificamente a un antigeno de celula diana o epitopo del mismo; y (B) un resto […]
Conjugados fármaco-anticuerpo anti-lrrc15 humano y métodos para su uso, del 17 de Junio de 2020, de AbbVie Inc: Un conjugado de farmaco-anticuerpo anti-huLRRC15 ("ADC") que comprende un agente antimitotico unido a un anticuerpo anti-huLRRC15 por medio de un conector, en donde […]
Cadenas ligeras comunes y procedimientos de uso, del 3 de Junio de 2020, de F. HOFFMANN-LA ROCHE AG: Una molécula de unión a antígeno biespecífica activadora de linfocitos T que comprende un primer y un segundo resto de unión a antígeno, en la que el primer resto […]
Anticuerpos anti-CD3 y métodos de uso, del 27 de Mayo de 2020, de GENENTECH, INC.: Un anticuerpo biespecífico que comprende un brazo anti-CD3 que comprende un primer dominio de unión que comprende (a) un dominio VH que comprende una secuencia de aminoácidos […]