Proceso para la preparación de un concentrado del FV con virus inactivados que se inicia a partir del suero humano, a un nivel de escala industrial.
Un proceso de purificación de FV que comienza a partir de plasma humano o una fracción intermedia enriquecida en FV,
en el que la proteína está intacta; dicho proceso comprende dos etapas de cromatografía sobre intercambiadores aniónicos débiles, en el que la primera etapa se lleva a cabo en modo de "no unión", para separar el FV de otros factores de coagulación mientras que la segunda etapa es en modo "captura" de FV; en el que ambos intercambiadores aniónicos débiles de las dos etapas de cromatografía pertenecen a la categoría de intercambiadores débiles que se caracterizan por el grupo funcional dietilaminoetilo (DEAE); en el que las dos etapas de cromatografía están separadas por al menos una etapa de inactivación vírica que se lleva a cabo por un tratamiento disolvente-detergente y en el que tras la segunda etapa de cromatografía, la solución que contiene el FV se somete a una etapa de eliminación vírica por nanofiltración.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2012/057262.
Solicitante: KEDRION S.P.A.
Nacionalidad solicitante: Italia.
Dirección: Localita' ai Conti 5 55051 Castelvecchio Pascoli - Barga ITALIA.
Inventor/es: FARINA,CLAUDIO, MORI,FILIPPO, NARDINI,ILARIA, ROSSI,PAOLA, GIOVACCHINI,PIERANGELO.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07K1/18 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 1/00 Procedimientos generales de preparación de péptidos. › Cromatografía de intercambio iónico.
- C07K14/745 C07K […] › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › Factores de coagulación sanguínea o de fibrinolisis.
PDF original: ES-2547425_T3.pdf
Fragmento de la descripción:
Proceso para la preparación de un concentrado del FV con virus inactivados que se inicia a partir del suero humano, a un nivel de escala industrial
Campo de la invención
La presente invención se refiere al campo de productos sanguíneos, en particular a la purificación del FV humano. En particular se refiere a la obtención de un concentrado de FV adecuado para el tratamiento de patologías asociadas con deficiencias/cambios en esta proteína.
Estado de la técnica
El factor V tiene un papel esencial en la cascada de coagulación sanguínea. Después de su activación por la trombina y el FXa, actúa como un cofactor de FXa por sí mismo en el complejo protrombinasa, dando como resultado un aumento significativo de la tasa de generación de trombina. La actividad de FVa entonces se regula negativamente por hidrólisis por APC. Además de esta función pro-coagulante, el FV actúa también como un anticoagulante: la hidrólisis de la cadena sencilla de FV por APC convierte el FV en una molécula que actúa como un cofactor de APC por sí mismo en la activación de FVIIIa.
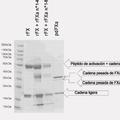
Aproximadamente el 80% del FV circula en el plasma a una concentración de 7-10 µg/ml; el 20% restante se acumula en los -gránulos de las plaquetas. El FV del plasma se sintetiza en los hepatocitos como un procofactor de cadena sencilla con un PM de 330 KDa; la fracción plaquetaria, parcialmente proteolisada y asociada con multimerina, se sintetiza parcialmente en los megacariocitos y se absorbe parcialmente del plasma por endocitosis. Estructuralmente, la cadena FV sencilla se organiza en los dominios estructurales A1-A2-B-C1-C2; la eliminación del dominio B genera el FVa, que está compuesto por dos cadenas que se mantienen unidas por enlaces no covalentes y se estabilizan por iones Ca++. En particular, la hidrólisis por FXa y trombina en los restos de aminoácidos Arg709, Arg1018 y Arg1545, da como resultado la liberación de FVa que consiste en una cadena pesada, con un PM de 105 KDa, y una cadena ligera con un PM de 74-71 KDa. La regulación negativa por APC se consigue entonces por medio de proteolisis en los restos Arg506, Arg306 y Arg679; se consigue un mecanismo alternativo de inactivación del FV mediado por trombina por hidrólisis en la Arg643 en presencia de células endoteliales. La hidrólisis de la cadena sencilla de FV por APC en la Arg506 convierte el FV en una molécula con actividad anticoagulante.
Las formas de FV resistentes a APC se describen en la bibliografía, tal como FV-Leiden, FV-Cambridge y FV-Hong Kong, dando como resultado la prolongación de la actividad de FVa, que se asocia con la aparición de fenómenos trombóticos. También se conoce otra forma de trastorno de coagulación, que se atribuye a la deficiencia de FV, y por lo tanto que se caracteriza por episodios hemorrágicos. Más precisamente, la Parahemofilia, una patología extremadamente rara con una incidencia de 1 caso por cada 1.000.000, que se clasifica entre los Trastornos de Coagulación Heredados Recesivamente (RICD) , que se reconoce como un defecto congénito de FV cualitativo (Tipo II) o cuantitativo (Tipo I) , que se transmite de manera autosómica recesiva. La deficiencia de FV adquirida también es posible como consecuencia del desarrollo de inhibidores, que en general aparecen por el uso tópico de trombina bovina, patologías reumáticas o tratamientos con antibióticos. Como una parte del FV circulante está contenido dentro de los -gránulos de las plaquetas, se puede producir también una reducción de su concentración en el caso de cambios de las últimas. Las manifestaciones clínicas de la deficiencia de FV, que se atribuyen a la función pro-coagulante de esta proteína, varían en extensión y frecuencia, y están representadas principalmente por hemorragias cutáneas y mucocutáneas, y también por hemorragia muscular, hemartrosis, episodios hemorrágicos genitourinarios, gastrointestinales y del SNC. Otra patología relacionada es la deficiencia congénita asociada con el Factor V y el Factor VIII, que por sí misma también es una enfermedad hemorrágica muy rara, en la que hay una reducción simultánea de la concentración de ambos factores, generalmente entre un 5% y 20% de los niveles plasmáticos normales. En este caso, la causa principal de la patología está representada por un defecto en un único gen que produce la alteración del transporte de los dos factores celulares hepáticos en la circulación sanguínea. La sintomatología hemorrágica es similar a la que se observa en la deficiencia de FV, pero con un aumento de la frecuencia de hemartrosis (el 50% de los casos) .
La escasez de las patologías asociadas con la deficiencia de FV se refleja en un progreso terapéutico lento. Además, la terapia de remplazo para pacientes afectados de parahemofilia y deficiencia combinada de Factor V y Factor VIII actualmente se basa solo en el uso de Plasma Nuevo Congelado (FFP) . Sin embargo el uso de FFP no representa un tratamiento ideal debido a los efectos secundarios resultantes, principalmente el aumento de volumen de plasma, la necesidad de un cuidadoso control y la posible administración de diuréticos, y el riesgo de infección vírica.
Las posibles alternativas incluyen el uso de agentes antifibrinolíticos, que solo son eficaces en el tratamiento de hemorragias menores, o la administración de rFVIIa y FEIBA, que sin embargo no constituyen un tratamiento específico, y que a veces da lugar a un riesgo de trombosis.
La disponibilidad de un concentrado de FV, con un buen nivel de pureza y seguro desde el punto de vista vírico, podría por lo tanto ofrecer una alternativa terapéutica más eficaz y dirigida en el tratamiento de las deficiencias de FV.
Debido a la falta de interés en el desarrollo de productos que contuvieran FV purificado, actualmente no hay procesos de purificación que consistan en un número limitado de etapas que hagan posible obtener buenos rendimientos de FV adecuados para la producción de dicha proteína a escala industrial.
En el fraccionamiento tradicional, no existen etapas en las que haya un enriquecimiento del FV, de esta manera se han desarrollado numerosos procesos de purificación que en la mayoría de los casos hace posible obtener FV del plasma o sobrenadante crio-agotado. Los métodos de purificación de FV descritos en la bibliografía casi siempre prevén el uso de numerosas etapas, muchas de las cuales consisten en etapas de precipitación con excipientes que a menudo son difíciles de eliminar del producto final, y/o el uso de métodos cromatográficos caros que no están fácilmente disponibles, tales como los que implican inmunoafinidad.
Los primeros intentos de purificación FV descritos en la bibliografía prevén el uso de los métodos clásicos de precipitación en hidróxido de aluminio y cloruro de bario. Casi todos los estudios prevén el uso de PEG, frecuentemente en combinación con otras etapas de precipitación. Dichas precipitaciones, que pueden producir la desnaturalización e inactivación de proteína lábiles tales como el FV, se han utilizado predominantemente con el fin de separar el FV de proteínas del complejo de protrombina, tales como FII, FVII, FIX y FX. La precipitación con hidróxido de aluminio también se describe en algunas patentes: en JP56049394 (A) , la fracción II derivada del fraccionamiento de Cohn, se incuba con un monosacárido y luego se precipita utilizando dicho óxido, de forma que se separa el FV de los factores de coagulación que puedan desencadenar la cascada de coagulación. La patente CA1293214 (C) -1991 también describe un proceso para la purificación de FV que comienza a partir del plasma humano o sobrenadante crio-agotado, que implica la precipitación con hidróxido de aluminio como una primera etapa, seguida por la incubación con resina Sephadex A50 DEAE y posteriormente precipitación en sulfato amónico.
Además de manera alternativa, o en asociación con las técnicas de precipitación, se han utilizado etapas de purificación por cromatografía con varias técnicas, que incluyen: interacción de absorción en hidroxiapatita, permeabilidad en gel, afinidad, interacción hidrófoba, inmunoafinidad.
La etapa de purificación cromatográfica que se incluye más frecuentemente es intercambio iónico, en particular, intercambio aniónico, utilizando soportes unidos a grupos funcionales catiónicos débiles o fuertes.
Entre los intercambiadores aniónicos fuertes se encuentran soportes con grupos de amonio cuaternario sobre celulosa o matrices de agarosa. Los intercambiadores aniónicos débiles que se utilizan predominantemente tienen grupos funcionales Sephadex A50 DEAE sobre matrices de celulosa, agarosa o dextrano.
En el proceso informado en las patentes que describen... [Seguir leyendo]
Reivindicaciones:
1. Un proceso de purificación de FV que comienza a partir de plasma humano o una fracción intermedia enriquecida en FV, en el que la proteína está intacta; dicho proceso comprende dos etapas de cromatografía sobre 5 intercambiadores aniónicos débiles, en el que la primera etapa se lleva a cabo en modo de "no unión", para separar el FV de otros factores de coagulación mientras que la segunda etapa es en modo "captura" de FV; en el que ambos intercambiadores aniónicos débiles de las dos etapas de cromatografía pertenecen a la categoría de intercambiadores débiles que se caracterizan por el grupo funcional dietilaminoetilo (DEAE) ; en el que las dos etapas de cromatografía están separadas por al menos una etapa de inactivación vírica que se lleva a cabo por un tratamiento disolvente-detergente y en el que tras la segunda etapa de cromatografía, la solución que contiene el FV se somete a una etapa de eliminación vírica por nanofiltración.
2. Un proceso de acuerdo con la reivindicación 1, en el que se utiliza criosobrenadante como material de partida.
3. Un proceso de acuerdo con la reivindicación 2 en el que el criosobrenadante se suplementa con inhibidores de proteasas, que se utilizan individualmente o en una asociación de los mismos, tales como, por ejemplo, Aprotinina, Benzamidina, Leupeptina, STI.
4. Un proceso de acuerdo con la reivindicación 3, en el que la muestra de criosobrenadante se suplementa con Aprotinina a una concentración comprendida entre 50 y 1100 KUI/ml, y luego diluida con WFI para obtener un valor de conductividad comprendido entre 3 y 10 mS/Cm, y el pH ajustado a un valor entre 7, 0 y 8, 0.
5. Un proceso de acuerdo con una cualquiera de las reivindicaciones 1-4, en el que la matriz de intercambio aniónico débil utilizado en la primera etapa es de tipo Sephadex, es decir, basada en dextrano. 25
6. Un proceso de acuerdo con la reivindicación 5, en el que la primera etapa de cromatografía se lleva a cabo en modo discontinuo, a una temperatura comprendida entre 15 y 25 ºC, utilizando resina Sephadex A50 DEAE seca o hidratada, en una relación que puede variar desde 0, 15 a 2, 0 g de resina seca por litro de muestra diluida, durante un periodo de tiempo comprendido entre 30 y 90 minutos.
7. Un proceso de acuerdo con una cualquiera de las reivindicaciones 1-6 en el que el intercambiador aniónico débil que se utiliza en la segunda etapa consiste en un soporte hidrófilo, sintético, con una estructura en "tentáculo" que contiene largas cadenas poliméricas, en cuyos extremos están unidos los grupos DEAE.
8. Un proceso de acuerdo con la reivindicación 7, en el que la segunda etapa de cromatografía comprende las siguientes etapas:
a) acondicionar la resina de intercambio iónico con tampón de equilibrio que tiene un pH comprendido entre 7, 0 y 7, 8, que contiene NaCl a una concentración comprendida entre 0, 05 y 0, 13 M, que contiene cloruro cálcico a una concentración comprendida entre 1 y 10 M, y que opcionalmente comprende glicina; b) cargar la fracción enriquecida en proteínas de interés; c) eluir las proteínas no unidas lavando con tampón de equilibrio; d) eluir las proteínas unidas débilmente con un tampón acuoso a un pH comprendido entre 7, 0 y 7, 8, que contiene NaCl a una concentración comprendida entre 0, 14 y 0, 17 M, que contiene cloruro cálcico a una 45 concentración comprendida entre 1 y 10 mM, y que opcionalmente comprende glicina; e) eluir una solución que contiene FV con un tampón de elución a un pH comprendido entre 7, 0 y 7, 8, que contiene NaCl a una concentración comprendida entre 0, 18 y 0, 30 M, que contiene cloruro cálcico a una concentración comprendida entre 1 y 10 mM, y que opcionalmente comprende glicina;
Patentes similares o relacionadas:
Polipéptidos de unión a IL-17A, del 15 de Julio de 2020, de AFFIBODY AB: Polipéptido de unión a IL-17A, que comprende un motivo de unión BM a IL-17A, cuyo motivo consiste en una secuencia de aminoácidos seleccionada […]
Medios mejorados para la expresión de proteínas recombinantes dependientes de vitamina k, del 6 de Mayo de 2020, de CSL Behring Lengnau AG: Un procedimiento para mejorar la actividad de una proteína recombinante dependiente de vitamina K que comprende las siguientes etapas: a) proporcionar […]
Método para purificar y cuantificar la trombina y sus polipéptidos de degradación, del 25 de Marzo de 2020, de OMRIX BIOPHARMACEUTICALS LTD.: Un método cromatográfico de un solo paso para cuantificar α-trombina en una solución que comprende la α-trombina y al menos uno de un polipéptido de degradación […]
Sistemas de expresión específica de hígado optimizados para FVIII y FIX, del 23 de Octubre de 2019, de VRIJE UNIVERSITEIT BRUSSEL: Casete de expresión de ácido nucleico que comprende: - una repetición triple dispuesta en tándem de un elemento regulador de ácido nucleico específico de hígado, consistiendo […]
Direccionamiento de factores de coagulación al TLT-1 en plaquetas activadas, del 23 de Octubre de 2019, de NOVO NORDISK HEALTH CARE AG: Una proteína procoagulante que comprende (i) al menos un factor de coagulación, que es un polipéptido de FVII o un polipéptido de FIX, unido covalentemente […]
Composición y apósito para tratamiento de heridas, del 14 de Agosto de 2019, de Protege Biomedical, LLC: Una composición para la curación de heridas, que comprende: una mezcla sustancialmente homogénea que comprende una cantidad de mullita, en la que la cantidad de mullita es efectiva […]
 Activación de factor X, del 31 de Julio de 2019, de Baxalta Incorporated: Método para activar el factor de coagulación X (FX) que comprende;
a) poner en contacto una disolución acuosa que comprende FX con un material de […]
Activación de factor X, del 31 de Julio de 2019, de Baxalta Incorporated: Método para activar el factor de coagulación X (FX) que comprende;
a) poner en contacto una disolución acuosa que comprende FX con un material de […]
Métodos y composiciones para proteínas del factor IX modificadas, del 19 de Junio de 2019, de THE UNIVERSITY OF NORTH CAROLINA AT CHAPEL HILL: Una proteína del Factor IX (FIX) aislada que comprende la secuencia de aminoácidos como se expone en la SEQ ID NO: 3, en donde Xaa es leucina.