Comprimidos de fosfolípidos y proteínas.
Una forma de dosificación sólida que comprende un ingrediente activo a una concentración de más deaproximadamente 40% en peso de dicha forma de dosificación,
en donde dicho ingrediente activo es unacomposición de proteína-fosfolípido que comprende proteína a una concentración de aproximadamente 30% aaproximadamente 50% en peso de dicho ingrediente activo y grasa a una concentración de aproximadamente 50% aaproximadamente 75% en peso de dicho ingrediente activo, en donde dicha grasa comprende fosfolípidos a unaconcentración de aproximadamente 35% a aproximadamente 60% en peso de dicha grasa; y un agente deadsorción; en donde dicha forma de dosificación tiene una dureza de más de aproximadamente 60 N.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/IB2010/000490.
Solicitante: Aker BioMarine AS.
Nacionalidad solicitante: Noruega.
Dirección: P.O. Box 1423, Vika Fjordalleen 16 0115 Oslo NORUEGA.
Inventor/es: TILSETH,SNORRE, HOEM,NILS.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A23L1/00
- A23L1/326
- A23L1/33
- A61K35/56 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 35/00 Preparaciones medicinales que contienen sustancias de constitución indeterminada o sus productos de reacción. › Sustancias procedentes de animales distintos de los mamíferos.
- A61K35/60 A61K 35/00 […] › Peces, p. ej. caballitos de mar; Huevos de peces.
- A61K9/20 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › Píldoras, pastillas o comprimidos.
PDF original: ES-2424000_T3.pdf
Fragmento de la descripción:
Comprimidos de fosfolípidos y proteínas.
Campo de la invención La invención se refiere a comprimidos que comprenden fosfolípidos y proteína, y en particular a la producción de comprimidos que contienen astaxantina y fosfolípidos que comprenden radicales ácido graso omega-3.
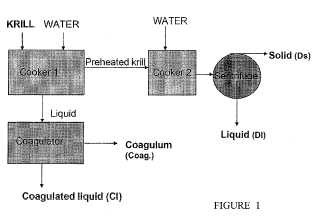
Antecedentes de la invención El krill es un pequeño crustáceo que vive en los principales océanos de todo el mundo. Por ejemplo, se puede encontrar en el Océano Pacífico (Euphausia pacifica) , en el Atlántico Norte (Meganyctiphanes norvegica) y en el Océano Austral frente a la costa de la Antártida (Euphausia superba) . El krill es una especie clave en el océano, ya que es la fuente de alimento para muchos animales como peces, aves, tiburones y ballenas. El krill se puede encontrar en grandes cantidades en el océano y se estima que la biomasa total de kril antártico (E. superba) está en el intervalo de 300-500 millones de toneladas métricas. El krill antártico se alimenta de fitoplancton durante el corto verano antártico. Durante el invierno, sin embargo, su suministro alimenticio se limita a las algas del hielo, bacterias, detritus marinos así como al agotamiento de la proteína corporal para obtener energía. Virtue et al., Mar. Biol. 126, 521-527. Por esta razón, los valores nutricionales del krill varían durante la temporada y en cierta medida anualmente. Phleger et al., Comp. Biochem. Physiol. 131B (2002) 733. Con el fin de adaptarse a las variaciones en el suministro de alimentos, el krill ha desarrollado un aparato digestivo enzimático eficiente que da como resultado una rápida rotura de las proteínas a aminoácidos. Ellingsen et al., Biochem. J. (1987) 246, 295-305. Esta autoproteolisis es altamente eficaz también post mortem, por lo que es un reto capturar y almacenar el krill de una manera que preserve la calidad nutricional del krill. Por lo tanto, con el fin de prevenir la degradación del krill o bien se reduce la actividad enzimática mediante el almacenamiento del krill a bajas temperaturas o bien se convierte el krill en harina de krill.
Durante el procesamiento de la harina de krill el krill se cuece de manera que todas las enzimas activas se desnaturalicen con el fin de eliminar toda la actividad enzimática. El krill es rico en fosfolípidos que actúan como emulsionantes. Por lo tanto, es más difícil separar el agua, la grasa y las proteínas utilizando métodos de separación mecánica de lo que es en una línea de producción de harina de pescado normal. Además, el krill se solidifica, aumenta de peso y pierde líquido con mayor facilidad cuando se mezcla con agua caliente. En definitiva esto puede conducir a una acumulación gradual de proteínas de krill coaguladas en la olla de cocción y a una operación no continua, debido a graves problemas de obstrucción. Con el fin de aliviar esto, se debe añadir vapor de agua caliente directamente a la olla de cocción. Esta operación requiere energía y también puede dar como resultado una degradación de los componentes bioactivos inestables del krill, tales como los ácidos grasos omega-3, los fosfolípidos y las astaxantina. La presencia de estos compuestos, convierte el aceite de krill en una fuente atractiva como suplemento alimenticio, un producto alimenticio funcional y un producto farmacéutico para la aplicación en animales y seres humanos.
Se ha demostrado recientemente que los ácidos grasos omega-3 tienen el efecto potencial de prevenir las enfermedades cardiovasculares, trastornos cognitivos, enfermedades de las articulaciones y enfermedades relacionadas con la inflamación, como la artritis reumatoide. La astaxantina es un antioxidante fuerte y puede por lo tanto ayudar a promover una salud óptima. Por lo tanto, existe una necesidad de un método de procesamiento de krill a una harina de krill en condiciones más suaves que impida la degradación de estos compuestos bioactivos valiosos.
Compendio de la invención La invención se refiere al procesamiento de crustáceos tales como el krill para proporcionar productos derivados de aceite y harina, y, en particular, a la producción de aceites y otros extractos de lípidos que contienen astaxantina y fosfolípidos que comprenden radicales ácido graso omega-3 y harina rica en astaxantina.
En algunas realizaciones, la presente invención proporciona composiciones que comprenden menos de aproximadamente 150, 100, 10, 5, 2 ó 1 mg/kg de astaxantina o de aproximadamente 0, 1 a aproximadamente 1, 2, 5, 10 o 200 mg/kg de astaxantina, preferiblemente astaxantina de origen natural, endógena, también en forma de ésteres de astaxantina, de aproximadamente 20% a aproximadamente 50%, 15% a 45%, o 25% a 35% de fosfolípidos sobre una base p/p, y aproximadamente 15% a 60%, aproximadamente 20% a 50%, o aproximadamente 25% a 40% de proteína sobre una base p/p, en donde dichos fosfolípidos comprenden residuos de ácidos grasos omega-3. En algunas realizaciones, la composición comprende una fracción lipídica que tiene un contenido de ácido graso omega-3 de aproximadamente 5% a aproximadamente 30%, de aproximadamente 10% a aproximadamente 30%, o de aproximadamente 12% a aproximadamente 18% sobre una base p/p. En algunas realizaciones, los fosfolípidos comprenden más de aproximadamente 60%, 65%, 80%, 85% o 90% de fosfatidilcolina sobre una base p/p. En algunas realizaciones, los fosfolípidos comprenden menos de aproximadamente 15%, 10%, 8% o 5% de etanolamina sobre una base p/p. En algunas realizaciones, las composiciones comprenden de aproximadamente 1% a 10%, preferiblemente de 2% a 8%, y más preferiblemente de aproximadamente 2% a 6% alquilacilfosfatidilcolina. En algunas realizaciones, las composiciones comprenden de aproximadamente 30% a aproximadamente 70% de triacilglicerol sobre una base p/p. En realizaciones adicionales, las composiciones comprenden menos de aproximadamente 1% de colesterol. En algunas realizaciones, la proteína comprende de aproximadamente 8% a aproximadamente 14% de leucina sobre una base p/p y de aproximadamente 5% a 11% isoleucina sobre una base p/p.
En algunas realizaciones, la presente invención comprende una fase acuosa y una fase sólida, comprendiendo dicha fase sólida de aproximadamente 20% a aproximadamente 50% de fosfolípidos sobre una base p/p, y de aproximadamente 20% a 50% de proteína sobre una base p/p, en donde dichos fosfolípidos comprenden de aproximadamente 10% a aproximadamente 20% de residuos de ácidos grasos omega-3.
En otras realizaciones, la presente invención proporciona composiciones de krill que comprenden astaxantina, una fracción de proteína, y una fracción lipídica, en donde dicha fracción lipídica comprende menos de aproximadamente 10%, 5% o 3% de fosfolípidos sobre una base p/p. En algunas realizaciones, los fosfolípidos comprenden menos de aproximadamente 15%, 10% o 5% de fosfatidilcolina sobre una base p/p.
En algunas realizaciones, la presente invención proporciona una harina de krill que comprende astaxantina y de aproximadamente 8% a aproximadamente 31% de lípidos, preferiblemente de aproximadamente 8% a aproximadamente 10 o 18% de lípidos, en donde dichos lípidos comprenden más de aproximadamente 80% de lípidos neutros sobre una base p/p. En algunas realizaciones, la harina de krill comprende menos de aproximadamente 15%, 10%, 5%, 3% o 1% de fosfolípidos. En algunas realizaciones, los fosfolípidos comprenden menos de aproximadamente 15%, 10% o 5% de fosfatidilcolina sobre una base p/p.
En algunas realizaciones, la presente invención proporciona métodos para la preparación de una composición de fosfolípidos a partir de material biológico o biomasa que comprenden: mezclar dicho material biológico o biomasa con agua a una temperatura adecuada para formar una fase sólida y una fase acuosa que comprende fosfolípidos y proteínas; separar dicha fase sólida de dicha fase acuosa; calentar dicha fase acuosa a una temperatura suficiente para formar un precipitado de fosfolípido-proteína; y separar dicho precipitado de fosfolípido-proteína de dicha fase acuosa. En algunas realizaciones, la presente invención proporciona un precipitado de fosfolípido-proteína obtenido utilizando el método anterior. En algunas realizaciones, el material biológico o biomasa es krill. En otras realizaciones, el material biológico o la biomasa se selecciona de cangrejos, camarones, Calanus, plancton, cangrejo de río, huevos u otro fosfolípido que contenga materiales biológicos o biomasa. En algunas realizaciones, los métodos comprenden adicionalmente la etapa de formar una harina a partir de dicha fase sólida. En algunas realizaciones, la etapa de formación de la harina comprende: calentar la fase sólida en presencia de agua; separar la grasa y la proteína en dicha fase sólida; y secar dicha proteína para formar una harina.... [Seguir leyendo]
Reivindicaciones:
1. Una forma de dosificación sólida que comprende un ingrediente activo a una concentración de más de aproximadamente 40% en peso de dicha forma de dosificación, en donde dicho ingrediente activo es una composición de proteína-fosfolípido que comprende proteína a una concentración de aproximadamente 30% a aproximadamente 50% en peso de dicho ingrediente activo y grasa a una concentración de aproximadamente 50% a aproximadamente 75% en peso de dicho ingrediente activo, en donde dicha grasa comprende fosfolípidos a una concentración de aproximadamente 35% a aproximadamente 60% en peso de dicha grasa; y un agente de adsorción; en donde dicha forma de dosificación tiene una dureza de más de aproximadamente 60 N.
2. La forma de dosificación sólida de la reivindicación 1, en donde dicha composición de proteína-fosfolípido se obtiene a partir de krill.
3. La forma de dosificación sólida de la reivindicación 1 o 2, en donde dicho ingrediente activo comprende, adicionalmente, astaxantina.
4. La forma de dosificación sólida de cualquiera de las reivindicaciones 1 a 3, en donde dicho ingrediente activo comprende de aproximadamente 1 a aproximadamente 200 mg/kg de astaxantina
5. La forma de dosificación sólida de cualquiera de las reivindicaciones 1 a 4, en donde dicha grasa comprende residuos de ácidos grasos omega-3 a una concentración de aproximadamente 10% a aproximadamente 35% en peso de dicha grasa.
6. La forma de dosificación sólida de cualquiera de las reivindicaciones 1 a 5, en donde dichos fosfolípidos comprenden fosfatidilcolina a una concentración de más de aproximadamente 65% en peso de dicho fosfolípidos.
7. La forma de dosificación sólida de cualquiera de las reivindicaciones 1 a 6, en donde dichos fosfolípidos comprenden alquilacilfosfatidilcolina a una concentración de aproximadamente 1% a aproximadamente 10% en peso de dichos fosfolípidos.
8. La forma de dosificación sólida de cualquiera de las reivindicaciones 1 a 7, en donde dicho agente de adsorción se proporciona a una concentración de aproximadamente 18% a aproximadamente 25% en peso de dicha forma de dosificación.
9. La forma de dosificación sólida de cualquiera de las reivindicaciones 1 a 8, en donde dicho agente de adsorción es aluminometasilicato de magnesio.
10. La forma de dosificación sólida de cualquiera de las reivindicaciones 1 a 9, que comprende adicionalmente un agente aglutinante a una concentración de aproximadamente 8% a aproximadamente 15% en peso de dicha forma de dosificación.
11. La forma de dosificación sólida de cualquiera de las reivindicaciones 1 a 10, que comprende adicionalmente un disgregante a una concentración de aproximadamente 2% a aproximadamente 8% en peso de dicha forma de dosificación.
12. La forma de dosificación sólida de cualquiera de las reivindicaciones 1 a 11, en donde dicha forma de dosificación sólida comprende residuos ácidos omega-3 a una concentración de aproximadamente 2, 5% a 15% en peso de dicha forma de dosificación.
13. La forma de dosificación sólida de cualquiera de las reivindicaciones 1 a 12, en donde dicha grasa comprende triglicéridos a una concentración de aproximadamente 40% a aproximadamente 65% en peso de dicha grasa.
14. La forma de dosificación sólida de cualquiera de las reivindicaciones 1 a 13, en donde dicha proteína comprende de aproximadamente 8% a aproximadamente 14% de leucina en peso de dicha proteína.
15. La forma de dosificación sólida de cualquiera de las reivindicaciones 1 a 14, en donde la disolución de la forma de dosificación en un medio que contiene agua desmineralizada como disolvente es mayor de 75 por ciento en aproximadamente 10 minutos donde la forma de dosificación sólida se hace subir y bajar en dicho disolvente a una tasa de frecuencia constante entre 29 y 32 ciclos por minuto, a través de una distancia de 55 ± 2 mm.
16. La forma de dosificación sólida de cualquiera de las reivindicaciones 1 a 15, en donde dicha forma de dosificación es un comprimido.
17. La forma de dosificación sólida de cualquiera de las reivindicaciones 1 a 16, en donde dicho ingrediente activo está en una concentración de aproximadamente 55% a aproximadamente 65% en peso de dicha forma de dosificación.
18. Un procedimiento para la preparación de la forma de dosificación sólida de cualquiera de las reivindicaciones 1 a 17, que comprende:
granular en húmedo una fase interna que comprende un ingrediente activo, en donde dicho ingrediente activo es una composición de proteína-fosfolípido que comprende proteína a una concentración de aproximadamente 30% a aproximadamente 50% en peso de dicho ingrediente activo y grasa a una concentración de aproximadamente 50% a aproximadamente 75% en peso de dicho ingrediente activo, en donde dicha grasa comprende fosfolípidos a una concentración de aproximadamente 35% a aproximadamente 60% en peso de dicha grasa, y uno o más excipientes farmacéuticamente aceptables;
formar una fase externa que comprende uno o más excipientes farmacéuticamente aceptables;
mezclar dicha fase externa con dicha fase interna para formar una mezcla comprimible;
y
comprimir dicha mezcla comprimible para formar un comprimido.
19. Una forma de dosificación sólida producida mediante el método de la reivindicación 18.
Patentes similares o relacionadas:
Preparación sólida que contiene colorante, del 29 de Julio de 2020, de DAIICHI SANKYO COMPANY, LIMITED: Preparación farmacéutica sólida que comprende monobencenosulfonato de ácido [(1R,5S,6S)-6-(aminometil)-3- etilbiciclo[3.2.0]hept-3-en-6-il]acético […]
Formulación de vitamina D de liberación modificada estabilizada y método de administración de la misma, del 22 de Julio de 2020, de EirGen Pharma Ltd: Una formulacion oral de liberacion controlada de un compuesto de vitamina D que comprende uno o ambos de 25- hidroxivitamina D2 y 25-hidroxivitamina D3, la formulacion […]
Métodos y composiciones para la administración oral de proteínas, del 22 de Julio de 2020, de Entera Bio Ltd: Una única composición farmacéutica oral que comprende una proteína que tiene un peso molecular de hasta 100.000 Daltons, siendo dicha proteína PTH; […]
Composiciones y métodos para tratar el virus de la hepatitis C, del 15 de Julio de 2020, de Gilead Pharmasset LLC: Una composición farmacéutica que comprende: a) de aproximadamente el 25% a aproximadamente el 35% p/p de GS-7977 cristalino que tiene la estructura **(Ver […]
Macrogols para aplicación a la mucosa, y sus usos terapéuticos, del 15 de Julio de 2020, de S.I.I.T. S.R.L.-SERVIZIO INTERNAZIONALE IMBALLAGGI TERMOSALDANTI: Composición farmacéutica en forma sólida que comprende, por unidad de dosificación, entre 5 y 400 mg de un PEG con un grado de 3000 o más, para uso en el tratamiento […]
Composición farmacéutica que comprende un agente antipsicótico atípico y método para su preparación, del 15 de Julio de 2020, de PHARMATHEN S.A.: Comprimido de liberación controlada de Paliperidona en forma de comprimido de varias capas que comprende: a) un núcleo de matriz que comprende […]
Preparación para el control del peso corporal a base de quitosano y celulosa, del 1 de Julio de 2020, de S.I.I.T. S.R.L.-SERVIZIO INTERNAZIONALE IMBALLAGGI TERMOSALDANTI: Una composición oral sólida que contiene una combinación de quitosano de hongos o levaduras, celulosa amorfa en polvo y opcionalmente excipientes.
Granulados secos de polvos de sílice mesoporosa, del 1 de Julio de 2020, de FORMAC PHARMACEUTICALS N.V: Un granulado seco que comprende desde el 50% al 100% p/p de sílice mesoporosa ordenada que tiene una organización bidimensional hexagonalmente […]