Métodos para la detección de hemoglobina glicosilada.
Método para detectar hemoglobina humana glicosilada que comprende:
poner en contacto una muestra que va a someterse a prueba para detectar hemoglobina humana glicosilada con una endopeptidasa;
poner en contacto la muestra tratada con endopeptidasa con endopeptidasa específica de prolina; y
detectar el pentapéptido amino-terminal de la cadena β glicosilada de hemoglobina humana.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2008/083847.
Solicitante: SIEMENS HEALTHCARE DIAGNOSTICS INC..
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 511 BENEDICT AVENUE TARRYTOWN, NY 10591 ESTADOS UNIDOS DE AMERICA.
Inventor/es: CHAPOTEAU, EDDY, EDWARDS,RICHARD, SWIRSKI,CHESTER, ZAZULAK,WOLODYMYR.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- G01N33/72 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › en los que intervienen pigmentos de la sangre, p. ej. la hemoglobina, la bilirrubina.
PDF original: ES-2541114_T3.pdf




Fragmento de la descripción:
MÉTODOS PARA LA DETECCIÓN DE HEMOGLOBINA GLICOSILADA
Campo de la invención Aspectos particulares de la presente invención se refieren a métodos para detectar hemoglobina humana glicosilada en, por ejemplo, sangre completa humana, que no se ven afectados por la presencia de variantes de hemoglobina en la sangre.
Antecedentes de la invención La hemoglobina presente en los glóbulos rojos puede glicosilarse mediante la adición no enzimática de una molécula de glucosa al extremo amino terminal de la cadena de la hemoglobina. Una vez que se glicosila una molécula de hemoglobina, permanece glicosilada, y una acumulación de hemoglobina glicosilada dentro de un glóbulo rojo refleja el nivel promedio de glucosa al que la célula se ha expuesto durante su ciclo de vida. El nivel de hemoglobina glicosilada presente en la sangre de un individuo es por tanto proporcional al nivel de glucosa en la sangre, y es un indicador de la concentración de glucosa en sangre diaria media del individuo a lo largo de las cuatro semanas a los tres meses previos.
Existen numerosos métodos para determinar el nivel de hemoglobina glicosilada en sangre humana, la mayoría de los cuales implican calcular la cantidad relativa de hemoglobina glicosilada A (HbA1c) presente en la sangre, debido al hecho de que la hemoglobina A (HbA) es la forma principal de hemoglobina presente en la sangre humana. Técnicas tales como cromatografía de líquidos de alta resolución y selección por inmunoafinidad se usan en tales métodos, que se aprovechan de las propiedades físicas y/o químicas de la hemoglobina glicosilada A que la distinguen de otras formas de hemoglobina presentes en la sangre.
En el artículo de H.W. Vesper et al., Assessment of microwave assisted enzymatic digestion by measuring glycated hemoglobin A1c by mass spectrometr y , en Rapid Commun. Mass Spectrom. 19 [2005] 2865 -2870, se evalúa el uso de digestión enzimática asistida por microondas para el análisis cuantitativo de proteínas para la medición de hemoglobina glicosilada (HbA1c) . Se usan tripsina y Glu-C como enzimas proteolíticas en la digestión enzimática asistida por microondas. Se detectan mediante espectrometría de masas hexapéptidos glicosilados y octapéptidos glicosilados obtenidos mediante la digestión enzimática.
En el artículo de P. Metus et al., Immunoturbidimetric assay of glycated hemoglobin, en J. Clin. Lab. Analysis 13 [1999] 5 -8, se da a conocer un ensayo inmunoturbidimétrico potenciado con látex de hemoglobina glicosilada HbA1c, usando anticuerpos monoclonales específicos contra los fragmentos -N-terminales. La hemoglobina se degrada proteolíticamente, sin especificar el tipo de enzimas proteolíticas.
En el documento WO 2008/009445 A1 anterior pero no publicado previamente se da a conocer un reactivo para la digestión de hemoglobina HbA1c. Comprende un tampón, pepsina y una sal de 1, 3-dialquil-imidazolio. Se da a conocer además un método para medir HbA1c en el que se mezcla una muestra que contiene hemoglobina con el reactivo y la hemoglobina se digiere durante de 1 a 60 min. Entonces se mide un fragmento que comprende los 14 aminoácidos N-terminales de HbA1c obtenido en la etapa de digestión.
En el documento US 7 153 666 B2 se enseña un método para la determinación de proteínas glicosiladas. En el método, se pone en contacto una muestra que contiene una proteína glicosilada con una proteasa para generar un péptido glicosilado o un aminoácido glicosilado. El péptido glicosilado o aminoácido glicosilado se pone en contacto entonces con una proteína quimérica que comprende un primer fragmento de peptidilo que comprende una secuencia líder bacteriana que tiene una longitud de aproximadamente 5 a 30 aminoácidos, y un segundo fragmento de peptidilo que comprende una amadoriasa, para oxidar el péptido glicosilado o aminoácido glicosilado.
Sin embargo, existen formas variantes de hemoglobina, tales como hemoglobina S (HbS) y hemoglobina C (HbC) , que difieren de la hemoglobina A en el residuo de aminoácido en la posición seis de la cadena de hemoglobina. Las formas de hemoglobina S y hemoglobina C de hemoglobina pueden glicosilarse, y se ha mostrado que la hemoglobina S y la hemoglobina C glicosiladas interfieren con la mayor parte de los métodos actuales para cuantificar hemoglobina humana glicosilada, provocando una elevación de hasta el 40% en los resultados. Existe por tanto una necesidad de métodos para detectar hemoglobina humana glicosilada que no se vean sometidos a interferencia provocada por variantes de hemoglobina.
Sumario de la invención En determinadas realizaciones, la invención se refiere a métodos para detectar hemoglobina humana glicosilada que comprenden poner en contacto una muestra que va a someterse a prueba para detectar hemoglobina humana glicosilada con una endopeptidasa, poner en contacto la muestra tratada con endopeptidasa con endopeptidasa específica de prolina, y detectar el pentapéptido amino-terminal de la cadena glicosilada de hemoglobina humana.
En otras realizaciones, la invención se refiere a métodos para detectar hemoglobina humana glicosilada que comprenden poner en contacto una muestra que va a someterse a prueba para detectar hemoglobina humana glicosilada con una endopeptidasa o bien simultáneamente con, antes de, o bien tras poner en contacto la muestra con un reactivo aglutinador, poner en contacto la muestra tratada con endopeptidasa y reactivo aglutinador con endopeptidasa específica de prolina, y detectar el pentapéptido amino-terminal de la cadena glicosilada de hemoglobina humana con un inmunoensayo de inhibición de la aglutinación.
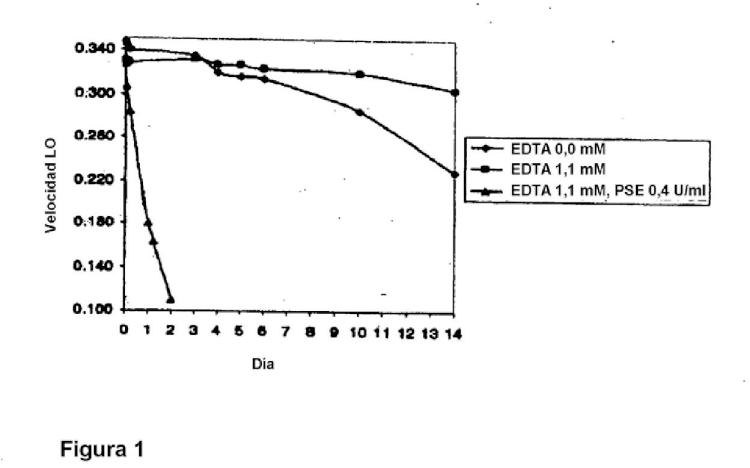
Breve descripción de los dibujos La figura 1 representa la velocidad de aglutinación de látex recubierto con anticuerpo monoclonal de ratón anti-HbA1c provocada por diversas formulaciones de un reactivo aglutinador (sexapéptido glicosilado amino-terminal de la cadena conjugado con poliaspartamida de hemoglobina humana) a lo largo de un periodo de 14 días. Las formulaciones contenían el reactivo aglutinador sin tanto ácido etilendiaminatetraacético (EDTA) como endopeptidasa específica de prolina, con EDTA sólo, y tanto con EDTA como con endopeptidasa específica de prolina.
La figura 2 representa la velocidad de aglutinación de látex recubierto con anticuerpo monoclonal de ratón anti-HbA1c provocada por diversas formulaciones de un reactivo aglutinador (sexapéptido glicosilado amino-terminal de la cadena conjugado con poliaspartamida de hemoglobina humana) a lo largo de un periodo de 18 días. Las formulaciones contenían el reactivo aglutinador y endopeptidasa específica de prolina tanto con EDTA como con BSA, o con BSA sólo.
La figura 3 representa una pendiente de correlación en la que el porcentaje de hemoglobina glicosilada presente en muestras de sangre completa humana que contienen hemoglobina S y hemoglobina C calculado usando el método de HbA1c ADVIA® 1650 se representa gráficamente frente al porcentaje de hemoglobina glicosilada presente en las muestras calculado usando en ensayo de HbA1c DCA® 2000.
La figura 4 representa una pendiente de correlación en la que el porcentaje de hemoglobina glicosilada que se determina que está presente en muestras de sangre completa humana que contienen hemoglobina S y hemoglobina C que se hicieron reaccionar con un reactivo aglutinador y endopeptidasa específica de prolina 0, 0 U/ml usando un instrumento ADVIA® 1650 se representa gráficamente frente al porcentaje de hemoglobina glicosilada presente en las muestras determinadas usando el ensayo de HbA1c DCA® 2000.
La figura 5 representa una pendiente de correlación en la que el porcentaje de hemoglobina glicosilada que se determina que está presente en muestras de sangre completa humana que contienen hemoglobina S y hemoglobina C que se hicieron reaccionar con un reactivo aglutinador y endopeptidasa específica de prolina 0, 1 U/ml usando un instrumento ADVIA® 1650 se representa gráficamente frente al porcentaje de hemoglobina glicosilada presente en las muestras determinadas usando el ensayo de HbA1c DCA® 2000.
La figura 6 representa una pendiente de correlación en la que el porcentaje de hemoglobina glicosilada que se determina que está presente en muestras de sangre completa humana que contienen hemoglobina S y hemoglobina C que se hicieron reaccionar con un reactivo aglutinador y endopeptidasa específica de prolina 0, 2 U/ml usando un instrumento ADVIA® 1650 se representa gráficamente frente al porcentaje de hemoglobina glicosilada presente en las muestras determinadas usando el ensayo de HbA1c DCA® 2000.
La figura 7 representa una pendiente de correlación en la que el porcentaje de hemoglobina glicosilada que se determina que está presente en... [Seguir leyendo]
Reivindicaciones:
1. Método para detectar hemoglobina humana glicosilada que comprende:
poner en contacto una muestra que va a someterse a prueba para detectar hemoglobina humana glicosilada con una endopeptidasa;
poner en contacto la muestra tratada con endopeptidasa con endopeptidasa específica de prolina; y detectar el pentapéptido amino-terminal de la cadena glicosilada de hemoglobina humana.
2. Método según la reivindicación 1, en el que la muestra es sangre completa humana.
3. Método según la reivindicación 1, que comprende determinar el porcentaje de hemoglobina humana 15 glicosilada en la muestra.
4. Método según la reivindicación 1, en el que la endopeptidasa es una endopeptidasa ácida seleccionada del grupo que consiste en pepsina, aspergilopepsina II, catepsina D, sacaropepsina, mucorpepsina, quimosina, gastricsina y fisirolisina.
5. Método según la reivindicación 4, en el que la endopeptidasa ácida es pepsina, que comprende poner en contacto la muestra con pepsina de aproximadamente 5 U/ml a aproximadamente 10.000 U/ml a un pH en el intervalo de aproximadamente 1, 0 a aproximadamente 5, 0.
6. Método según la reivindicación 1, que comprende poner en contacto la muestra tratada con endopeptidasa con endopeptidasa específica de prolina de aproximadamente 0, 1 U/ml a aproximadamente 30 U/ml a un pH en el intervalo de aproximadamente 5, 0 a aproximadamente 9, 0.
7. Método según la reivindicación 1, que comprende detectar el pentapéptido amino-terminal de la cadena glicosilada de hemoglobina humana con un método que comprende el uso de cromatografía de líquidos de alta resolución o que comprende la unión de al menos un anticuerpo al pentapéptido glicosilado.
8. Método según la reivindicación 1, que comprende detectar el pentapéptido amino-terminal de la cadena
glicosilada de hemoglobina humana con un inmunoensayo de inhibición de la aglutinación. 35
9. Método según la reivindicación 8, en el que el reactivo aglutinador usado en el inmunoensayo de inhibición de la aglutinación es un sexapéptido de Val-His-Leu-Thr-Tyr-Cys glicosilado conjugado con poliaspartamida.
10. Método según la reivindicación 8, que comprende poner en contacto la muestra tratada con endopeptidasa con endopeptidasa específica de prolina o bien simultáneamente con, antes de, o bien tras poner en contacto la muestra con un reactivo aglutinador o que comprende poner en contacto la muestra tratada con endopeptidasa con una mezcla de endopeptidasa específica de prolina y el reactivo aglutinador.
11. Método según la reivindicación 10, en el que la mezcla de endopeptidasa específica de prolina y el reactivo aglutinador comprende albúmina sérica bovina de aproximadamente 0, 1 g/dl a aproximadamente 5, 0 g/dl y ácido etilendiaminatetraacético de aproximadamente 0, 5 mmol/l a aproximadamente 10, 0 mmol/l y tiene un pH en el intervalo de aproximadamente 6, 0 a aproximadamente 8, 0.
12. Método según la reivindicación 10, que comprende además poner en contacto la endopeptidasa, la endopeptidasa específica de prolina y la muestra tratada con reactivo aglutinador con un anticuerpo que se une específicamente tanto al pentapéptido amino-terminal de la cadena glicosilada de hemoglobina humana como al reactivo aglutinador.
13. Método según la reivindicación 14, en el que se une al menos una molécula de anticuerpo a una o más partículas de látex.
14. Método para detectar hemoglobina humana glicosilada según la reivindicación 1, que comprende:
poner en contacto una muestra que va a someterse a prueba para detectar hemoglobina humana glicosilada con una endopeptidasa o bien simultáneamente con, antes de, o bien tras poner en contacto la muestra con un reactivo aglutinador;
poner en contacto la muestra tratada con endopeptidasa y reactivo aglutinador con endopeptidasa 65 específica de prolina; y 12
detectar el pentapéptido amino-terminal de la cadena glicosilada de hemoglobina humana con un inmunoensayo de inhibición de la aglutinación.
15. Método según la reivindicación 14, en el que la endopeptidasa es una endopeptidasa ácida seleccionada del grupo que consiste en pepsina, aspergilopepsina II, catepsina D, sacaropepsina, mucorpepsina, quimosina, gastricsina o fisirolisina.
16. Método según la reivindicación 14, que comprende poner en contacto la muestra con una mezcla de pepsina y el reactivo aglutinador en el que la mezcla de pepsina y el reactivo aglutinador comprende pepsina de aproximadamente 3 U/ml a aproximadamente 100 U/ml y tiene un pH en el intervalo de aproximadamente 1, 0 a aproximadamente 4, 0.
17. Método según la reivindicación 16, que comprende además poner en contacto la muestra tratada con endopeptidasa y reactivo aglutinador con endopeptidasa específica de prolina o bien simultáneamente con o bien antes de poner en contacto la muestra con un anticuerpo que se une específicamente tanto al pentapéptido amino-terminal de la cadena glicosilada de hemoglobina humana como al reactivo aglutinador.
18. Método según la reivindicación 17, que comprende poner en contacto la muestra tratada con endopeptidasa 20 y reactivo aglutinador con una mezcla de endopeptidasa específica de prolina y el anticuerpo.
19. Método según la reivindicación 18, en el que la mezcla comprende endopeptidasa específica de prolina de aproximadamente 2, 0 U/ml a aproximadamente 30, 0 U/ml y tiene un pH en el intervalo de aproximadamente 7, 0 a aproximadamente 8, 0.
20. Método según la reivindicación 19, en el que se une al menos una molécula de anticuerpo a una o más partículas de látex.
Patentes similares o relacionadas:
Calibración normalizada de determinaciones de la concentración de analito, del 6 de Mayo de 2020, de Ascensia Diabetes Care Holdings AG: Un método de calibrado de un dispositivo de medida de un sistema de biosensor, comprendiendo el método: para cada una de las al menos dos concentraciones […]
Filtro de sangre, del 11 de Marzo de 2020, de IMPERIAL COLLEGE OF SCIENCE, TECHNOLOGY AND MEDICINE: Un dispositivo para la eliminación de componentes derivados de la hemólisis de la sangre, el dispositivo comprende: un soporte y una pluralidad […]
Procedimiento para determinar una concentración de analito, del 11 de Diciembre de 2019, de F. HOFFMANN-LA ROCHE AG: Un procedimiento para determinar una concentración de analito en una muestra mediante un sensor, comprendiendo el procedimiento analizar una […]
Detección de malaria, del 2 de Octubre de 2019, de MAGNETRAP: Método de detección de un material diana en una muestra comprendiendo el material diana en una forma que presenta propiedades magnéticas, […]
Sistema para mejorar la función de órganos o tejidos y longevidad de trasplantes de órganos o tejidos, del 11 de Septiembre de 2019, de Proterris, Inc: Un sistema para administrar terapia con monóxido de carbono, que comprende: una fuente de gas que comprende monóxido de carbono (CO), […]
Biomarcador para uso en el tratamiento de anemia, del 7 de Agosto de 2019, de CELGENE CORPORATION: Un inhibidor del receptor de activina tipo II para uso en un método para el tratamiento de anemia, beta talasemia, o para aumentar los niveles de glóbulos […]
Procedimiento para la detección de anormalidades en hemoglobina, del 24 de Julio de 2019, de MAP IP HOLDING LIMITED: Un procedimiento de detección de una hemoglobinopatía que comprende someter una muestra sanguínea obtenida de un sujeto a espectrometría de masas de […]
Contenedor que comprende fracciones de hemoglobina, del 3 de Julio de 2019, de Eurotrol B.V: Contenedor que comprende fracciones de hemoglobina, donde dicho contenedor comprende al menos dos compartimentos adyacentes, donde un primer compartimento comprende […]