Método para detectar un xenoantígeno en tejidos fijados usados como sustituciones bioprotésicas.
Un método para determinar xenoantígeno a-Gal en tejidos fijados con glutaraldehído que comprende al menos las etapas de:
- someter una muestra de un tejido fijado a un tratamiento de inactivación con ácido homocistéico;
- detectar epítope a-Gal por medio de un inmunoensayo de ELISA con un anticuerpo monoclonal anti-a-Gal primario;
- cuantificar el epítope a-Gal por medio de detección por absorbancia a 450 nm de la señal generada por la cantidad libre de dicho anticuerpo monoclonal anti-a-Gal reaccionado con un anticuerpo secundario conjugado con peroxidasa y comparación con una línea de calibración.
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E13154536.
Solicitante: Biocompatibility Innovation S.r.l.s.
Inventor/es: SPINA, MICHELE, NASO,FILIPPO, GANDAGLIA,ALESSANDRO, GEROSA,GINO.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- G01N33/50 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › Análisis químico de material biológico, p. ej. de sangre o de orina; Ensayos mediante métodos en los que interviene la formación de uniones bioespecíficas con grupos coordinadores; Ensayos inmunológicos (procedimientos de medida o ensayos diferentes de los procedimientos inmunológicos en los que intervienen enzimas o microorganismos, composiciones o papeles reactivos a este efecto, procedimientos para preparar estas composiciones, procedimientos de control sensibles a las condiciones del medio en los procedimientos microbiológicos o enzimáticos C12Q).
PDF original: ES-2540602_T3.pdf
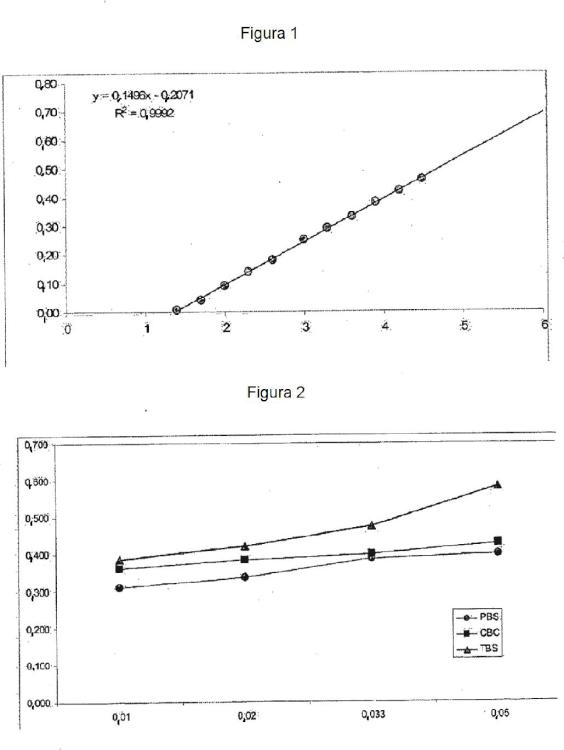
Fragmento de la descripción:
Método para detectar un xenoantígeno en tejidos fijados usados como sustituciones bioprotésicas Campo de la invención [0001] La invención se refiere a un método para la detección de un xenoantígeno, en particular el epítope -Gal, en tejidos xenógenos fijados, en particular tejidos fijados con glutaraldehído, que pueden emplearse para fabricar sustituciones bioprotésicas para su uso en el campo clínico humano.
Antecedentes de la invención [0002] Avances recientes en la ingeniería del tejido en la bioprótesis proporcionaron un refuerzo sustancial en este sector, tanto comercialmente como clínicamente, para investigar nuevos escenarios con el fin de contribuir a la mejora mundial de las curas sanitarias.
En tal sentido, el área de interés cardiovascular debe considerarse simbólica, tanto en términos del impacto social como sanitario y del procedimiento establecido para la sustitución de válvulas del corazón.
De hecho, la disfunción de las válvulas del corazón tiene un alto impacto sobre la población en el mundo ya que hay varias causas etiológicas. Las modificaciones del aparato valvular inducidas por fenómenos inflamatorios (tales como enfermedades reumáticas) , afecciones infecciosas (tales como endocarditis) o degenerativas (degeneración mixoide, distrofia cálcica) pueden inducir alteración funcional y morfológica (estenosis o insuficiencia) con alteración grave de la circulación sanguínea, frecuentemente incompatible con la propia vida. El impacto de estas valvulopatías sobre la salud pública también está ligado a la correlación entre la etiología degenerativa y el envejecimiento progresivo de la población. Las encuestas epidemiológicas más recientes llevadas a cabo en Europa y en EE.UU. [1] muestran una prevalencia de estenosis aórtica de moderada-grave en el 4, 6 % de la población de edad >75 años, que alcanza el 8, 1 % después de los 85 años de edad. Desde el momento en que se vuelve sintomática o determina disfunción ventricular izquierda, la estenosis aórtica es una enfermedad con mal pronóstico a corto plazo.
El descubrimiento de la "máquina corazón-pulmón" en los años 60 permitió a la función cardíaca ser bloqueada temporalmente mediante el uso de circulación extracorpórea, permitiendo así operaciones quirúrgicas sobre un músculo cardíaco sin movimiento. Por tanto, la tecnología biomédica ha sido capaz de desarrollarse y aplicarse quirúrgicamente para sustitutos de prótesis de válvulas adecuados para imitar la función natural de válvulas nativas y no patológicas. Actualmente, la sustitución de válvulas es la terapia por elección apta para mejorar el pronóstico de los pacientes y mejorar significativamente su calidad de vida.
La prótesis de válvula ideal debe permitir un flujo transvalvular comparable al de la válvula sana nativa correspondiente, con una larga vida útil y que no genere efectos hemolíticos o trombogénicos. Como estas características son generalmente difíciles de obtener cuando se condensan en un único dispositivo, las actuales prótesis de válvulas cardíacas comerciales resultan de modificaciones coherentes y mejoras constantes que están todavía en curso. Tales prótesis, disponibles para fines clínicos, se dividen en prótesis mecánicas, biológicas y de homoinjerto. Las prótesis mecánicas generalmente no encuentran ninguna degeneración con el tiempo, sin embargo 45 requieren terapia anticoagulante. No pueden ser repobladas por células, ya que no proporcionan un soporte biológico que promueva la unión de células. Esto compromete la posibilidad de una remodelación estructural y así, por ejemplo, un aumento en el tamaño en relación con el crecimiento del cuerpo del paciente. Pueden durar durante hasta aproximadamente 20 años, a partir de entonces deben sustituirse debido a la formación de panículo fibroso, no compatible con la motilidad de las valvas.
Por otra parte, homoinjerto significa una prótesis de válvula no xenógena recogida durante autopsias de corazones no adecuados para el trasplante de órganos enteros, que pertenecen a individuos de edades entre 18 y 65. Incluyen una porción de aproximadamente 5-6 cm de la aorta ascendente o arteria pulmonar y el anillo fibroso de la propia válvula. Las ventajas de estas bioprótesis, una vez implantadas, son debidas a su excelente perfil 55 hemodinámico y bajo riesgo tromboembólico y de infección. Además, los homoinjertos no requieren terapia de anticoagulación. Sin embargo, estos tipos de bioprótesis tienen duración limitada en el tiempo: la degeneración de homoinjertos resulta de fenómenos de distrofia cálcica de un modo que es inversamente proporcional a la edad del receptor (este aspecto es debido a una elevada movilización fisiológica del calcio, que en pacientes pediátricos y jóvenes está asociada al desarrollo del aparato esquelético) . Además, el alto número de hospitalizaciones, que requieren cirugía de sustitución de la válvula, y la baja disponibilidad de tales prótesis biológicas (obtenidas de donantes fallecidos) , las hace insuficientes en número para cumplir la demanda clínica.
Debido a estos inconvenientes, las válvulas más comúnmente usadas como sustitución están representadas por prótesis biológicas que se derivan de tejidos xenógenos, en particular que se derivan de válvulas 65 de cerdo o de pericardio bovino o equino. Estas bioprótesis se producen tanto con un medio semirrígido que soporta el anillo fibroso y se usa como anclaje en procedimientos quirúrgicos (bioprótesis con endoprótesis) como sin tal
medio de soporte (bioprótesis sin endoprótesis) . La circulación sanguínea a través de estas bioprótesis es fisiológicamente similar a la de las válvulas nativas y la terapia después de la sustitución de la válvula no requiere fármacos anticoagulantes o antiplaquetarios. Sin embargo, tienen la desventaja de encontrarse con procesos de distrofia cálcica degenerativa (bioprótesis de cerdo) , degeneración con rotura de las valvas (prótesis pericárdica) y demuestran una mayor sensibilidad hacia infecciones endocárdicas. Estas bioprótesis se tratan normalmente con agentes químicos, tales como glutaraldehído, con el fin de mejorar las características mecánicas mientras que se reduce la antigenicidad del tejido intrínseco, permitiendo la preservación de las mismas.
También pueden tratarse con protocolos de descalcificación (que pretende disminuir el riesgo de deposición de cristales de hidroxiapatita tras el implante) o agentes detoxificantes, mediante la saturación de cualquier sitio aldehídico de glutaraldehído que todavía es reactivo. Las bioprótesis, de tanto origen porcino como bovino/equino, se han dividido en bioprótesis de 1ª generación (tejidos fijados con glutaraldehído a alta presión) y 2ª generación (glutaraldehído a baja presión con la adición de tensioactivos que bloquean los sitios de unión del calcio) , teniendo ambas una duración promedio de 10-14 años.
Como se ha mencionado previamente, todas las prótesis de válvula biológicas (con la excepción de homoinjertos) son de origen xenógeno. El tejido xenógeno pertenece a un organismo de una especie distinta del hombre; estos materiales poseen antígenos de superficie específicos tolerables exclusivamente dentro de las mismas especies de origen, pero incompatibles en el caso de una implantación humana en la que, si no se tratan adecuadamente, desencadenarían la cascada de activación del complemento con agregación de plaquetas, generando una situación similar a la que se produce en el caso de incompatibilidad de grupos sanguíneos. Esta reacción se conoce como rechazo hiperagudo y se produce en aproximadamente treinta minutos. El principal factor responsable de este impresionante mecanismo de rechazo es el xenoantígeno -Gal. Este epítope es un digalactósido (galactosa-alfa 1, 3-galactosa) presente sobre glucoproteínas y glucolípidos de la membrana, principalmente de células endoteliales, aunque también se encontró sobre tipos de células tales como monocitos, granulocitos [2] y glóbulos rojos [3] y en distritos de tejido importantes tales como las regiones miocárdicas [4] y de hueso [5]. El epítope alfa-Gal se expresa constitutivamente en todos los mamíferos, con la excepción de primates superiores y seres humanos [6] que, debido a mutaciones que se producen durante el proceso evolutivo, son incapaces de sintetizar la enzima -1, 3-galactosil-transferasa, responsables de enlazar el epítope a las glucoproteínas y glucolípidos de la membrana de los componentes celulares. Además, los seres humanos expresan anticuerpos dirigidos contra este antígeno desde el nacimiento como resultado de una estimulación continua inducida por la flora bacteriana intestinal (principalmente... [Seguir leyendo]
Reivindicaciones:
1. Un método para determinar xenoantígeno -Gal en tejidos fijados con glutaraldehído que comprende al menos las etapas de:
- someter una muestra de un tejido fijado a un tratamiento de inactivación con ácido homocistéico; -detectar epítope -Gal por medio de un inmunoensayo de ELISA con un anticuerpo monoclonal anti--Gal primario; -cuantificar el epítope -Gal por medio de detección por absorbancia a 450 nm de la señal generada por la cantidad libre de dicho anticuerpo monoclonal anti--Gal reaccionado con un anticuerpo secundario conjugado con peroxidasa y comparación con una línea de calibración.
2. El método para determinar xenoantígeno -Gal en tejidos fijados con glutaraldehído según la reivindicación 1, que comprende además la etapa de:
- producir la línea de calibración usando glóbulos rojos de conejo para la determinación cuantitativa del epítope -Gal tras la detección por absorbancia a 450 nm de la señal de cantidad libre de dicho anticuerpo monoclonal anti--Gal.
3. El método para determinar xenoantígeno -Gal en tejidos fijados con glutaraldehído según la reivindicación 1, en el que para el tratamiento de inactivación el ácido homocistéico está en un tampón fosfato con un pH entre 6, 0 y 8, 0 a una concentración comprendida de 50 mM a 200 mM.
4. El método para determinar xenoantígeno -Gal en tejidos fijados con glutaraldehído según la reivindicación 3, en 25 el que el ácido homocistéico está a la concentración de 100 mM.
5. El método para determinar xenoantígeno -Gal en tejidos fijados con glutaraldehído según la reivindicación 1, en el que para el ensayo de ELISA el recubrimiento de placa se realiza con disoluciones de epítope -Gal/albúmina de suero a una concentración comprendida de 2, 5 a 15 µg/ml en un tampón seleccionado de tampones fosfato pH 7, 0
8, 0, carbonato/bicarbonato pH 9, 0 -1, 0 y Tris/NaCl pH 7, 0 -8, 0.
6. El método para determinar xenoantígeno -Gal en tejidos fijados con glutaraldehído según la reivindicación 5, en el que el recubrimiento de placa se lleva a cabo con disoluciones de epítope -Gal/albúmina de suero humano en una concentración de 5 µg/ml en tampón Tris/NaCl. 35
7. El método para determinar xenoantígeno -Gal en tejidos fijados con glutaraldehído según la reivindicación 1, que comprende las etapas de:
- tratar una muestra de tejido por incubación de la misma dos veces con una disolución de ácido homocistéico tamponada durante 12 horas, con agitación, en la oscuridad y a temperatura ambiente; -incubar la muestra previamente tratada con un anticuerpo monoclonal anti--Gal primario durante 2 horas a 37 ºC; -centrifugar la muestra a 14.340 rpm durante 30 minutos a 4 ºC y separar el sobrenadante; -tratar una placa de pocillos para recubrimiento con una disolución tamponada de epítope -Gal/albúmina de 45 suero; -lavar los pocillos con tampón y tratar para bloquear con una disolución tamponada al 1, 5 % en peso/volumen de albúmina de suero durante 2 horas a temperatura ambiente; -lavar los pocillos con tampón, cargar el sobrenadante de la muestra previamente centrifugada e incubar durante la noche a 4 ºC;
-lavar los pocillos con tampón, cargar un anticuerpo policlonal secundario conjugado con peroxidasa e incubar durante la noche a 4 ºC; -lavar con tampón, cargar los pocillos con una disolución de revelador e incubar en la oscuridad durante 30 minutos; -leer la placa con un lector de placas para la detección de dicha señal de anticuerpo monoclonal anti-alfa-Gal 55 libre por absorbancia a 450 nm.
8. Un kit para llevar a cabo el método según una de las reivindicaciones 1 a 7, que comprende al menos:
- al menos un primer recipiente que contiene una disolución de ácido homocistéico tamponada;
-al menos un segundo recipiente que contiene un anticuerpo monoclonal para -Gal primario; -al menos un recipiente adicional que contiene un anticuerpo policlonal secundario conjugado con la enzima peroxidasa; -un prospecto que muestra una línea de calibración dispuesta con concentraciones conocidas de glóbulos rojos de conejo y la fórmula de conversión para calcular el número de epítopes -Gal en el tejido analizado 65 basándose en la absorbancia de la muestra leída en una placa a 450 nm.
9. El kit según la reivindicación 8, que comprende además:
- al menos un recipiente con un tampón de recubrimiento que consiste en una disolución tamponada de epítope -Gal/albúmina de suero;
-al menos un recipiente con un tampón de bloqueo que consiste en una disolución tamponada de albúmina de suero; -al menos un recipiente con una disolución para el desarrollo de enzima peroxidasa.
10. Uso del método según una de las reivindicaciones 1 a 7 para el control de calidad de los tejidos fijados biológicos 10 útiles para la fabricación de bioprótesis de uso clínico humano.
Patentes similares o relacionadas:
Cultivo de tejido tridimensional heterogéneamente diferenciado, del 22 de Julio de 2020, de IMBA-INSTITUT FÜR MOLEKULARE BIOTECHNOLOGIE GMBH: Un cultivo de tejido neuronal tridimensional artificial cultivado in vitro que comprende una población heterogénea de células humanas o células de primate no humanas […]
Gangliósidos para estandarizar y aumentar la sensibilidad de las células a las neurotoxinas botulínicas en los sistemas de prueba in vitro, del 15 de Julio de 2020, de MERZ PHARMA GMBH & CO. KGAA: Un método para determinar la actividad biológica de un polipéptido de neurotoxina, que comprende las etapas de: a) cultivar neuronas de diferentes […]
Procedimiento para evaluación de la función hepática y el flujo sanguíneo portal, del 15 de Julio de 2020, de The Regents of the University of Colorado, a body corporate: Procedimiento in vitro para la estimación del flujo sanguíneo portal en un individuo a partir de una única muestra de sangre o suero, comprendiendo el procedimiento: […]
ANTICUERPO MONOCLONAL O UNA PORCIÓN DE UNIÓN A ANTÍGENO DEL MISMO QUE SE UNE A LA PROTEÍNA L DEL VIRUS PARAINFLUENZA HUMANO (PIV); MÉTODO Y KIT PARA DETECTAR AL VIRUS PIV, del 2 de Julio de 2020, de PONTIFICIA UNIVERSIDAD CATÓLICA DE CHILE: La invención presenta la generación de anticuerpos monoclonales, o fragmentos de los mismos, que reconocen la proteína L del virus parainfluenza humano (PIV), donde dichos […]
ANTICUERPOS MONOCLONALES ESPECÍFICOS PARA EL ANTÍGENO PB2 DEL VIRUS DE LA INFLUENZA HUMANA (FLU), SECUENCIAS NUCLEOTÍDICAS; MÉTODO Y KIT DE DIAGNÓSTICO DE INFECCIÓN PRODUCIDA POR FLU, del 2 de Julio de 2020, de PONTIFICIA UNIVERSIDAD CATÓLICA DE CHILE: La invención presenta la generación de anticuerpos monoclonales, o fragmentos de los mismos, que reconocen la proteína PB2 del virus de la influenza humana (Flu), […]
Reactivos SIRP-alfa de alta afinidad, del 24 de Junio de 2020, de THE BOARD OF TRUSTEES OF THE LELAND STANFORD JUNIOR UNIVERSITY: Un polipéptido SIRPα de alta afinidad que comprende al menos una y no más de 15 modificaciones de aminoácidos dentro del dominio d1 de una secuencia SIRPα de tipo […]
Diagnóstico y terapia de cáncer que implica células madre cancerosas, del 24 de Junio de 2020, de BioNTech SE: Un anticuerpo que tiene la capacidad de unirse a Claudina 6 (CLDN6) para usar en un método de tratamiento o prevención del cáncer que comprende inhibir y/o eliminar […]
Nueva inmunoterapia contra diversos tumores como el cáncer gastrointestinal y gástrico, del 24 de Junio de 2020, de IMMATICS BIOTECHNOLOGIES GMBH: Péptido seleccionado del grupo siguiente: a) péptido consistente en la secuencia conforme a la SEQ ID N.º 86, b) el péptido conforme a a), en la […]