Xilanasa termoestable para la hidrólisis selectiva de polisacáridos que contienen pentosa.
Un polipéptido que tiene actividad de xilanasa, en el que el polipéptido comprende una secuencia de aminoácidos que tiene al menos 70%,
más preferiblemente al menos 75%, 80%, 85%, 90% o 95% de identidad de secuencia para la SEC ID Nº 1.
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E09180210.
Solicitante: Süd-Chemie IP GmbH & Co. KG .
Nacionalidad solicitante: Alemania.
Dirección: LENBACHPLATZ 6 80333 MUNCHEN ALEMANIA.
Inventor/es: KOLTERMANN, ANDRE, RARBACH,MARKUS, BRÜCK,THOMAS, UNTERSTRASSER,ISABEL, KOHL,ANDREAS, REISINGER,CHRISTOPH DR.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07K14/00 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados.
- C07K14/195 C07K […] › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › de origen bacteriano.
PDF original: ES-2523242_T3.pdf





Fragmento de la descripción:
Xilanasa termoestable para la hidrólisis selectiva de polisacáridos que contienen pentosa.
Antecedentes de la invención Las hemicelulosas y, en particular, los polisacáridos que contienen xilana son una fuente valiosa para la producción de monosacáridos que se pueden convertir en biocombustibles, productos químicos de la plataforma industrial, productos de consumo, aditivos alimentarios y para piensos. Debido a la estructura química heterogénea de este material su degradación requiere una serie de etapas de tratamiento físico-químico y/o enzimático. Los procedimientos que permiten una hidrólisis eficaz y selectiva de los polisacáridos que contienen pentosa son muy deseables.
Una fuente importante de pentosas a partir de biomasa es la xilana. La xilana constituye aproximadamente 15-25% de biomasa lignocelulósica y hasta el 70% de otras materias primas tales como espeltas de avena. Las xilanas representan uno de los principales componentes de las paredes celulares vegetales y se encuentran abundantemente en productos de desecho agrícolas, por ej., paja de trigo, rastrojo de maíz, mazorcas de maíz y semilla de algodón. Las xilanas consisten en subunidades monoméricas de xilosa unidas por enlaces β-1-4glucosídicos en un polímero complejo con otros diversos componentes tales como arabinosa, ácido glucurónico, ácido metilglucurónico y grupos acetilo. En los cereales, las xilanas con frecuencia contienen cadenas laterales de Larabinofuranósido α-1, 2-y/o α-1, 3-ligado. Estas xilanas sustituidas se refieren comúnmente como arabinoxilanas. Las xilanas que están sustituidas con glucosa se refieren como glucoxilanas. También existen formas mixtas de estas xilanas.
Las xilanasas (β-1, 3-o β-1, 4-xilan-xilohidrolasa; E. C. 3.2.1.8) son enzimas xilanolíticas que despolimerizan xilanas, arabinoxilana y/u otros polisacáridos que contienen xilosa. Las endo-xilanasas (por ej., endo-β-1, 4-xilanasa) hidrolizan las uniones β-glucosídicas internas en xilana, arabinoxilana y/u otros polisacáridos que contienen xilosa para producir xilo-oligómeros o monómeros de xilosa de menor peso molecular.
Las aplicaciones industriales principales de las xilanasas hoy en día están en la industria de la pasta y el papel para mejorar la aptitud de las pastas para ser blanqueadas y para producir xilosa como base para el edulcorante xilitol. Además, se pueden usar xilanasas en composiciones de alimentos y piensos que contienen cereales (por ej., cebada, trigo, maíz, centeno, triticale o avenas) o subproductos de cereales que son ricos en xilanas, arabinoxilanas y/o glucoxilanas. La adición de xilanasas a pienso para animales o productos de panadería mejora la descomposición de las paredes celulares vegetales, que conduce a mejor utilización de los nutrientes vegetales y/o frescura del pan prolongada, respectivamente. En las composiciones de pienso la adición de xilanasa conduce a tasa de crecimiento animal y conversión del pienso mejoradas. Adicionalmente, la viscosidad de composiciones de piensos que contienen xilana se puede reducir por la xilanasa, que conduce a mejor aceptabilidad y adsorción.
A pesar del número relativamente alto de xilanasas fúngicas y bacterianas conocidas, el número de xilanasas que son industrialmente aplicables sigue limitado. Esto se debe principalmente a las condiciones físicas del procedimiento, tales como alta temperatura y bajo pH, así como ausencia de selectividad del sustrato y/o producto. Dichas desventajas limitan el uso de las xilanasas.
Las xilanasas fúngicas típicas son ineficaces a temperaturas mayores que 60º C y generan un amplio espectro de productos de azúcar que contienen mezclas de hexosas y pentosas (Saha, B. C. (2.003) Hemicellulose bioconversion. J. Ind. Microbiol. Biotechnol. 30: 279-291) . La ausencia de especificidad del producto y la rápida desactivación de estas enzimas a temperaturas del procedimiento >60º C limita su aplicación en aplicaciones industriales. Mayor especificidad del producto y temperaturas de funcionamiento, sin embargo, darían como resultado procedimientos de purificación simplificados y generación del producto más rápida, conduciendo a intensificación del procedimiento total y reducción del coste.
Aunque las preparaciones de xilanasa fúngica, típicas, operan entre pH 3, 5 – 6, 0, se desactivan rápidamente en condiciones del procedimiento fuera de este intervalo de pH (Kulkani, N., Shendye, A., Rao, M. (1.999) Molecular and biotechnological aspects of xylanases FEMS Microbiology Reviews 23: 411-456; Savitha S, Sadhasivam S, Swaminathan K. Application of Aspergillus fumigatus xylanase for quality improvement of waste paper pulp. Bull Environ Contam Toxicol. Abril de 2.007; 78 (3-4) : 217-21) . Sin embargo, para aplicaciones alimenticias y de piensos es deseable que las xilanasas sean estables y/u operen en un amplio intervalo de pH.
Una característica preferible adicional es la resistencia a la hidrólisis proteolítica, que daría como resultado mayor estabilidad del procedimiento. La xilanasa disponible no es resistente a la hidrólisis o carece de la especificidad del producto o la estabilidad térmica deseada (Mendicuti Castro LP, Trejo-Aguilar BA, Aguilar Osorio G. Thermostable xylanases produced at 37 degrees C and 45 degrees C by a thermotolerant Aspergillus strain. FEMS Microbiol Lett. 1 de enero de 1.997; 146 (1) : 97-102; Li N, Yang P, Wang Y, Luo H, Meng K, Wu N, Fan Y, Yao B. (2.008) Cloning, expression, and characterization of protease-resistant xylanase from Streptomyces fradiae var. k11. J Microbiol Biotechnol. 18 (3) : 410-416) .
Típicamente, las xilanasas fúngicas presentan una temperatura óptima de aproximadamente 50º C y un pH óptimo menor que las xilanasas bacterianas. Un ejemplo típico de una xilanasa fúngica se aisló de Trichoderma longibrachiatum (Xyl1, Mr: 20 Kda, pl 5, 5; 4) . La enzima presenta temperatura y pH óptimos alrededor de 50º C y pH 4, 5, respectivamente. La xilanasa es estable por un intervalo de pH de 3-8 y se desactiva por encima de 55º C, como se espera para las enzimas fúngicas. La enzima escinde preferiblemente unidades de xilosa de xilana lineal o polímeros de hemicelulosa ramificados. Como otras xilanasas fúngicas también presenta una especificidad del sustrato bastante amplia, que conduce a actividades secundarias de celulasa y arabinasa significativas. Las xilanasas fúngicas que se han modificado para aumentar la termoestabilidad se describen en la patente internacional WO 02/18561A2.
Por contraste a la xilanasa fúngica, diversas xilanasas de bacterias presentan una temperatura óptima en el intervalo de 50 a 80º C. Un ejemplo es una xilanasa termoestable de Thermobifida (Thermomonospora) fusca (Mr: 22 kDa, pl 5) que opera en el intervalo de pH entre 5-8 y a temperaturas de 50-75º C. Otras xilanasas termoestables se describen en la patente internacional WO 03/106654A2.
Sin embargo, para aplicaciones industriales se desean xilanasas muy eficaces con termoestabilidad mejorada.
Sumario de la invención La presente invención describe nuevos polipéptidos con actividad de xilanasa que se caracterizan por alta termoestabilidad. Preferiblemente, el polipéptido según la presente invención mantiene al menos 80%, más preferiblemente más de 90% de su actividad de xilanasa después de 72 horas de incubación a 70º C en tampón de fosfato 50 mM pH 5, 0.
La presente invención proporciona además un ácido nucleico que codifica el polipéptido según la presente invención. En una realización preferida, se proporciona un ácido nucleico que codifica un polipéptido con una secuencia de aminoácidos con al menos 70% de identidad de secuencias, preferiblemente 90% de identidad de secuencia, para la SEC ID Nº 1 o SEC ID Nº 3.
La presente invención proporciona además un vector que comprende un ácido nucleico de la presente invención.
La presente invención proporciona además una célula huésped transformada con un vector que comprende un ácido nucleico de la presente invención.
La invención también proporciona métodos para preparar xilanasas, incluyendo xilanasas selectivas al sustrato y termotolerantes, que comprenden las etapas de: obtener una célula huésped de la presente invención, que se ha transformado con un vector de la presente invención, preferiblemente con un vector que comprende un ácido nucleico que codifica un polipéptido con una secuencia de aminoácidos con al menos 70% de identidad de secuencia para la SEC ID Nº 1, cultivar la célula huésped en condiciones en que se exprese la proteína xilanasa codificada por dicho ácido nucleico y recuperar la proteína xilanasa.
La presente invención proporciona además una composición... [Seguir leyendo]
Reivindicaciones:
1. Un polipéptido que tiene actividad de xilanasa, en el que el polipéptido comprende una secuencia de aminoácidos que tiene al menos 70%, más preferiblemente al menos 75%, 80%, 85%, 90% o 95% de identidad de secuencia para la SEC ID Nº 1.
2. El polipéptido según la reivindicación 1, en el que la secuencia de aminoácidos del polipéptido presenta la secuencia como se define por la SEC ID Nº 1 o SEC ID Nº 2 o SEC ID Nº 3 o SEC ID Nº 4 o una secuencia como se define por la SEC ID Nº 1 o SEC ID Nº 2 o SEC ID Nº 3 o SEC ID Nº 4 en la que1 a 30 restos aminoácido son sustituidos, suprimidos o insertados.
3. El polipéptido según una o más de las reivindicaciones precedentes, en el que el polipéptido mantiene al menos 80%, preferiblemente 90% de su actividad de xilanasa después de haber sido sometido a tripsina a pH 7, 8 y 50º C durante 1 hora.
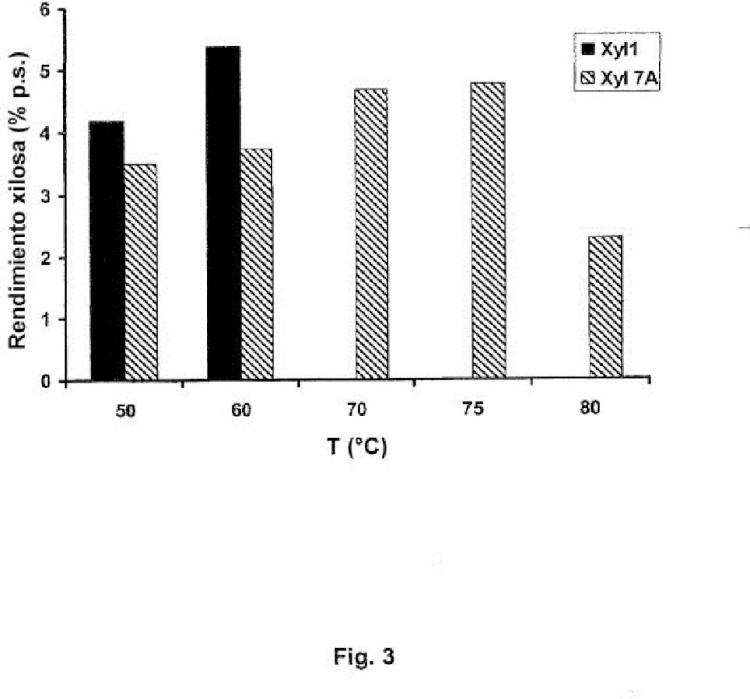
4. El polipéptido según una o más de las reivindicaciones precedentes, en el que la xilanasa muestra una actividad óptima para la hidrólisis de xilosa de paja de trigo en el intervalo de temperatura entre 45 y 80º C, preferiblemente entre 65 y 75º C.
5. El polipéptido según una o más de las reivindicaciones precedentes, que se expresa y se segrega a un nivel mayor que 100 mg/l, más preferiblemente mayor que 1 g/l en el sobrenadante después de introducción de un ácido nucleico que codifica un polipéptido con una secuencia de aminoácidos con al menos 70%, más preferiblemente al menos 75%, 80%, 85%, 90% o 95% de identidad de secuencia para la SEC ID Nº 1 en una levadura.
6. Un ácido nucleico que codifica un polipéptido con una secuencia de aminoácidos con al menos 70%, más preferiblemente al menos 75%, 80%, 85%, 90% o 95% de identidad de secuencia para la SEC ID Nº 1.
7. Un vector que comprende el ácido nucleico según la reivindicación 6.
8. Una célula huésped transformada con un vector según la reivindicación 7.
9. La célula huésped según la reivindicación 8, en la que la célula huésped procede del grupo que consiste en: Saccharomyces cerevisiae, Schizosaccharomyces pombe, Kluyveromyces lactis, Pichia pastoris, Pichia angusta, Hansenula polymorpha, Aspergillus niger, Trichoderma reesei, Penicillium sp.
10. La célula huésped según la reivindicación 8 ó 9, en la que la célula huésped es una levadura metilotrófica, preferiblemente procedente del grupo de células huésped que comprende: Pichia methanolica, Pichia pastoris, Pichia angusta, Hansenula polymorpha.
11. Un método para producir una proteína xilanasa, que comprende las etapas:
a. obtener una célula huésped, que se haya transformado con un vector que comprende el ácido nucleico como se define en la reivindicación 6;
b. cultivo de la célula huésped en condiciones en que se exprese la proteína xilanasa y
c. recuperación de la proteína xilanasa.
12. El método según la reivindicación 11, en el que la célula huésped es una célula de levadura y la proteína xilanasa presenta una secuencia como se define por la SEC ID Nº 3 o se expresa una secuencia como se define por la SEC ID Nº 3 en la que 1 a 30 restos aminoácido son sustituidos, suprimidos o insertados.
13. Composición que comprende el polipéptido según una o más de las reivindicaciones 1 a 5 y una celulasa.
14. Uso del polipéptido según una o más de las reivindicaciones 1 a 5 o de la composición según la reivindicación 13 para la degradación enzimática de biomasa lignocelulósica.
Patentes similares o relacionadas:
Polipéptidos de unión específica novedosos y usos de los mismos, del 15 de Julio de 2020, de Pieris Pharmaceuticals GmbH: Muteína de lipocalina lagrimal humana que tiene especificidad de unión para IL-17A, en la que la muteína se une a IL-17A con una KD de aproximadamente 1 nM o menos, en la que […]
Formulaciones liofilizadas para antídoto del factor Xa, del 1 de Julio de 2020, de PORTOLA PHARMACEUTICALS, INC.: Una formulación acuosa, que comprende de 10 mM a 55 mM de arginina, de 1% a 3% de sacarosa (p/v), de 2% a 8% de manitol (p/v), y al menos 5 mg/ml de un polipéptido […]
Péptidos de unión beta amiloide y sus usos para el tratamiento y el diagnóstico de la demencia de Alzheimer, del 17 de Junio de 2020, de Priavoid GmbH: Péptido que contiene al menos una secuencia de aminoácidos que se une a especies beta amiloides y en el que la carga negativa del grupo carboxilo presente […]
Arginina desiminasa con reactividad cruzada reducida hacia anticuerpos para ADI - PEG 20 para el tratamiento del cáncer, del 6 de Mayo de 2020, de TDW Group: Una composición terapéutica que comprende una arginina desiminasa (ADI) aislada y un vehículo farmacéuticamente aceptable, en donde la ADI aislada comprende la secuencia de […]
Composiciones y métodos utilizando andamios de lisofosfatidilcolina, del 6 de Mayo de 2020, de NATIONAL UNIVERSITY OF SINGAPORE: Un método para seleccionar uno o más compuestos o ácidos grasos para determinar el transporte mediado por lisofosfatidilcolina (LPC) del uno o más compuestos o ácidos […]
Péptidos antimicrobianos y composiciones de los mismos, del 29 de Abril de 2020, de REVANCE THERAPEUTICS, INC: Composición farmacéutica o cosmética que comprende un péptido, en donde dicho péptido consiste en la secuencia de aminoácidos SEQ ID NO: 3 correspondiente […]
COMPOSICIÓN PARA LA ESTIMULACIÓN DEL SISTEMA INMUNE EN PECES QUE CONTIENE PÉPTIDOS RECOMBINANTES, PÉPTIDOS RECOMBINANTES INMUNOESTIMULANTES Y SECUENCIAS NUCLEOTÍDICAS QUE LOS CODIFICAN, del 23 de Abril de 2020, de UNIVERSIDAD DE CONCEPCION: La presente invención se refiere a una composición, una micropartícula y una formulación alimenticia que comprende péptidos recombinantes que estimulan el sistema inmune […]
Nuevo péptido con cuatro epítopos CTL unidos, del 15 de Abril de 2020, de TAIHO PHARMACEUTICAL CO., LTD.: Un péptido que consiste en 4 epítopos unidos, en el que los 4 péptidos de epítopo se seleccionan del grupo que consiste en los péptidos de epítopo CTL: el péptido como […]