Reducción selectiva de los factores de espinosina Et-J y Et-L a spinetoram.
Un proceso para la producción de spinetoram el cual comprende:
hidrogenación de una mezcla que comprende aproximadamente 50 a 90% en peso de 3'-O-etil espinosina J y aproximadamente 50 a 10% en peso de 3'-O-etil espinosina L, en un disolvente orgánico miscible en agua, con gas de hidrógeno a una presión entre 1,378 x 104 y 2,068 x 107 Pa (2 y 3.000 psig), en presencia de un catalizador heterogéneo capaz de reducir selectivamente el doble enlace 5,6 de 3'-O-etil espinosina J, hasta que el 3'-O-etil espinosina J se convierta en 3'-O-etil-5,6-dihidroespinosina J.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2007/023338.
Solicitante: DOW AGROSCIENCES LLC.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 9330 ZIONSVILLE ROAD INDIANAPOLIS IN 46268-1054 ESTADOS UNIDOS DE AMERICA.
Inventor/es: MOLZAHN, DAVID, C., ROTH, GARY, A., PODHOREZ,DAVID E, ADAWAY,TIMOTHY.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07H17/08 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07H AZUCARES; SUS DERIVADOS; NUCLEOSIDOS; NUCLEOTIDOS; ACIDOS NUCLEICOS (derivados de ácidos aldónicos o sacáricos C07C, C07D; ácidos aldónicos, ácidos sacáricos C07C 59/105, C07C 59/285; cianohidrinas C07C 255/16; glicales C07D; compuestos de constitución indeterminada C07G; polisacáridos, sus derivados C08B; ADN o ARN concerniente a la ingeniería genética, vectores, p. ej. plásmidos o su aislamiento, preparación o purificación C12N 15/00; industria del azúcar C13). › C07H 17/00 Compuestos que contienen radicales heterocíclicos unidos directamente a los heteroátomos de los radicales sacárido. › Heterociclos que contienen ocho o más miembros cíclicos, p. ej. eritromicinas.
PDF original: ES-2527095_T3.pdf
Fragmento de la descripción:
Reducción selectiva de los factores de espinosina Et-J y Et-L a spinetoram Compendio de la invención
La presente invención proporciona un proceso de reducción catalítica selectiva para la producción de spinetoram 5 insecticida (también conocido como DE-175).
Más específicamente, la invención proporciona un proceso para la producción de spinetoram que comprende la hidrogenación de una mezcla que comprende aproximadamente 5 a 9% en peso de 3--etil espinosina J y aproximadamente 5 a 1% en peso de 3--etil espinosina L, en un disolvente orgánico miscible en agua, con gas de hidrógeno a una presión entre 1,378 x 14 y 6,894 x 15 Pa (2 y 1 psi), en presencia de un catalizador 1 heterogéneo capaz de reducir selectivamente el doble enlace 5,6 de 3--etil espinosina J, hasta que la 3--etil espinosina J se convierta en 3--etil-5,6-dihidro-espinosina J.
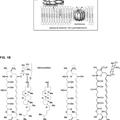
El proceso en su totalidad se muestra en el ESQUEMA 1:
a. ESQUEMA 1
**(Ver fórmula)**H2
catalizador
**(Ver fórmula)** **(Ver fórmula)**Spinetoram es el nombre común para una mezcla de (2R,3aR,5aR,5bS,9S,13S,14R,16aS,16bR)-2-(6-deoxi-3--etil- 2,4-di--metil-a-L-manopiranosiloxi)-13-[(2R,5S,6R)-5-(dimetilamino)tetrahidro-6-metilpiran-2-iloxi]-9-etil- 2,3,3a,4,5,5a,5b,6,9,1,11,12,13,14,16a, 16b-hexadecahidro-14-metil-1 H-as-indaceno[3,2-d]oxaciclododecin-7,15- diona (referido en el Esquema 1 como "dihidro-EKJ") al 5 a 9% y (2R,3aR,5aS,5bS,9S,13S,14R,16aS,16bS)-2-(6- deoxi-3--etil-2,4-di--metil-a-L-manopiranosiloxi)-13-[(2R,5S,6R)-5-(dimetilamino)tetrahidro-6-metilpiran-2-iloxi]-9- 2 etil-2,3,3a,5a,5b,6,9,1,11,12,13,14,16a,16b-tetradecahidro-4,14-dimetil-1R-as-indaceno[3,2-cf]oxaciclododecin-7,15- diona (referido en el Esquema 1 como "Et-L") al 5 a 1%.
La hidrogenación selectiva del doble enlace 5,6 de 3-O-etil espinosina J está descrita en "Pest Management Sci". vol. 57, páginas 177-185 (21).
Descripción detallada de la invención
La invención utiliza un catalizador heterogéneo para dar reducción catalítica selectiva del doble enlace aislado 5,6 sin reducción concomitante del doble enlace conjugado 13,14 del factor de espinosina Et-J. El Factor Et-L intencionadamente no se reduce (más allá de muy pequeñas cantidades) y se transmite al producto. El spinetoram se produce selectivamente y con excelentes rendimientos. El uso de un catalizador heterogéneo en lugar de un catalizador homogéneo simplifica las condiciones del tratamiento final ("workup").
El material de partida para la hidrogenación es una mezcla de los factores de espinosina EKJ y Et-L obtenida
mediante la alquilación de una mezcla de factores de fermentación J y L. Los procedimientos y los esfuerzos para obtener las mezclas de espinosinas J y L están descritos en el documento de Patente US N° 5.22.242. El procedimiento de alquilación está descrito en el documento de Patente US N° 6.1.981.
La mezcla de Et-J y Et-L (Et-J/L) obtenida a partir de la alquilación se puede usar como sólido, obtenido siguiendo el tratamiento final y el aislamiento de la etapa de alquilación. Alternativamente, Et-J/L se puede usar como una disolución obtenida después del intercambio de disolvente. La concentración de Et-J/L en disolución puede ser de 5% a 5% en peso, y preferiblemente se usa en el Intervalo de 2% a 3%. Los porcentajes en peso de Et-J y Et-L en la mezcla Et-J/L no son críticos con tal de que sean seleccionados para producir un producto que contiene dihidro-Et-J y Et-L en una relación de peso de 1/1 a 9/1.
El disolvente usado para la hidrogenación puede ser cualquier disolvente orgánico típico que sea compatible con las condiciones de hidrogenación, tal como tolueno, acetato de etilo, alcoholes (metanol, etanol, 2-propanol), éteres (t- butilmetiléter, tetrahidrofurano) y glicol éteres. Más específicamente, se desea un disolvente miscible en agua para ayudar en la precipitación del spinetoram en la conclusión de la hidrogenación, preferido con dimetoxietano y 2- propanol. El agua se puede usar como codisolvente de a 25% en peso, preferiblemente en el intervalo de 5% a 1% en peso (en base al disolvente principal). La presencia de agua aumenta el índice de hidrogenación y mejora la filtración del catalizador en la conclusión de la hidrogenación.
La hidrogenación se puede llevar a cabo bajo una atmósfera de hidrógeno entre 1,378 x 14 y 2,68 x 17 Pa (2 y 3. psig) de presión. Generalmente, la hidrogenación se conduce a 3,447 x 14-1,34 x 15 Pa (5 a 15 psig) hidrógeno. El rendimiento y la pureza mejoran cuando se disminuye la presión de reacción, pero el índice de
reacción disminuye.
La temperatura de la mezcla de reacción durante la hidrogenación puede ser de °C hasta el punto de ebullición del disolvente a usar. Generalmente la temperatura estará en el Intervalo de °C a 1°C, más generalmente en el intervalo de °C a 5°C. Lo más comúnmente es que la reacción se haga funcionar a temperatura ambiente.
El catalizador usado para la hidrogenación puede ser cualquier catalizador heterogéneo encontrado en la bibliografía que sea capaz de reducir un doble enlace, por ejemplo paladlo, platino, rodio y níquel. Estos catalizadores generalmente se usan sobre un soporte inerte tal como carbono, AI2O3, BaS4 y CaC3, generalmente catalizador al ,5% a 1% en peso para soporte. Los catalizadores pueden estar secos o contener agua hasta el 6% en peso. La cantidad de catalizador usado para la hidrogenación puede ser del ,1% en mol al 1% en mol en base a la cantidad de factores Et-J/L de partida, y lo más comúnmente se usa del 1 al 3 % en mol. Lo más importante es la capacidad para reducir selectivamente el doble enlace 5,6 de Et-J sin reducción concomitante del doble enlace conjugado 13,14 de los factores Et-J. Por ejemplo, Rh/AI23 al 5%, Rh/C al 5%, Pd/C al 5%, Pd/Al23 al 5% dan excelentes resultados. Pd/C al 1%-5% se ha usado con éxito. Pd/CaC3 se ha usado con éxito. También se puede usar un catalizador metálico mezclado, por ejemplo Rh+Pd/C.
La selectividad de reacción aumenta cuando se aumenta la carga del catalizador. Un conjunto de experimentos dieron los siguientes resultados entre catalizador al % en mol y cantidad de reducción en el doble enlace 13,14: (Pd al 1,2% en mol/24+ hr de reacción/2,3% sobre reducción), (Pd al 1,9% en mol/4 hr de reacción/1,5% sobre reducción), y (Pd al 4,2% en mol/2 hrde reacción/,5% sobre reducción).
El pretratamiento de la disolución de alimentación con carbono activado reduce la cantidad de envenenamiento del catalizador, y disminuye la cantidad de catalizador necesario para obtener un índice de reacción razonable.
El pH de la disolución de alimentación debería estar por debajo de 7 para obtener buena selectividad.
El tratamiento final y el aislamiento de la reacción de hidrogenación implican la filtración del catalizador a través de una ayuda de filtración inerte tal como Celite o celulosa, seguida de la adición de agua para precipitar el spinetoram producto final. Este procedimiento presente evita el tedioso tratamiento final y que consume tiempo necesario cuando se usa el catalizador de Wilkinson, evitando así vahas extracciones problemáticas y el uso de éter. El spinetoram producto final se filtra a partir del disolvente acuoso/orgánico y se seca para proporcionar spinetoram adecuado para la formulación.
Ejemplo 1
Hidrogenación con rodio de Et-J/L sólido a Spinetoram usando DME
Se cargó una botella de Parr de pared gruesa de 2 I con 135 g (~,18 mol, ppt a partir de EÍOH/H2) de Et-J/L sólido seguido de 3 mi de 1,2-dimetoxietano (DME). A la disolución se añadió 9,3 g de Rh/AbCb al 5% (4,5 mmol) y se comenzó la agitación magnética. La botella se conectó a un sistema de hidrogenación, y se presionó hasta 4,136 x 14 Pa (6 psi) con N2. La presión se atenuó, y este procedimiento se repitió cuatro veces. Finalmente, la botella se presionó a 1,34 x 15 Pa (15 psi) con H2, se atenuó, y se volvió a presionar a 1,34 x 15 Pa (15 psi) con H2.
La mezcla negra se dejó agitar a 1,34 x 15 Pa (15 psi) H2 durante 17 h, cuando el análisis de 1H NMR Indicó reducción pequeña. La mezcla de reacción se sometió a inertización y se atenuó cinco veces presionando hasta
4,136 x 14 Pa (6 psi) con N2. La mezcla oscura se filtró a través de Celite para separar el catalizador. La disolución amarilla se sometió de nuevo a hidrogenaclón (2,757 x 15 Pa (4 psi) H2) con Rh/Al23 al 5% fresco (9,3 g, 4,5 mmol). Después de 27 h el análisis 1H NMR Indicó reducción completa de Et-J a dihidro Et-J. La mezcla oscura se filtró a través de Celite y se concentró in vacuo para dar 262 g de un aceite oscuro espeso. Éste se añadió gota a gota durante 1,5 h a 55 mi de agua la cual había sido sembrada... [Seguir leyendo]
Reivindicaciones:
1. Un proceso para la producción de spinetoram el cual comprende: hidrogenación de una mezcla que comprende
aproximadamente 5 a 9% en peso de 3-O-etll espinosina J y aproximadamente 5 a 1% en peso de 3--etil
esplnoslna L, en un disolvente orgánico mlsclble en agua, con gas de hidrógeno a una presión entre 1,378 x 14 y
2,68 x 17 Pa (2 y 3. pslg), en presencia de un catalizador heterogéneo capaz de reducir selectivamente el
doble enlace 5,6 de 3--etil esplnoslna J, hasta que el 3--etil espinosina J se convierta en 3--etil-5,6-dihidro- espinoslna J.
2. Un proceso de la reivindicación 1 en el que el disolvente es isopropil alcohol.
3. Un proceso de la reivindicación 1 en el que el catalizador heterogéneo es Rh/Al23 al 5% o Pd/C al 5%.
Patentes similares o relacionadas:
Polimorfos de 20,23-piperidinil-5-O-micaminosiltilonolida, del 20 de Mayo de 2020, de INTERVET INTERNATIONAL B.V: Una forma cristalina de 20,23-dipiperidinil-5-O-micaminosil-tilonolida que tiene al menos una de las siguientes características: un espectro FT-Raman que comprende […]
Derivados de azitromicina con propiedades de potenciación de la barrera epitelial, del 13 de Mayo de 2020, de EpiEndo Pharmaceuticals ehf: Un compuesto de acuerdo con la fórmula (I) **(Ver fórmula)** En donde R1 es OH; R2 es de acuerdo con la fórmula (III) **(Ver […]
Derivados de avermectina B1 que tienen un sustituyente alcoximetilo en la posición 4'''' o 4'', del 17 de Febrero de 2020, de Boehringer Ingelheim Animal Health USA Inc: Compuesto de fórmula**Fórmula** en la que n es 0 o 1; A-B es -CH=CH; R1 es sec-butilo o isopropilo; R2 es CH2CH3, p-ClC6H4, CH2(CH2)2N3 […]
Levoisovalerilespiramicina III y preparaciones, métodos de preparación y utilizaciones de la misma, del 1 de Enero de 2020, de Shenyang Fuyang Pharmaceutical Technology Co., Ltd: Compuesto cristalino de levoisovalerilespiramicina III, en el que, la fórmula estructural química de la levoisovalerilespiramicina III se representa como la fórmula […]
 Derivado de anfotericina b con toxicidad reducida, del 25 de Septiembre de 2019, de THE BOARD OF TRUSTEES OF THE UNIVERSITY OF ILLINOIS: C2'epiAmB, representado por**Fórmula**
o una sal farmacéuticamente aceptable del mismo.
Derivado de anfotericina b con toxicidad reducida, del 25 de Septiembre de 2019, de THE BOARD OF TRUSTEES OF THE UNIVERSITY OF ILLINOIS: C2'epiAmB, representado por**Fórmula**
o una sal farmacéuticamente aceptable del mismo.
Forma cristalina de levoisovalerilespiramicina II y preparaciones, procedimientos de preparación y utilizaciones de la misma, del 7 de Agosto de 2019, de Shenyang Fuyang Pharmaceutical Technology Co., Ltd: Compuesto de levoisovalerilespiramicina II, en el que, la fórmula estructural química de la levoisovalerilespiramicina II se representa como la fórmula (II), en condiciones […]
Derivados de la anfotericina B con índice terapéutico mejorado, del 20 de Septiembre de 2018, de The Board of Trustees of the University of Illionis: Un compuesto, o una sal farmacéuticamente aceptable del mismo, el compuesto que se selecciona de**Fórmula**
Procedimientos para tratar enfermedades gastrointestinales, del 11 de Abril de 2018, de Cempra Pharmaceuticals, Inc: Una cantidad terapéuticamente efectiva de un compuesto de fórmula **Fórmula** o una sal farmacéuticamente aceptable del mismo, donde: R10 es hidrógeno […]