Inhibidores de LOX y LOXL2 y usos de los mismos.
Un anticuerpo aislado o un fragmento de unión a antígeno del mismo que se une a una proteína similar a lisil oxidasa 2 (LOXL2),
en donde dichos anticuerpo o fragmento de unión a antígeno se unen específicamente a la secuencia de aminoácidos de SEC ID Nº: 6 e inhiben la actividad enzimática de la proteína LOXL2, en donde la inhibición es no competitiva.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2008/072039.
Solicitante: Gilead Biologics, Inc.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 333 LAKESIDE DRIVE FOSTER CITY, CA 94404 ESTADOS UNIDOS DE AMERICA.
Inventor/es: SMITH, VICTORIA, VAN VLASSELAER, PETER, OGG,SCOTT, BARRY,VIVIAN E, MARSHALL,DEREK, HOLZER,ALISON KAY, RODRIGUEZ,HECTOR, OYASU,MIHO, MCCAULEY,SCOTT ALAN, GARCIA,CARLOS AURELIO, BIERMANN,DONNA HIROKO TOKUOKA.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K39/395 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Anticuerpos (aglutininas A61K 38/36 ); Inmunoglobulinas; Inmunosuero, p. ej. suero antilinfocitario.
- A61P35/00 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Agentes antineoplásicos.
PDF original: ES-2534490_T3.pdf




Fragmento de la descripción:
Inhibidores de LOX y LOXL2 y usos de los mismos
Antecedentes de la invención El cáncer es un grave problema de salud pública en los Estados Unidos y otros países desarrollados. Actualmente, una de cada cuatro muertes en los estados unidos se debe al cáncer. La terapia para el cáncer implica tratar a los pacientes con fármacos quimioterapéuticos para eliminar células tumorales. Sin embargo, los subconjuntos de células tumorales son frecuentemente resistentes a la terapia con fármacos y sobreviven y vuelven a formar poblaciones en los sitios de origen y en sitios metastásicos distantes, dando lugar a una recurrencia detectable de la enfermedad y a morbilidad. Muchas células tumorales de carcinoma que tienen las propiedades de capacidad invasiva y metastásica aumentadas, y resistencia a fármacos alterada, se cree que han sufrido una transformación morfológica que abarca o es similar a la EMT (transición epitelial-mesenquimal) . Las células que sufren EMT pierden las propiedades adhesivas normales de las células epiteliales y sufren un espectro de cambios que incluyen la pérdida de la expresión de E-cadherina y la expresión de marcadores mesenquimales, una motilidad aumentada, una invasividad aumentada, y una resistencia aumentada a la muerte celular.
Las principales terapias para el cáncer son actualmente cirugía, radiación y quimioterapia. Las estrategias quimioterapéuticas, tales como antibióticos antitumorales, agentes alquilantes, compuestos de nitrosourea, alcaloides de la vinca, hormonas esteroideas, y antimetabolitos forman la mayoría de las terapias disponibles para los oncólogos. A pesar de los avances en el campo del tratamiento del cáncer, el cáncer sigue siendo un problema de salud importante.
La angiogénesis, la formación de nuevos vasos sanguíneos fuera de los capilares preexistentes, es una secuencia de eventos que es de importancia clave en una amplia variedad de procesos fisiológicos y patológicos. El crecimiento normal de tejidos, tal como el desarrollo embrionario, cicatrización de heridas, y el ciclo menstrual, está caracterizado por la dependencia de la formación de nuevos vasos para el suministro de oxígeno y nutrientes así como la retirada de productos de desecho. Una gran variedad de enfermedades diferentes y no relacionadas también se asocian con la formación de nueva vasculatura. Entre determinadas patologías, hay afecciones en las que la angiogénesis es baja, y debe potenciarse para mejorar los estados de enfermedad. Más frecuentemente, sin embargo, la angiogénesis excesiva es una característica importante de varias patologías, incluyendo patologías caracterizadas o asociadas con una proliferación de células anormal o no controlada. Las patologías que implican una angiogénesis excesiva incluyen, por ejemplo, cánceres (tumores tanto sólidos como hematológicos) ,
enfermedades cardiovasculares (tales como aterosclerosis y restenosis) , inflamación crónica (artritis reumatoide, enfermedad de Crohn) , diabetes (retinopatía diabética) , psoriasis, endometriosis, glaucoma neovascular y adiposidad (3) . Estas afecciones pueden beneficiarse de la inhibición quimioterapéutica de la angiogénesis.
Hablando de manera general, el proceso angiogénico implica la proliferación y migración de un endotelio normalmente quiescente, la proteolisis controlada de la matriz pericelular, y la síntesis de nuevos componentes de matriz extracelular por los capilares en desarrollo. El establecimiento de nuevos contactos intra e intercelulares y la diferenciación morfológica de células endoteliales a redes tubulares de tipo capilar proporciona soporte para su posterior maduración, ramificación, remodelado y regresión selectiva para formar una red microvascular funcional elevadamente organizada. Las interacciones autocrinas, paracrinas y anficrinas del endotelio vascular con sus 45 componentes estromales circundantes, así como con las citocinas pro-angiogénicas y angiostáticas y factores de crecimiento que orquestan la angiogénsis fisiológica, normalmente están estrechamente reguladas tanto espacial como temporalmente.
La angiogénesis es crucial para el crecimiento de tejidos neoplásicos. Durante más de 100 años, se han observado los tumores más como tejidos vasculares que normales. Varios estudios experimentales han sugerido que tanto el crecimiento primario de tumores como la metástasis necesitan neovascularización. A diferencia del proceso bien orquestado descrito anteriormente para el crecimiento normal de tejidos, la angiogénesis patológica necesaria para el crecimiento activo de tumores es generalmente sostenida y persistente, siendo la adquisición inicial del fenotipo angiogénico un mecanismo común para el desarrollo de varios tipos de tumores sólidos y hematopoyéticos. Los 55 tumores que son incapaces de reclutar y mantener una red vascular permanecen normalmente durmientes como lesiones asintomáticas in situ. La metástasis también es dependiente de la angiogénesis: para que una célula tumoral metastatice de manera exitosa, generalmente tiene que lograra acceso a la vasculatura en el tumor primario, sobrevivir a la circulación, detenerse en la microvasculatura del órgano diana, salir de esta vasculatura, crecer en el órgano diana, e inducir la angiogénesis en el sitio diana. Por lo tanto, la angiogénesis parece ser necesaria al comienzo así como la compleción de la cascada metastásica.
La capacidad crítica de la angiogénesis para el crecimiento y la metástasis de neoplasias proporciona por lo tanto una diana potencial óptima para los esfuerzos quimioterapéuticos. Los agentes anti-angiogénicos adecuados pueden actuar directamente o indirectamente para influenciar la angiogénsis asociada a tumores ya sea retrasando su 65 aparición (es decir, bloqueando un "interruptor angiogénico") o bloqueando la neovascularización sostenida y focal que es característica de muchos tipos de tumores. Las terapias anti-angiogénsis dirigidas contra el endotelio
asociado al tumor y los múltiples procesos moleculares y celulares y dianas implicadas en la angiogénesis patológica sostenida se están evaluando activamente en cuanto a su seguridad y eficacia en múltiples ensayos clínicos. Sin embargo, ha habido un éxito limitado hasta la fecha en cuanto al descubrimiento y/o identificación de agentes antiangiogénicos seguros y/o eficaces.
La fibrosis es la acumulación anormal de tejido fibrótico que puede suceder como parte del proceso de curación de heridas en el tejido dañado. Dicho daño tisular puede ser el resultado de una lesión física, inflamación, infección, exposición a toxinas, y otras causas.
La fibrosis de hígado (hepática) , por ejemplo, sucede como parte de la respuesta de curación de heridas en la lesión hepática crónica. La fibrosis sucede como una complicación de la hemocromatosis, la enfermedad de Wilson, el alcoholismo, la esquistosomiasis, la hepatitis vírica, la obstrucción del conducto biliar, exposición a toxinas, y trastornos metabólicos. Esta formación de tejido cicatrizal se cree que representa un intento del cuerpo para encapsular al tejido lesionado. La fibrosis hepática está caracterizada por la acumulación de matriz extracelular que puede distinguirse cualitativamente de aquella en el hígado normal. Si no se controla, la fibrosis hepática progresa a cirrosis (definida por la presencia de nódulos encapsulados) , insuficiencia hepática, y la muerte.
Como se resume por Li y Friedman (Gastroenterol. Hepatol. 14:618-633, 1999) , las estrategias terapéuticas actuales y propuestas para la fibrosis hepática incluyen la eliminación de la causa subyacente (por ejemplo, toxina o agente 20 infeccioso) , la supresión de la inflamación (usando, por ejemplo, corticoesteroides, antagonistas del receptor de IL-1, u otros agentes) , la regulación negativa de la activación de células estrelladas usando, por ejemplo, interferón gamma y antioxidantes) , la promoción de la degradación de la matriz, o la promoción de la apoptosis de células estrelladas. A pesar del progreso reciente, muchas de estas estrategias todavía se encuentran en etapa experimental, y las terapias existentes están dirigidas a la supresión de la inflamación más que a dirigirse a los procesos bioquímicos subyacentes. Por lo tanto, sigue habiendo una necesidad en la técnica de materiales y métodos para tratar la fibrosis, incluyendo la fibrosis hepática y pulmonar.
Los tejidos fibróticos se acumulan en el corazón y los vasos sanguíneos a causa de la hipertensión, de la enfermedad cardíaca hipertensiva, aterosclerosis, e infarto de miocardio. La presión sanguínea elevada, o 30 hipertensión, puede estar causada por varios factores y a menudo da lugar al desarrollo de la enfermedad coronaria... [Seguir leyendo]
Reivindicaciones:
1. Un anticuerpo aislado o un fragmento de unión a antígeno del mismo que se une a una proteína similar a lisil oxidasa 2 (LOXL2) , en donde dichos anticuerpo o fragmento de unión a antígeno se unen específicamente a la secuencia de aminoácidos de SEC ID Nº : 6 e inhiben la actividad enzimática de la proteína LOXL2, en donde la inhibición es no competitiva.
2. El anticuerpo o el fragmento de unión a antígeno del mismo de la reivindicación 1, en donde el anticuerpo o el fragmento comprenden una cadena pesada variable que tiene al menos un 75 % de identidad de secuencia de aminoácidos con una secuencia de aminoácidos expuesta como SEC ID Nº : 1.
3. El anticuerpo o el fragmento de unión a antígeno del mismo de la reivindicación 1 o la reivindicación 2, en donde el anticuerpo o el fragmento comprenden una cadena ligera variable que tiene al menos un 75 % de identidad de secuencia de aminoácidos con una secuencia de aminoácidos expuesta como SEC ID Nº : 2.
4. El anticuerpo o el fragmento de unión a antígeno del mismo de cualquiera de las reivindicaciones 1-3, en donde dichos anticuerpo o fragmento de unión a antígeno están humanizados o son humanos.
5. El anticuerpo o el fragmento de unión a antígeno del mismo de la reivindicación 4, en donde el anticuerpo el o fragmento están humanizados y comprenden las CDR de cadena pesada variable que tienen las secuencias de aminoácidos de CDR1-3 de GYAFTYYLIE (SEC ID Nº : 41) , VINPGSGGTNYNEKFKG (SEC ID Nº : 42) y NWMNFDY, respectivamente, y las CDR de cadena ligera variable que tienen las secuencias de aminoácidos de CDR1-3 de RSSKSLLHSNGNTYLY (SEC ID Nº : 57) , RMSNLAS (SEC ID Nº : 58) y MQH-LEYPYT (SEC ID Nº : 59) , respectivamente.
6. El anticuerpo o el fragmento de unión a antígeno del mismo de las reivindicaciones 4 o 5, en donde el anticuerpo o el fragmento están humanizados y tienen una cadena pesada variable que tiene al menos un 75 % de identidad de secuencia de aminoácidos con una secuencia de aminoácidos expuesta en SEC ID Nº : 25, 26, 27 o 28.
7. El anticuerpo o el fragmento de unión a antígeno del mismo de la reivindicación 6, en donde la cadena pesada variable comprende la SEC ID Nº : 27.
8. El anticuerpo o el fragmento de unión a antígeno del mismo de cualquiera de las reivindicaciones 4-7, en donde el anticuerpo o el fragmento están humanizados y tienen una cadena ligera variable que tiene al menos un 75 % de identidad de secuencia de aminoácidos con una secuencia de aminoácidos expuesta en SEC ID Nº : 30, 31 o 32.
9. El anticuerpo o el fragmento de unión a antígeno del mismo de la reivindicación 8, en donde la cadena ligera variable comprende la SEC ID Nº : 31.
10. Un anticuerpo humanizado o un fragmento de unión a antígeno del mismo de acuerdo con la reivindicación 1, que compiten con un anticuerpo o un fragmento de unión a antígeno del mismo que comprenden una cadena pesada variable que tiene una secuencia de aminoácidos expuesta como SEC ID Nº : 1 y una cadena ligera variable que tiene una secuencia de aminoácidos expuesta como SEC ID Nº : 2 por la unión a LOXL2.
11. El anticuerpo o el fragmento de unión a antígeno del mismo de cualquiera de las reivindicaciones 1-10, en donde el anticuerpo o el fragmento están marcados con un marcador terapéutico o un marcador diagnóstico.
12. El anticuerpo o el fragmento de unión a antígeno del mismo de cualquiera de las reivindicaciones 1-11, en donde el anticuerpo o el fragmento están marcados con un marcador detectable.
13. El anticuerpo o el fragmento de unión a antígeno del mismo de cualquiera de las reivindicaciones 1-12, en donde el anticuerpo o el fragmento son un Fv, un scFv, un Fab, un F (ab') 2, un anticuerpo diseñado por ingeniería genética,
o un anticuerpo monoclonal.
14. El anticuerpo o el fragmento de unión a antígeno del mismo de cualquiera de las reivindicaciones 1-13, para su uso en un método para reducir el crecimiento tumoral, reducir la metástasis, inhibir la angiogénesis, tratar la fibrosis o disminuir la formación de matriz extracelular.
15. El anticuerpo o el fragmento de unión a antígeno del mismo para su uso en un método de acuerdo con la reivindicación 14, en el que dichos anticuerpo o fragmento de unión a antígeno del mismo se usan en combinación con un segundo agente terapéutico.
16. El anticuerpo o el fragmento de unión a antígeno del mismo para su uso en un método de acuerdo con la reivindicación 15, en el que el segundo agente terapéutico es un anticuerpo o un agente quimioterapéutico.
17. El anticuerpo o el fragmento de unión a antígeno del mismo para su uso en un método de acuerdo con la reivindicación 14, en el que dicha fibrosis es una fibrosis hepática, una fibrosis pulmonar, una fibrosis renal, una fibrosis cardíaca o escleroderma.
18. El anticuerpo o el fragmento de unión a antígeno del mismo para su uso en un método de acuerdo con la reivindicación 17, en el que dicha fibrosis pulmonar es fibrosis pulmonar idiopática (FPI) , alveolitis fibrosante criptogénica, neumonía intersticial fibrosante crónica, enfermedad pulmonar intersticial (ILD) , enfermedad pulmonar parenquimal difusa (DPLD) , enfisema, enfermedad pulmonar obstructiva crónica (EPOC) o asma crónica.
19. El anticuerpo o el fragmento de unión a antígeno del mismo para su uso en un método de acuerdo con la reivindicación 17, en el que dicha fibrosis hepática es cirrosis, hepatitis viral crónica, enfermedad del hígado graso no alcohólico (NAFLD) , esteatohepatitis alcohólica (ASH) , esteatohepatitis no alcohólica (NASH) , cirrosis biliar primaria (PBC) , cirrosis biliar o hepatitis autoinmune.
FIGURA 1 Enzimología de lisil oxidasa
Las enzimas LOX/L actúan por medio de un mecanismo de ping-pong que puede describirse mediante la cinética de Michaelis-Menten
FIGURA 2 Modos comunes de inhibición enzimática
Inhibición competitiva
• El inhibidor normalmente tiene similitud estructural con respecto al sustrato.
• Inhibición perceptible a bajas concentraciones de sustrato pero pueden superarse a altas concentraciones de sustrato.
Inhibición a competitiva
• El inhibidor se une en el sitio que esté disponible después de que el sustrato se una al sitio activo
• Inhibición más perceptible a alta concentración de sustrato
Inhibición no competitiva
• El inhibidor se une a un sitio que está lejos del sitio de unión del sustrato
• La inhibición relativa es la misma a todas las concentraciones de sustrato.
FIGURA 3
APN es un inhibidor no competitivo de LOXL2
FIGURA 4
Modos inhibición enzimática: LOXL2
Figura 5 LOXL2 extracelular: Localización y Función
A alta densidad celular, LOXL2 se secreta y detecta unida a la matriz y, en medio condicionado, un anticuerpo bloqueante se unirá covalentemente a todos los estados e inhibirá todas las actividades Figura 6 Anticuerpo anti-LOXL2 monoclonal murino
A. Cadena pesada variable
B. Cadena ligera variable
Figura 7 Anticuerpo anti-LOX
A. Cadena pesada variable
B. Cadena ligera variable 1
C. Cadena pesada variable 2
Figura 8
Anticuerpos anti-LOXL2: Actualización proteína Exploración B Evaluación de la actividad enzimática de LOXL2
Anticuerpo anti-LOXL2 designado AB0023
• Actividad inhibidora observada en 10 ml del material de la proporción en el ensayo enzimático
• La inhibición también se repetirá en ensayos basados en células
• El análisis de secuencia confirma que M01, M16, M19, M20 son idénticos
Figura 9 Anticuerpo anti-LOXL2 AB0023 y actividad enzimática
AB0023 es un inhibidor parcial de la actividad enzimática de LOXL2 con una CI50 aparente de ~30nM
Figura 10
Anticuerpo anti-LOXL2 AB0023: un inhibidor no competitivo
Figura 11 Anticuerpo anti-LOXL2 AB0023: Afinidad de unión y velocidad de disociación
Análisis usando el ProteOn 1 ug/ml de AB0023 (M20) inmovilizado en un chip Se aplicó LOXL2 en concentraciones variables al chip
6. 1 -1
• kon=1, 68 x l0Ms - 4 -1
• koff=1, 17 x l0s
•KD=0, 69 nM
• t1/2 =98, 7 min
El anticuerpo se une muy fuertemente y se libera muy despacio Kd estimada de diversos métodos 0, 1 – 1, 0 nM
Figura 12
Mapeo de los dominios de anticuerpo anti-LOXL2 AB0023
AB0023 se une al dominio SRCR 3-4
AB0023 se une al dominio SRCR 3-4
Figura 13
Anticuerpo anti-LOXL2 AB0023: Ensayos basados en células
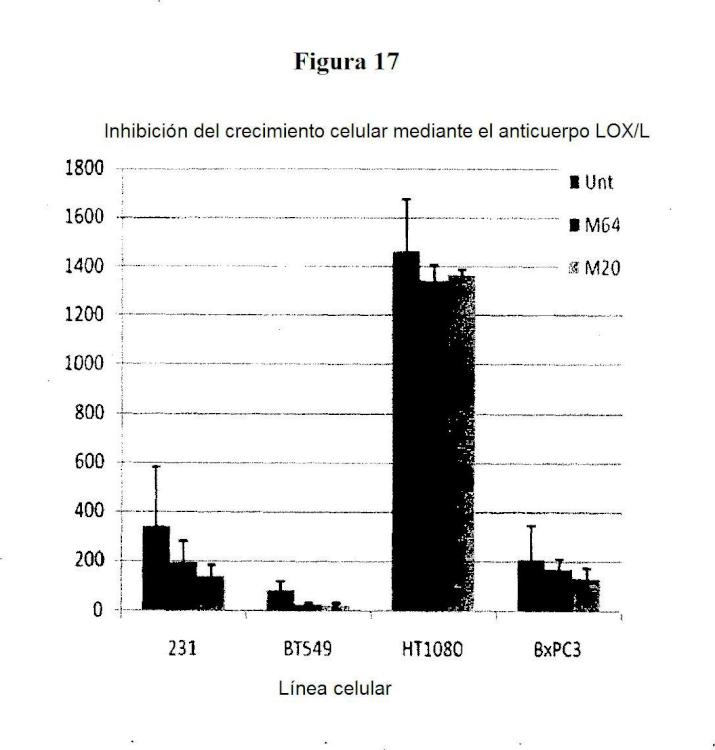
• Inhibición consistente de la migración/invasión en colágeno I y colágeno IV, de sobrenadantes a través de 10 ml del material de la proporción y 100 ml de la proporción a mayor escala y material ascítico.
• También se observó inhibición parcial en el ensayo de adhesión celular
Sensibilidad a DDP en la línea celular MiaPaCa 2 en placas de CT tratadas CI50
Línea celular No tratado (uM) Anti-LOX (M64) (uM)
231 261, 8 ± 72, 3 242, 2 ± 14, 4
HT1080 207, 5 ± 6, 9 194, 2 ± 22, 7
MiaPaCa 2 664, 6 ± 112, 8 174, 7 ± 5, 7
BT549 384 ± 244, 3 197, 3 ± 28, 5
Patentes similares o relacionadas:
Profármacos de gemcitabina, del 29 de Julio de 2020, de NuCana plc: Una formulación farmacéutica que comprende gemcitabina-[fenil-benzoxi-L-alaninil)]-(S)-fosfato 3: **(Ver fórmula)** o una sal o solvato […]
Formas cristalinas de 6-((6,7-dimetoxiquinazolin-4-il)oxi)-N,2-dimetilbenzofuran-3-carboxamida, del 29 de Julio de 2020, de Hutchison Medipharma Limited: Forma I de 6-((6,7-dimetoxiquinazolin-4-il)oxi)-N,2-dimetilbenzofuran-3-carboxamida, en donde el difractograma de rayos X de polvo de la Forma […]
Compuestos y procedimientos de uso, del 29 de Julio de 2020, de Medivation Technologies LLC: Un compuesto de fórmula (Aa-1): **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en la que: A representa H, halógeno, amino, […]
Complejos de agentes terapéuticos de base vírica y poli(beta-amino-ésteres) modificados, del 29 de Julio de 2020, de Sagetis Biotech, SL: Un complejo de un agente terapéutico de base vírica con un polímero de fórmula I: **(Ver fórmula)** donde cada L1 y L2 están seleccionados […]
Compuestos de alquinilbenceno heterocíclicos, y composiciones médicas y usos de los mismos, del 29 de Julio de 2020, de Guangzhou Healthquest Pharma Co., Ltd: Un compuesto de alquinilbenceno heterocíclico que tiene la fórmula (I) y una sal farmacéuticamente aceptable, o estereoisómero del mismo, **(Ver […]
 Composiciones y métodos para el tratamiento de trastornos de células plasmáticas y trastornos prolinfocíticos de células b, del 29 de Julio de 2020, de Knopp Biosciences LLC: Una composición que comprende una cantidad terapéuticamente eficaz de dexpramipexol para su uso en el tratamiento de un trastorno de células B caracterizado por niveles elevados […]
Composiciones y métodos para el tratamiento de trastornos de células plasmáticas y trastornos prolinfocíticos de células b, del 29 de Julio de 2020, de Knopp Biosciences LLC: Una composición que comprende una cantidad terapéuticamente eficaz de dexpramipexol para su uso en el tratamiento de un trastorno de células B caracterizado por niveles elevados […]
Derivados de piperidina 1,4 sustituidos, del 29 de Julio de 2020, de 89Bio Ltd: Un compuesto de acuerdo con la Fórmula I: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en donde: A se selecciona de […]
Método de tratamiento del cáncer, del 22 de Julio de 2020, de Intensity Therapeutics, Inc: Una composición que comprende una cantidad terapéuticamente efectiva de un agente terapéutico y un agente mejorador de la permeación intracelular para uso en el tratamiento […]