Proteínas de fusión que comprenden los antígenos de rechazo tumoral NY-ESO-1 y LAGE-1.
Una proteína de fusión, que comprende:
(a) NY-ESO-1 o un fragmento del mismo,
enlazado con
(b) LAGE-1 o un fragmento del mismo,
en la que al menos uno de NY-ESO-1 y/o LAGE-1 está truncado o parcialmente truncado, o es un fragmento queincluye uno o más epítopos de NY-ESO-1 o LAGE-1, comprendiendo la proteína de fusión una secuencia deaminoácidos seleccionada del grupo que consiste en SEC ID Nº 73, SEC ID Nº 75, SEC ID Nº 79, SEC ID Nº 81,SEC ID Nº 83, SEC ID Nº 85 SEC ID Nº 89, SEC ID Nº 93 y SEC ID Nº 97.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2008/050879.
Solicitante: GLAXOSMITHKLINE BIOLOGICALS SA.
Nacionalidad solicitante: Bélgica.
Dirección: RUE DE L'INSTITUT 89 1330 RIXENSART BELGICA.
Inventor/es: RIOUX, CLEMENT, BRICHARD, VINCENT, BOYER,MARTINE, MARTIN,DENIS, BLAIS,NORMAND, PALMANTIER,REMI M, LOUAHED,JAMILA.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K39/00 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53).
- C07K14/47 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › de mamíferos.
PDF original: ES-2398492_T3.pdf
Fragmento de la descripción:
Proteínas de fusión que comprenden los antígenos de rechazo tumoral NY-ESO-1 y LAGE-1
Campo de la invención La presente invención se refiere en general a polipéptidos y a constructos que comprenden un antígeno derivado de uno de los antígenos de rechazo tumoral NY-ESO-1 y LAGE-1 o de ambos.
Antecedentes de la invención Los antígenos de cáncer testicular (CT) son una clase de antígenos asociados a tumores con una expresión normalmente restringida a células germinales de los testículos, ovarios o células trofoblásticas. Estos antígenos no se expresan normalmente en tejidos somáticos adultos. Véase Simpson y col., Nat. Rev. Cancer, 5 (8) :615-625 (2005) ; Scanlan y col., Immunol. Reviews, 188:22-32 (2002) ; Scanlan y col., Canc. Immun., 4:1-15 (2004) .
La regulación genética de los antígenos de CT se altera en los pacientes de cáncer, conduciendo a la expresión aberrante de estos antígenos en una amplia diversidad de tumores. El primer antígeno de CT que se identificó, MAGE-1, fue identificado a principios de la década de 1990, mediante la clonación del epítopo de linfocitos T (van der Bruggen y col., 1991 Science 13;254 (5038) :1643-7; van der Bruggen y col., 1999 Science 254:1643-1647; Traversari y col., 1992 Immunogenetics, 35 (3) :145-152; y Patente de los Estados Unidos de Norteamérica Número 5.342.774) . Desde entonces, la técnica de clonación de expresión serológica (SEREX) (Sahin y col., Proc. Natl. Acad. Sci. EUA, 92 (25) :11810-11813 (1995) y patente de Estados Unidos Número 5.698.396) , la expresión de antígeno recombinante sobre superficie de levadura (RAYS) (Mischo y col., Canc. Immun., 3:5-16 (2003) ) , y el análisis de expresión de ARNm diferencial (Gure y col., Int. J. Canc., 85 (5) :726-732 (2000) ) , han conducido a la identificación de aproximadamente 90 antígenos de CT, y se espera que su número crezca en los próximos años. La inmunogenicidad de algunos antígenos de CT en pacientes de cáncer, los hace un objetivo ideal para el desarrollo de vacunas tumorales.
NY-ESO-1. Un antígeno de cáncer testicular que actualmente es de interés para su uso en la inmunoterapia de cáncer es NY-ESO-1. Este antígeno fue primeramente identificado por SEREX en un carcinoma esofágico de células escamosas a finales de la década de 1990, en la Sucursal de Nueva York del Ludwig Institute for Cancer Research (Chen y col., PNAS EUA, 94 (5) :1914-1918 (1997) ; y patente de Estados Unidos Número 5.804.381) .
La proteína NY-ESO-1 tiene una longitud de 180 aminoácidos y se puede describir como compuesta por tres regiones:
• Una región N-terminal: aproximadamente o alrededor de los aminoácidos 1 a 70,
• Una región central: aproximadamente o alrededor de los aminoácidos 71 a 134, y
• Una región C-terminal: aproximadamente o alrededor de los aminoácidos 135 a 180.
Una región de tipo colágeno comprende aproximadamente o alrededor de los aminoácidos 15 a 73 de la región Nterminal (véase la Figura 1) .
La proteína NY-ESO-1 se ha encontrado en una amplia variedad de tumores, incluyendo, pero sin limitarse a, cáncer de ovario, cáncer de pulmón, cáncer de mama, cáncer de próstata, cáncer esofágico, cáncer de vejiga, y en melanomas. (Nicholaou T y col., Immunol Cell Biol. Junio 2006; 84 (3) : 303-17 y Jungbluth y col., 2001, Int. J. Canc., 92 (6) : 856-860) . Se han descrito respuestas inmuninatarias humorales y celulares espontáneas contra este antígeno en pacientes con tumores positivos a NY-ESO-1 y se ha identificado un número de péptidos restringidos a HLA (Antígeno de Leucocitos Humanos) clase I y II (Jager y col., 1998 J. Exp. Med., 187 (2) : 265-270; Yamaguchi y col., 2004 Clin. Canc. Res., 10 (3) : 890-961; y Davis y col., 2004 Proc. Natl. Acad. Sci. EUA, 101 (29) :10697-10702) . Los ejemplos de la literatura de patente son las patentes de Estados Unidos Números 6.140.050; 6.251.603; 6.242.052; 6.274.145; 6.338.947; 6.417.165; 6.525.177; 6.605.711; 6.689.742; 6.723.832; 6.756.044 y 6.800.730. En un estudio clínico, se usaron tres péptidos derivados de NY-ESO-1 parcialmente sobrelapados con motivos de unión con HLA-A2 (157-167, 157-165 y 155-163) en una vacuna para tratar a doce pacientes con tumores que expresaban NY-ESO-1 metastásico. Este estudio demostró que se pueden administrar péptidos de NY-ESO-1 sintéticos con seguridad, y son capaces de generar respuestas de linfocitos T potencialmente benéficas (Jager y col., 2000 PNAS EUA, 97 (22) : 12198-12203) .
Se han identificado un número de epítopos de MHC (complejo de histocompatibilidad principal) de clase I y II en la proteína por diferentes grupos, véase, por ejemplo, la Figura 1. Estos epítopos son meramente representativos de los epítopos comunicados para la proteína, y la lista de la Figura 1 no es exhaustiva. Adicionalmente, al menos uno o más de los epítopos comunicados y/o enumerados en la Figura 1 no han sido confirmados mediante experimentación. La región de tipo colágeno en el extremo N-teminal contiene al menos un epítopo de MHC de clase I denominado en el presente documento A31. La región central comprende varios epítopos de MHC de clase II, denominados en el presente documento DR1, DR2, DR4, DR7 y DP4. Esta región también contiene varios epítopos
de MHC de clase I denominados en el presente documento B35, B51, Cw3 y Cw6. Se cree que el extremo Cterminal contiene al menos dos epítopos de clase II (DR4 y DP4) y un epítopo de clase I (A2) .
LAGE-1. También se ha identificado un antígeno de cáncer testicular adicional, LAGE-1. Se han descrito dos tránscriptos de LAGE-1: LAGE-1a y LAGE1b. LAGE-1b está ayustado incompletamente y codifica una proteína putativa de aproximadamente 210 residuos de aminoácidos, mientras que el producto genético LAGE-1a contiene 180 residuos de aminoácidos (Sun y col., Cancer Immunol Immunother 2006: 55: 644-652) .
Las regiones N-terminales de las proteínas LAGE-1 y NY-ESO-1 están muy conservadas, y se piensa que tienen más del 97 por ciento de identidad. Sin embargo, LAGE-1 difiere de NY-ESO-1 en las regiones centrales, que son solamente idénticas en un 62 %. Los extremos C-terminales de NY-ESO-1 y LAGE-1 están muy conservados (más del 97 por ciento de identidad) . Sin embargo, el extremo C-terminal de LAGE-1a es más largo y no está conservado, y se piensa que tiene menos del 50 por ciento de identidad con la misma región de LAGE-1a/NY-ESO-1.
La información general en relación con estas proteínas está disponible en el sitio web de LICR (véase www.cancerimmunity.org/CIdatabase) .
Sumario de la invención La presente invención proporciona una proteína de fusión inmunogénica que comprende:
(i) NY-ESO-1 o un fragmento del mismo, enlazado con
(ii) LAGE-1 o un fragmento del mismo,
en la que al menos uno de NY-ESO-1 y/o LAGE-1 está truncado o parcialmente truncado, o es un fragmento que incluye uno o más epítopos de NY-ESO-1 o LAGE-1, comprendiendo la proteína de fusión una secuencia de aminoácidos seleccionada del grupo que consiste en SEC ID Nº 73, SEC ID Nº 75, SEC ID Nº 79, SEC ID Nº 81, SEC ID Nº 83, SEC ID Nº 85 SEC ID Nº 89, SEC ID Nº 93 y SEC ID Nº 97.
También se proporcionan composiciones que implican proteínas y polipéptidos de fusión.
Breve descripción de las figuras La Figura 1 muestra un número de epítopos de MHC (complejo de histocompatibilidad principal) de clase I y clase II en la proteína NY-ESO-1, que han sido identificados por diferentes grupos. Estos epítopos son meramente representativos de los epítopos comunicados para la proteína, de modo que la lista de la Figura 1 no es exhaustiva. Adicionalmente, al menos uno o más de los epítopos comunicados y/o enumerados en la Figura 1 no han sido confirmados mediante experimentación. La secuencia de aminoácidos que se ha comunicado para NY-ESO-1 se encuentra en el presente documento en la SEC ID Nº 49.
La Figura 2 muestra el constructo A, una proteína de fusión que comprende el NY-ESO-1 de longitud completa y el LAGE-1 truncado, tal como LAGE-1a. En esta realización, el extremo C-terminal del NY-ESO-1 está fusionado con el extremo N-terminal del LAGE-1 truncado, junto con una etiqueta de afinidad de histidina para proporcionar una proteína de fusión de 288 aminoácidos de longitud. Otros detalles del constructo A se dan en la Tabla 1 (SEC ID Nº 1; SEC ID Nº 3) .
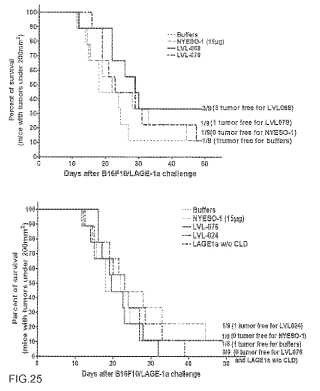
La Figura 3 muestra el constructo B, una proteína de fusión que comprende el primer tercio de la proteína D sin su señal de secreción (por ejemplo, los aminoácidos 20 a 127) , el NY-ESO-1 de longitud completa y el LAGE-1 truncado, tal como LAGE-1a. En esta realización, el aminoácido 127 de la proteína D está fusionado con el extremo... [Seguir leyendo]
Reivindicaciones:
1. Una proteína de fusión, que comprende:
(a) NY-ESO-1 o un fragmento del mismo, enlazado con
(b) LAGE-1 o un fragmento del mismo,
en la que al menos uno de NY-ESO-1 y/o LAGE-1 está truncado o parcialmente truncado, o es un fragmento que incluye uno o más epítopos de NY-ESO-1 o LAGE-1, comprendiendo la proteína de fusión una secuencia de aminoácidos seleccionada del grupo que consiste en SEC ID Nº 73, SEC ID Nº 75, SEC ID Nº 79, SEC ID Nº 81, SEC ID Nº 83, SEC ID Nº 85 SEC ID Nº 89, SEC ID Nº 93 y SEC ID Nº 97.
2. Una molécula de ácido nucleico que codifica la proteína de fusión de la reivindicación 1.
3. Un vector que comprende la molécula de ácido nucleico de la reivindicación 2.
4. Una célula huésped transformada con un vector de la reivindicación 3.
5. Una composición inmunogénica o una vacuna que comprenden una proteína de fusión según la reivindicación 1, una molécula de ácido nucleico tal como se reivindica en la reivindicación 2 o un vector tal como se reivindica en la reivindicación 3 que comprende adicionalmente un coadyuvante y/o una citocina o una quimiocina inmunoestimulantes.
6. Una composición inmunogénica o una vacuna tal como se reivindica en la reivindicación 5 para su uso en medicina.
Tipo
Tumores con adyuvante/antígeno
Patentes similares o relacionadas:
Eliminación de impurezas de cultivos celulares residuales, del 29 de Julio de 2020, de NOVARTIS AG: Un método para eliminar la Proteína Nuclear (NP) de la Gripe de una preparación que comprende proteínas del virus de la gripe de interés que incluyen hemaglutinina […]
 Cepas de Bordetella vivas atenuadas como vacuna de dosis única contra la tos ferina, del 29 de Julio de 2020, de INSTITUT PASTEUR DE LILLE: Una vacuna que comprende una cepa viva, atenuada y mutada de Bordetella pertussis que comprende al menos una mutación del gen (ptx) de la toxina […]
Cepas de Bordetella vivas atenuadas como vacuna de dosis única contra la tos ferina, del 29 de Julio de 2020, de INSTITUT PASTEUR DE LILLE: Una vacuna que comprende una cepa viva, atenuada y mutada de Bordetella pertussis que comprende al menos una mutación del gen (ptx) de la toxina […]
Inmunoterapia novedosa contra diversos tumores, entre ellos tumores cerebrales y neuronales, del 22 de Julio de 2020, de IMMATICS BIOTECHNOLOGIES GMBH: Péptido que comprende una secuencia de aminoácidos acorde con la SEQ ID N.º 19, en que dicho péptido tiene una longitud total de entre 9 y 16 aminoácidos.
Método para producir inmunoconjugados de anticuerpo-SN-38 con un enlazador CL2A, del 22 de Julio de 2020, de IMMUNOMEDICS, INC.: Un método para producir un compuesto, CL2A-SN-38, que presenta la estructura, **(Ver fórmula)** que comprende realizar un esquema de reacción como el que se muestra: **(Ver […]
Composición de vacuna que contiene un adyuvante sintético, del 22 de Julio de 2020, de INFECTIOUS DISEASE RESEARCH INSTITUTE: Una composición farmacéutica que comprende: un adyuvante lípido de glucopiranosilo (GLA), que tiene la fórmula: **(Ver fórmula)** en la que: […]
Arenavirus trisegmentados como vectores de vacunas, del 22 de Julio de 2020, de UNIVERSITE DE GENEVE: Una partícula de arenavirus trisegmentada infecciosa y competente para la replicación que comprende un segmento L y dos segmentos S, en donde uno de los dos segmentos […]
Polipéptidos biparatópicos antagonistas de la señalización WNT en células tumorales, del 15 de Julio de 2020, de Boehringer Ingelheim International GmbH & Co. KG: Un polipéptido que se une específicamente a LRP5 o LRP6, que comprende - un primer dominio variable individual de inmunoglobulina seleccionado del grupo de dominios […]
Anticuerpos del OPGL, del 15 de Julio de 2020, de AMGEN FREMONT INC.: Un anticuerpo, que comprende una cadena pesada y una cadena ligera, donde: a) la cadena pesada comprende: 1) una secuencia de aminoácidos recogida […]