Inhibición mediada por interferencia de ARN de una expresión de gen usando ácido nucleico de interferencia corto (ANic).
Una molécula de ácido nucleico de interferencia corto (ANic) sintética modificada químicamente capaz de regular deforma negativa la expresión de un gen diana en células por interferencia de ARN (ARNi),
en la que el ANic comprende:
(a) una cadena con sentido y una cadena antisentido;
(b) cada cadena de la molécula de ácido nucleico es de forma independiente de 18 a 24 nucleótidos de longitud y ladoble cadena de ANic comprende de 17 a 23 pares de bases;
(c) 5, 6, 7, 8, 9 ó 10 nucleótidos de pirimidina de la cadena con sentido y/o 5, 6, 7, 8, 9 ó 10 nucleótidos de pirimidinade la antisentido se modifican químicamente con nucleótidos 2'-desoxi, 2'-O-metil y/o 2'-desoxi-2'-fluoro; y
(d) uno o más enlaces internucleotídicos de fosforotioato y/o una molécula de recubrimiento terminal en el extremo3', en el extremo 5' o los extremos tanto 3' como 5', que está presente en la misma o diferente cadena del ANic.
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E10008930.
Solicitante: SIRNA THERAPEUTICS, INC.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 2950 WILDERNESS PLACE BOULDER, CO 80301 ESTADOS UNIDOS DE AMERICA.
Inventor/es: USMAN, NASSIM, BEIGELMAN, LEONID, CHOWRIRA,BHARAT, PAVCO,PAMELA, MCSWIGGEN,JAMES, JAMISON,SHARON, FOSNAUGH,KATHY, THOMPSON,JAMES.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/713 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › Acidos nucleicos u oligonucleótidos con estructura en doble hélice.
- C12N15/113 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Acidos nucleicos no codificantes que modulan la expresión de genes, p.ej. oligonucleótidos antisentido.
PDF original: ES-2394269_T3.pdf
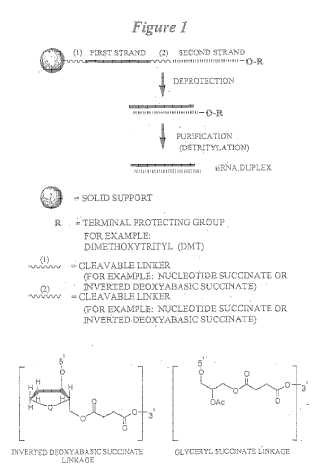
Fragmento de la descripción:
Inhibicion mediada por interferencia de ARN de una expresión de gen usando ácido nucleico de interferencia corto (ANic)
La presente invención reivindica el beneficio de los documentos USSN 60/358.580 de Beigelman presentado el 20 de febrero de 2002, USSN 60/363.124 de Beigelman presentado el 11 de marzo de 2002, USSN 60/386.782 de Beigelman presentado el 6 de junio de 2002, USSN 60/406.784 de Beigelman presentado el 29 de agosto de 2002, USSN 60/408.378 de Beigelman presentado el 5 de septiembre de 2002, USSN 60/409.293 de Beigelman presentado el 9 de septiembre de 2002 y USSN 60/440.129 de Beigelman presentado el 15 de enero de 2003. La totalidad, incluyendo los dibujos, de dichas solicitudes se incorporan en el presente documento por referencia.
Campo de la Invención
La presente invención se refiere a procedimientos y reactivos útiles para modular la expresión génica en una diversidad de aplicaciones, incluyendo el uso en aplicaciones terapéuticas, de diagnóstico, de validación de dianas y descubrimiento genómico. Específicamente, la invención se refiere a moléculas pequeñas de ácido nucleico, tales como moléculas de ácido nucleico de interferencia corto (ANic) , ARN de interferencia corto (ARNic) , ARN bicatenario (ARNbc) , micro-ARN (miARN) y ARN de horquilla corto (ARNhc) capaces de mediar la interferencia de ARN (iARN) .
Antecedentes de la invención
Lo siguiente es una discusión de la técnica pertinente que concierne a la iARN. La discusión se proporciona sólo para la comprensión de la siguiente invención. El sumario no es una admisión de que cualquiera de los trabajos descritos más adelante sea de la técnica anterior a la invención reivindicada. En el presente documento el solicitante demuestra que los ácidos nucleicos de interferencia cortos modificados químicamente poseen la misma capacidad para mediar la iARN que las moléculas de ARNic, y se espera que posean una estabilidad y actividad in vivo mejoradas; por lo tanto, esta discusión no tiene por objeto limitarse sólo a ARNic y puede aplicarse a ANic de manera general.
La interferencia de ARN se refiere al procedimiento de silenciamiento génico postranscripcional específico de secuencia en animales mediado por los ARN de interferencia cortos (ARNic) (Fire y col., 1998, Nature, 391, 806) . El procedimiento correspondiente en plantas se denomina comúnmente silenciamiento génico postranscripcional o silenciamiento de ARN, y también se denomina supresión en hongos. Se piensa que el procedimiento de silenciamiento génico postranscripcional es un mecanismo de defensa celular conservado de forma evolutiva usado para evitar la expresión de genes extraños, y flora y filos diversos lo comparten comúnmente (Fire y col., 1999, Trends Genet., 15, 358) . Dicha protección frente a la expresión de genes extraños puede haber evolucionado como respuesta a la producción de ARN bicatenarios (ARNbc) derivados de una infección viral o de la integración aleatoria de elementos transponibles en un genoma huésped mediante una respuesta celular que destruye específicamente ARN monocatenario homólogo o ARN genómico viral. La presencia de ARNbc en células desencadena la respuesta de iARN a través de un mecanismo que aún tiene que caracterizarse completamente. Este mecanismo parece ser diferente de la respuesta de interferón que se produce como resultado de la activación mediada por ARNbc de la proteína quinasa PKR y 2’, 5’-oligoadenilato sintetasa, dando como resultado una escisión inespecífica del ARNm por la ribonucleasa L.
La presencia de ARNbc largos en células estimula la actividad de una enzima ribonucleasa III denominada dicer. La dicer está implicada en el procesamiento de los ARNbc en trozos cortos de ARNbc conocidos como ARN de interferencia cortos (ARNic) (Berstein y col., 2001, Nature, 409, 363) . Los ARN de interferencia cortos derivados de la actividad de dicer típicamente tienen de aproximadamente 21 a aproximadamente 23 nucleótidos de longitud y comprenden dúplex de aproximadamente 19 pares de bases (Elbashir y col., 2001, Genes Dev., 15, 188) . También se ha implicado a dicer en la escisión de ARN temporales pequeños (ARNtp) de 21 y 22 nucleótidos a partir de ARN precursor de estructura conservada que están implicados en el control traduccional (Hutvagner y col., 2001, Science, 293, 834) . La respuesta de iARN también presenta un complejo de endonucleasa, denominado comúnmente complejo de silenciamiento inducido por ARN (RISC) , que media la escisión de ARN monocatenario que tiene una secuencia complementaria a la cadena antisentido del dúplex de ARNic. La escisión del ARN diana tiene lugar en el centro de la región complementaria a la cadena antisentido del dúplex de ARNic (Elbashir y col., 2001, Genes Dev., 15, 188) .
La iARN se ha estudiado en una diversidad de sistemas. Fire y col., 1998, Nature, 391, 806, fueron los primeros en observar la iARN en C. elegans. Wianny y Goetz, 1999, Nature Cell Biol., 2, 70, describen la iARN mediada por ARNbc en embriones de ratón. Hammond y col., 2000, Nature, 404, 293, describen la iARN en células de Drosophila transfectadas con ARNbc. Elbashir y col., 2001, Nature, 411, 494, describen la iARN inducida introduciendo dúplex de ARN sintéticos de 21 nucleótidos en células de mamífero cultivadas incluyendo células embrionarias de riñón humano y células HeLa. Trabajos recientes en lisados embrionarios de Drosophila (Elbashir y col., 2001, EMBO J., 20, 6877) han revelado determinados requisitos de longitud, estructura, composición química y secuencia de ARNic que son esenciales para mediar una actividad de iARN eficaz. Estos estudios han demostrado que los dúplex de ARNic de 21 nucleótidos son más activos cuando contienen salientes dinucleotídicos 3’terminales. Además, la sustitución completa de una o ambas cadenas de ARNic con nucleótidos 2’-desoxi (2’-H) o 2’-O-metilo suprime la actividad de iARN, mientras que se demostró que se toleraba la sustitución de los nucleótidos salientes de ARNic 3’-terminales con 2’-desoxi nucleótidos (2’-H) . También se demostró que secuencias con un solo emparejamiento erróneo en el centro del dúplex de ARNic suprimía la actividad de iARN. Además, estos estudios también indican que la posición del sitio de escisión en el ARN diana está definida por el extremo 5’ de la secuencia guía de ARNic en lugar del extremo 3’ de la secuencia guía (Elbashir y col., 2001, EMBO J., 20, 6877) . Otros estudios han indicado que es necesario un fosfato 5’ en la cadena complementaria diana de un dúplex de ARNic para la actividad del ARNic y que, para mantener el resto fosfato 5’ en el ARNic, se utiliza ATP (Nykanen y col., 2001, Cell, 107, 309) .
Los estudios han demostrado que la sustitución de los segmentos salientes de nucleótidos 3’-terminales de un dúplex de ARNic de 21 unidades, que tiene salientes 3’ de dos nucleótidos, con desoxirribonucleótidos no tiene un efecto adverso sobre la actividad de iARN. Se ha indicado que la sustitución de hasta cuatro nucleótidos en cada extremo del ARNic con desoxirribonucleótidos se tolera bien, mientras que la sustitución completa con desoxirribonucleótidos da como resultado la ausencia de actividad de iARN (Elbashir y col., 2001, EMBO J., 20, 6877) . Además, Elbashir y col., anteriormente, también indican que la sustitución de ARNic con nucleótidos 2’-Ometilo suprime completamente la actividad de iARN. Li y col., Publicación Internacional PCT Nº WO 00/44914, y Beach y col., Publicación Internacional PCT Nº WO 01/68836 sugieren de forma preliminar que el ARNic puede incluir modificaciones en la cadena principal de azúcar-fosfato o en el nucleósido para incluir al menos uno de un heteroátomo de nitrógeno o de azufre, sin embargo, ninguna solicitud postula en qué medida se tolerarían tales modificaciones en moléculas de ARNic, ni proporciona ninguna orientación adicional o ejemplos de dicho ARNic modificado. Kreutzer y col., solicitud de patente canadiense Nº 2.359.180, también describen determinadas modificaciones químicas para su uso en construcciones de ARNbc con el fin de contrarrestar la activación de la proteína quinasa PKR dependiente de ARN bicatenario, específicamente nucleótidos 2’-amino o 2’-O-metilo y nucleótidos que contienen un puente de 2’-O-o 4’-C-metileno. Sin embargo, de manera similar, Kreutzer y col. no proporcionan ejemplos u orientaciones con respecto a en qué medida se tolerarían estas modificaciones en moléculas de ARNic.
Parrish y col., 2000, Molecular Cell, 6,... [Seguir leyendo]
Reivindicaciones:
1. Una molécula de ácido nucleico de interferencia corto (ANic) sintética modificada químicamente capaz de regular de forma negativa la expresión de un gen diana en células por interferencia de ARN (ARNi) , en la que el ANic comprende:
(a) una cadena con sentido y una cadena antisentido;
(b) cada cadena de la molécula de ácido nucleico es de forma independiente de 18 a 24 nucleótidos de longitud y la doble cadena de ANic comprende de 17 a 23 pares de bases;
(c) 5, 6, 7, 8, 9 ó 10 nucleótidos de pirimidina de la cadena con sentido y/o 5, 6, 7, 8, 9 ó 10 nucleótidos de pirimidina de la antisentido se modifican químicamente con nucleótidos 2’-desoxi, 2’-O-metil y/o 2’-desoxi-2’fluoro; y
(d) uno o más enlaces internucleotídicos de fosforotioato y/o una molécula de recubrimiento terminal en el extremo 3’, en el extremo 5’ o los extremos tanto 3’ como 5’, que está presente en la misma o diferente cadena del ANic.
2. La molécula de ANic de la reivindicación 1, en la que la molécula de ANic comprende dos fragmentos oligonucleotídicos separados, en la que un fragmento comprende la región con sentido y un segundo fragmento comprende la región antisentido y en la que el fragmento que comprende la región con sentido incluye un resto de recubrimiento terminal en el extremo 5’, el extremo 3’ o los extremos tanto 5’ como 3’.
3. La molécula de ANic de la reivindicación 2, en la que los nucleótidos de purina en la región con sentido son nucleótidos de 2’-desoxi purina y en la que los nucleótidos de pirimidina en la región con sentido son 2’-desoxi-2’fluoro pirimidina.
4. La molécula de ANic de la reivindicación 2, en la que los nucleótidos de pirimidina de la región antisentido son nucleótidos 2’-desoxi-2’-fluoro pirimidina y en la que los nucleótidos de purina en la región antisentido son nucleótidos de 2’-O-metil purina.
5. La molécula de ANic de la reivindicación 2, en la que los nucleótidos de purina presentes en la región antisentido son nucleótidos de 2’-desoxi purina y en la que los nucleótidos de pirimidina presentes en la región antisentido son nucleótidos de 2’-desoxi-2’-fluoro pirimidina.
6. La molécula de ANic de una cualquiera de las reivindicaciones 2, 4 y 5, en la que la región antisentido comprende un enlace internucleotídico de fosforotioato en el extremo 3’ de la región antisentido.
7. La molécula de ANic de la reivindicación 2, en la que cada uno de los dos fragmentos de la molécula de ANic comprende 21 nucleótidos.
8. La molécula de ANic de la reivindicación 2, en la que 19 nucleótidos de cada fragmento de la molécula ANic forman pares de bases con los nucleótidos complementarios del otro fragmento de la molécula de ANic y en la que al menos dos nucleótidos 3’ terminales de cada fragmento de la molécula de ANic no forman pares de bases con los nucleótidos del otro fragmento de la molécula de ANic.
9. La molécula de ANic de la reivindicación 2, en la que 19 nucleótidos de la región antisentido forman pares de bases con la secuencia de nucleótidos del ARN que codifica el gen diana o una parte del mismo.
10. La molécula de ANic de la reivindicación 2, en la que 21 nucleótidos de la región antisentido forman pares de bases con la secuencia de nucleótidos del ARN que codifica el gen diana o una parte del mismo.
11. La molécula de ANic de la reivindicación 2, en la que los nucleótidos de purina en la región con sentido son ribonucleótidos de purina, y en la que los nucleótidos de pirimidina en la región con sentido son nucleótidos de 2’desoxi-2’-pirimidina y en la que el fragmento con sentido incluye un resto de recubrimiento terminal en los extremos 5’ y3’.
12. La molécula de ANic de la reivindicación 2, en la que los nucleótidos de purina en la región con sentido son ribonucleótidos de purina, y en la que nucleótidos de pirimidina en la región con sentido son nucleótidos de 2’-Ometil pirimidina y en la que el fragmento con sentido incluye un resto de recubrimiento terminal en los extremos 5’ y 3’.
13. La molécula de ácido nucleico de la reivindicación 1, en la que 5, 6, 7, 8, 9 ó 10 nucleótidos de pirimidina en la cadena con sentido son nucleótidos de 2’-desoxi pirimidina.
14. La molécula de ácido nucleico de la reivindicación 1, en la que 5, 6, 7, 8, 9 ó 10 nucleótidos de pirimidina en la cadena con sentido son nucleótidos de 2’-O-metil pirimidina.
15. La molécula de ácido nucleico de la reivindicación 1, en la que 5, 6, 7, 8, 9 ó 10 nucleótidos de pirimidina en la cadena con sentido son nucleótidos 2’-desoxi-2’-fluoro pirimidina.
16. La molécula de ácido nucleico de la reivindicación 1, en la que 5, 6, 7, 8, 9 ó 10 nucleótidos de pirimidina en la cadena antisentido son nucleótidos de 2’-O-metil pirimidina.
17. La molécula de ácido nucleico de la reivindicación 1, en la que 5, 6, 7, 8, 9 ó 10 nucleótidos de pirimidina en la cadena antisentido son nucleótidos de 2’-desoxi-2’-fluoro pirimidina.
18. La molécula de ácido nucleico de cualquier reivindicación previa, en la que el resto de recubrimiento terminal es un resto desoxi abásico invertido.
19. La molécula de ácido nucleico de cualquier reivindicación previa, que comprende 1, 2, 3, 4, 5, 6, 7, 8, 9 ó 10 enlaces internucleotídicos de fosforotioato.
20. La molécula de ácido nucleico de cualquier reivindicación previa, en la que la molécula de ácido nucleico comprende ribonucleótidos.
21. La molécula de ácido nucleico de cualquier reivindicación previa, en la que el ARN diana es una secuencia de ARN de mamífero.
22. La molécula de ácido nucleico de cualquier reivindicación previa, en la que el ARN diana es una secuencia de ARN humano.
23. La molécula de ácido nucleico de la reivindicación 22, en la que la secuencia de ARN humano comprende secuencias de VEGFr-1, VEGFr-2, HER1, HER2, HER3, HER4, TERT, ARN de telomerasa, NFkappaB, Rel-A, NOGO, NOGOr, RAS, RAF, CD20, METAP2, CLCA1, fosfolamban o PTP1B humanas.
24. La molécula de ácido nucleico de una cualquiera de las reivindicaciones 1 a 20, en la que el ARN diana es una secuencia de ARN viral.
25. La molécula de ácido nucleico de la reivindicación 24, en la que la secuencia de ARN viral comprende secuencia de VHB, VHC, VIH-1, VIH-2, WNV, CMV, VSR, virus de la gripe, rinovirus, virus del papiloma, VHS o HTLV.
26. Una composición que comprende la molécula de ácido nucleico de cualquier reivindicación previa y un vehículo o diluyente farmacéuticamente aceptable.
Patentes similares o relacionadas:
 Compuestos que modulan la actividad de señalización de las interleucinas 17 y 23, del 29 de Julio de 2020, de Sarepta Therapeutics, Inc: Un método ex vivo de modulación de la actividad de señalización de IL-17 en una célula, que comprende poner en contacto la célula con un oligómero antisentido de morfolino […]
Compuestos que modulan la actividad de señalización de las interleucinas 17 y 23, del 29 de Julio de 2020, de Sarepta Therapeutics, Inc: Un método ex vivo de modulación de la actividad de señalización de IL-17 en una célula, que comprende poner en contacto la célula con un oligómero antisentido de morfolino […]
Método para producir inmunoconjugados de anticuerpo-SN-38 con un enlazador CL2A, del 22 de Julio de 2020, de IMMUNOMEDICS, INC.: Un método para producir un compuesto, CL2A-SN-38, que presenta la estructura, **(Ver fórmula)** que comprende realizar un esquema de reacción como el que se muestra: **(Ver […]
Terapia mediada por ARN interferente para enfermedades neurodegenerativas, del 24 de Junio de 2020, de Università Degli Studi Di Trento: Agente terapéutico para su uso en el tratamiento de enfermedades neurodegenerativas asociadas con anomalías de la proteína tau codificada […]
Composiciones para modular la expresión de SOD-1, del 24 de Junio de 2020, de Biogen MA Inc: Un compuesto antisentido según la siguiente fórmula: mCes Aeo Ges Geo Aes Tds Ads mCds Ads Tds Tds Tds mCds Tds Ads mCeo Aes Geo mCes Te (secuencia […]
Compuestos oligonucleotídicos dirigidos a ARNm de huntingtina, del 3 de Junio de 2020, de UNIVERSITY OF MASSACHUSETTS: Una molécula de ARN que tiene una longitud entre 15 y 35 bases, que comprende una región de complementariedad que es completamente complementaria a 5' CAGUAAAGAGAUUAA 3' […]
Oligonucleótidos TGF-beta modificados, del 29 de Abril de 2020, de ISARNA Therapeutics GmbH: Oligonucleótido que consiste en CAAAGTATTTGGTCTCC (SEQ ID NO. 46), en el que los nucleótidos en negrita son oligonucleótidos modificados con LNA, complementarios […]
Agente de direccionamiento para células cancerosas o fibroblastos asociados con cáncer, del 29 de Abril de 2020, de NITTO DENKO CORPORATION: Composición para su uso en el tratamiento de cáncer en el que están implicados fibroblastos asociados con cáncer, caracterizada porque la composición comprende un portador […]
Lípido catiónico, del 29 de Abril de 2020, de TAKEDA PHARMACEUTICAL COMPANY LIMITED: Un compuesto representado por la fórmula: **(Ver fórmula)** donde, W denota la fórmula -NR1R2 o la fórmula -N+R3R4R 5(Z-); R1 y R2 denotan, cada uno de forma independiente, […]